4种子宫内膜准备方案在冻融胚胎移植中的应用价值*
2015-03-14陈彩蓉王秋香李艳红邱佩嫦
陈彩蓉,全 松,王秋香,李艳红,邱佩嫦
(1.南方医科大学南方医院妇产科生殖医学中心,广州510515;
2.广东省清远市人民医院/广州医科大学附属第六医院生殖医学中心 511518)
冻融胚胎移植(frozen-thawed embryo transfer,FET)是人类辅助生殖技术的一项常规技术,用于体外受精(IVF)/卵胞浆内单精子注射(ICSI)新鲜周期移植后仍有剩余胚胎或因各种因素行全胚冷冻的患者。FET的成功取决于胚胎质量、子宫内膜的容受性及胚胎与子宫内膜发育的同步性等因素,其中,在胚胎质量既定的情况下,提高子宫内膜的容受性是提高FET妊娠率的关键。因此,冻融胚胎的内膜准备方案一直是临床医生探讨的热点问题。本研究回顾性分析清远市人民医院生殖医学中心2013年3月至2015年3月共320个FET周期内膜的不同准备方法,比较胚胎种植率、临床妊娠率、流产率、多胎妊娠率等指标,探讨不同内膜准备方案对妊娠结局的影响,以便更好地进行个体化的FET周期内膜准备工作,进一步改善FET的治疗结局。
1 资料与方法
1.1 一般资料 选择清远市人民医院生殖医学中心2013年3月至2015年3月因新鲜胚胎移植失败或全胚冷冻而进行的FET,共265例患者,320个周期,其中原发性不孕142周期,继发性不孕178周期。IVF 278个周期,ICSI 42个周期。年龄22~49岁,平均(32.7±5.26)岁;不孕时间1~19年,平均(4.85±3.81)年;BMI(21.76±2.60)kg/m2;平均移植胚胎数为(1.91±0.50)个。所有患者移植前均B超或宫腔镜检查排除内膜病变。
1.2 方法
1.2.1 子宫内膜准备方案 按子宫内膜准备方案的不同,分为以下4组:自然周期组(A组)70个周期,促排卵组(B组)152个周期,激素替代组(C组)74个周期,降调后激素替代组(D组)24个周期。各组均于月经第2~3天上午抽取静脉血2 mL行基础性激素检测,并行阴道B超排除子宫及卵巢异常情况。A组:适用于平素月经周期规则,自然周期监测有排卵者。在自然月经周期第10天开始B超和血清黄体生成激素(LH)、雌二醇(E2)及孕酮(P)监测卵泡发育及内膜发育情况,至卵泡破裂,排卵后3d行FET[受精第3天(D3)冷冻胚胎,胚胎数目小于或等于2枚],自排卵后予黄体酮40~60mg/d行黄体支持。B组:应用他莫昔芬(TMX)/人绝经促性腺激素(HMG)或来曲唑(LE)/HMG促排卵,适用于排卵障碍、黄体功能不足及子宫内膜过薄患者。患者于月经或撤退性出血的第3~5天口服TMX 20~40mg/d或LE 2.5~5.0mg/d,月经第10天B超监测卵泡发育及内膜发育情况,若卵泡直径小于或等于10mm,则加HMG 75~150IU/d隔日肌内注射,直至子宫内膜大于或等于8mm,卵泡直径大于或等于18mm时,肌内注射人绒毛膜促性腺激素(HCG)4 000~10 000IU诱发排卵。若HCG注射日黄体生成素(LH)≥20IU/mL,则当日下午15:00~17:00肌内注射HCG注射,4d后行FET;若 HCG注射日LH<20IU/mL,则当晚21:00肌内注射 HCG,5d后行FET(移植D3冷冻胚胎,胚胎数目小于或等于2枚)。自排卵后予黄体酮40~60mg/d行黄体支持。C组:适用于所有行FET者,尤其月经不规律及子宫内膜薄的患者。从月经或撤退性出血的第2~3天起,予口服戊酸雌二醇2~8mg/d,7d后根据B超监测子宫内膜厚度,若厚度大于或等于7mm,维持原剂量7d;若厚度小于7mm,酌情增加戊酸雌二醇剂量,最高剂量为15mg/d。当内膜大于或等于8mm时,肌内注射黄体酮40~80mg/d行黄体酮转化,在给黄体酮第4天行FET(移植D3冷冻胚胎,胚胎数目小于或等于2枚);移植后继续予戊酸雌二醇和黄体酮支持黄体。D组:适用于子宫内膜异位症、子宫肌瘤及胚胎优良而其他子宫内膜准备方案周期失败患者。于月经周期第2~3天肌内注射促性腺激素释放激素激动剂(GnRHa)制剂(达菲林或抑那通)3.75mg,隔28d注射1~3次,末次注射后30~40d,予口服戊酸雌二醇6~8mg/d,7d后根据B超监测子宫内膜厚度,酌情调整戊酸雌二醇剂量,最高剂量为15mg/d;内膜大于或等于8mm时,肌内注射黄体酮60~80mg/d行黄体酮转化,在给黄体酮第4天行FET(移植D3冷冻胚胎,胚胎数目小于或等于2枚);移植后继续予戊酸雌二醇和黄体酮支持黄体。
1.2.2 新鲜胚胎评分标准 经IVF或ICSI获得的新鲜胚胎根据原核评分方法(Z分级)和D3胚胎评分而分为优质和可用胚胎。优质胚胎:受精第1天(D1)原核评分为Z1或Z2,D3卵裂球数为7~10个的Ⅰ级或Ⅱ级的胚胎;可用胚胎:D3细胞数4个细胞以上的Ⅰ、Ⅱ、Ⅲ级胚胎。其中原核评分在受精后16~18h进行,分为Z1~Z4级(Z1级:每个原核核仁数3~7个,核仁在原核相交处排列成线;Z2级:原核大小相等,但核仁不成线排列在原核相交处;Z3级:两原核特征不同,核仁的大小、数目不等,不排列在原核相接处;Z4级:原核大小明显不等,原核相离)。D3胚胎评分在受精后的(68±1)h进行,分为Ⅰ~Ⅳ级(Ⅰ级:卵裂球大小均匀,形状规则,胞质均匀、清晰,胚胎内碎片小于10%;Ⅱ级:卵裂球大小略不规则;胞质可有颗粒现象,碎片在11%~20%;Ⅲ级:卵裂球大小明显不均,可有明显的形状不规则,胞质可有明显颗粒现象,碎片在21%~50%;Ⅳ级:细胞大小严重不均匀,胞质可有严重颗粒现象,碎片在50%以上)。
1.2.3 胚胎冷冻和解冻方法 冷冻D3达到优质胚胎和可用胚胎评分标准的胚胎,采用玻璃化冷冻和解冻程序(均采用日本加藤公司相应冷冻和解冻试剂)。
1.2.4 胚胎解冻后存活标准 冻融胚胎50%以上卵裂球存活,胚胎判断为存活。
1.2.5 妊娠结局的判断 胚胎移植后9d查血清β-HCG≥10 IU/mL为生化妊娠,阳性者2周后超声检查,见孕囊即诊断为临床妊娠。
1.3 统计学处理 数据采用SPSS19.0软件进行统计分析,计量资料采用x±s表示,组间比较采用方差分析;计数资料用率表示,组间比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结 果
2.1 4组患者取卵周期的一般情况比较 4种子宫内膜准备方案的患者取卵周期在年龄、BMI、不孕年限、继发不孕症比例、输卵管因素不孕所占比例、ICSI周期比例等方面差异无统计学意义(P>0.05)。但A组基础FSH值、基础FSH/LH比值显著高于其他3组(P<0.05),获卵数、正常受精数和冷冻胚胎数显著低于其他3组(P<0.05);B、C、D组之间差异无统计学意义,见表1。
2.2 4组患者FET周期的一般情况和胚胎解冻情况比较
在FET周期中,4种子宫内膜准备方案的患者在年龄、FET日E2水平、FET日内膜厚度、胚胎冷冻至解冻时间、移植胚胎数、胚胎复苏率和移植优质胚胎率等方面差异无统计学意义(P>0.05),但D组FET周期次数显著高于其他3组(P<0.05),见表2。
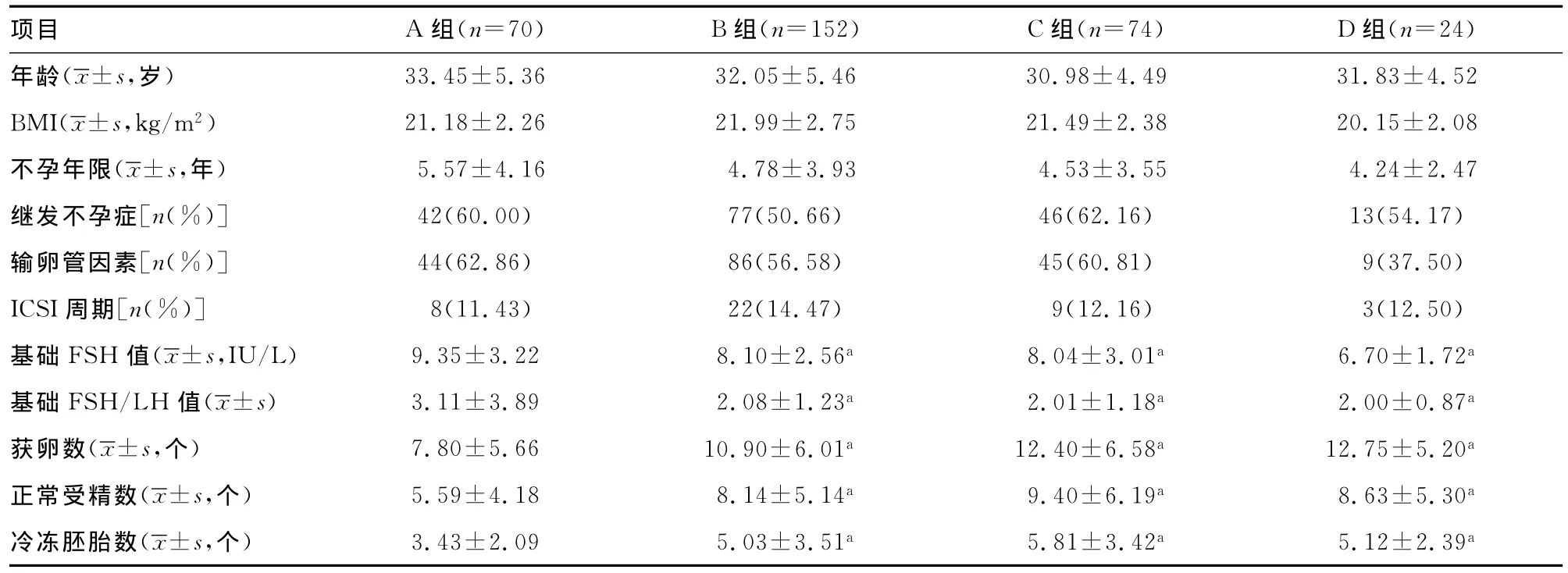
表1 4组患者取卵周期的一般情况比较

表2 4组患者FET周期的一般情况和胚胎解冻情况比较

表3 4种子宫内膜准备方案FET结局比较[%(n/n)]
2.3 4组患者FET的临床结局比较 4组患者的临床妊娠率和胚胎种植率比较,差异有统计学意义(P<0.05),其中A组临床妊娠率显著低于B、C、D组(P<0.05),而B、C、D组间比较差异无统计学意义(P>0.05);A组胚胎种植率低于B、C、D组(P<0.05),B组低于C组(P<0.05),C、D两组间差异无统计学意义(P>0.05)。4组的多胎妊娠率、生化妊娠率、早期妊娠流产率和异位妊娠率等方面比较,差异均无统计学意义(P>0.05),见表3。
3 讨 论
子宫内膜的准备工作在FET过程中起着至关重要的作用,决定着子宫内膜的容受性及内膜与胚胎发育的同步性,因此,临床医生对子宫内膜准备方法的选择和用药显得格外重要。目前用于FET准备子宫内膜常见的方案有:自然周期、促排卵周期、激素替代周期等,而何种方案最优,尚没有达成统一共识[1]。
在各种子宫内膜准备方案中,自然周期方案用药最为简单,是一种经济、并且更符合生理的方案,适用于排卵正常的患者。常根据是否采用外源性HCG诱发排卵而分为改良自然周期和纯粹自然周期[1],在FET中,研究显示,改良自然周期的临床妊娠率、种植率和活产率与纯粹自然周期相似[1-4],或优于纯粹自然周期[5-6];自然周期与激素替代周期方案可获得相似的种植率和妊娠率[1,7]。本研究采用改良自然周期方案实施70个周期FET,通过B超监测和查血E2、LH及P水平确定排卵时间、排卵后给予黄体酮支持,选择排卵后3d行超声引导下胚胎移植,移植日子宫内膜厚度为(10.14±1.70)mm,胚胎种植率和临床妊娠率分别为22.90%和32.86%,与文献报道的种植率(20.4%)和临床妊娠率(33.3%)的结论相近[7],但显著低于本中心促排卵组、降调或非降调后激素替代周期组的胚胎种植率和临床妊娠率。其原因可能是在本研究行自然周期FET患者取卵周期的年龄(33.45±5.36)岁高于其他3组[(32.05±5.46)、(30.98±4.49)、(31.83±4.52)岁],虽然差异并无统计学意义(P>0.05),但A组患者的基础FSH和FSH/LH 值均显著高于其他3组(P<0.05),获卵数(7.80±5.66)个也低于其他3组(P<0.05),说明本研究在自然周期FET患者的选择上偏向于卵巢储备较低和年龄较大的患者,其出发点在于高龄的患者行激素替代周期往往面临更高的血栓栓塞的风险,这可能也是本中心自然周期FET妊娠率较其他3组偏低的原因。
尽管自然周期方案有用药少,更符合生理的优点,但由于在行FET的患者中仅有30%存在规律的排卵周期[8],且自然周期中有5%~6%患者子宫内膜过薄而取消移植周期[9]。因此,仍有很大部分患者需要采用其他方案准备子宫内膜,如激素替代周期或促排卵周期。激素替代周期方案最初是为了赠卵周期而设计的,后来发现同样适用于FET的患者[10]。由于该方案需要较少次的监测,雌激素的补充减少了由于子宫内膜过薄导致的取消周期,且具有工作计划性强、容易掌握等优点,近年在临床也得到了广泛的使用。激素替代周期方案采用外源性雌孕激素模拟自然周期内源性激素的周期变化,使血清雌激素水平升高与内膜厚度增加同步化,同时通过孕激素的给予来控制种植窗的开放,进而使子宫内膜与胚胎发育同步来提高妊娠率。有研究认为,在激素替代周期采用GnRHa进行垂体降调节可显著提高临床妊娠率和活产率[11],而另一些作者则认为有无预降调并不会影响临床妊娠结局[12]。本研究实施了74个激素替代周期和24个GnRH-a降调的激素替代周期FET,激素替代组和降调后激素替代组临床妊娠率和种植率分别为64.86%vs.58.33%和43.62%vs.40.42%,组间比较差异无统计学意义(P>0.05)。然而,本研究降调后激素替代组患者FET累积次数显著高于其余3组,说明经过其他子宫内膜准备方案失败的患者,在重复FET周期中采用降调后激素替代方案,仍可获得较满意的种植率和临床妊娠率。这与吴晓燕等[13]的研究相一致。降调后激素替代方案妊娠率提高的原因可能有以下几个方面:(1)由于未降调激素替代仍有可能优势卵泡发育及排卵[14],此外,即使在无优势卵泡生长的情况下未降调组也可能出现类似排卵前的LH峰,并作用于子宫内膜上的LH受体,进而影响子宫内膜容受性。GnRHa降调可以消除以上2个方面的不利因素。(2)子宫内膜组织亦可能存在GnRH受体,降调可能会改善子宫腔种植环境而提高子宫内膜容受性。
激素替代周期方案提高了子宫内膜与胚胎发育的同步性,进一步改善了FET的妊娠率,但其缺点是患者需要服用长达10周的药物,给患者增加了身体的负担(如肝脏负担、血栓性疾病风险等);此外,降调后激素替代方案中患者还可能出现低雌激素症状。因此对于部分不适合自然周期、降调或非降调激素替代的患者,如:排卵障碍、高龄患者,本中心采用促排卵方案准备子宫内膜共152周期,也取得了较好的临床效果,临床妊娠率和种植率虽然低于激素替代方案组,但患者经促排卵后具有健全的黄体,因此无需长期使用雌孕激素支持黄体,减轻了患者经济和身体负担。因此,促排卵方案对于排卵障碍且具有激素替代禁忌证的患者来说,无疑是一项不错的选择。其缺点在于部分患者,尤其是多囊卵巢综合征患者,促排卵治疗具有发生卵巢过度刺激综合征及诱导排卵失败而导致周期取消的风险,治疗过程中应严格监测。
本研究通过对320个FET周期进行回顾性分析得出,与自然周期方案相比较,促排卵、降调或非降调激素替代方案均可获得更高的临床妊娠率和种植率,其中降调后激素替代方案在既往移植失败患者中仍具有较好的临床效果,值得临床借鉴。
[1] Groenewoud ER,Cantineau AE,Kollen BJ,et al.What is the optimal means of preparing the endometrium in frozen-thawed embryo transfer cycles?A systematic review and meta-analysis[J].Hum Reprod Update,2013,19(5):458-470.
[2] 康艳,匡延平.冻融胚胎移植周期内膜准备方案的进展[J].生殖与避孕,2012,32(7):478-481.
[3] Weissman A,Horowitz E,Ravhon A,et al.Spontaneous ovulation versus HCG triggering for timing natural-cycle frozen-thawed embryo transfer:a randomized study[J].Reprod Biomed Online,2011,23(4):484-489.
[4] Tomas C,Alsbjerg B,Martikainen H,et al.Pregnancy loss after frozen-embryo transfer-a comparison of three protocols[J].Fertil Steril,2012,98(5):1165-1169.
[5] Chang EM,Han JE,Kim YS,et al.Use of the natural cycle and vitrification thawed blastocyst transfer results in better in-vitro fertilization outcomes:cycle regimens of vitrification thawed blastocyst transfer[J].J Assist Reprod Genet,2011,28(4):369-374.
[6] 刘景瑜,王玢,孔娜,等.自然周期使用hCG诱导排卵对冻融胚胎移植临床结局的影响[J].生殖与避孕,2014,34(10):871-874.
[7] 王青丽,巩晓芸,田海清,等.自然周期和人工周期方案对解冻胚胎移植妊娠结局的影响[J].新疆医科大学学报,2014,27(4):389-391.
[8] Krotz S,Mckenzie LJ,Cisneros P,et al.Prevalence of premature urinary luteinizing hormone surges in women with regular menstrual cycles and its effect on implantation of frozen-thawed embryos[J].Fertil Steril,2005,83(6):1742-1744.
[9] Sathanandan M,Macnamee MC,Rainsbury P,et al.Replacement of frozen-thawed embryos in artificial and natural cycles:aprospective semi-randomized study[J].Hum Reprod,1991,6(5):685-687.
[10]Younis JS,Simon A,Laufer N.Endometrial preparation:Lessons from oocyte donation[J].Fertil Steril,1996,66(6):873-884.
[11]Hill MJ,Miller KA,Frattarelli JL.A GnRH agonist and exogenous hormone stimulation protocol has a higher live-birth rate than a natural endogenous hormone protocol for frozen-thawed blastocyst-stage embryo transfer cycles:an analysis of 1 391cycles[J].Fertil Steril,2010,93(2):416-422.
[12]Azimi Nekoo E,Chamani M,Shahrokh Tehrani E,et al.Artificial endometrial preparation for Frozen-Thawed embryo transfer with or without pretreatment with depot gonadotropin releasing hormone agonist in women with regular menses[J].J Family Reprod Health,2015,9(1):1-4.
[13]吴晓燕,李志凌,林虹,等.多次胚胎移植失败患者采用冻融胚胎移植3种内膜准备方案结局分析[J].中国计划生育学杂志,2014,22(4):248-251,254.
[14]Zheng Y,Li Z,Xiong M,et al.Hormonal replacement treatment improves clinical pregnancy in frozen-thawed embryos transfer cycles:a retrospective cohort study[J].Am J Transl Res,2014,6(1):85-90.
