白藜芦醇对β淀粉肽1~42刺激内皮细胞炎症因子表达的影响*
2015-03-14李焱平刘礼富胡高强
李焱平,刘礼富,胡高强,张 静,姜 鲜△
(1.四川省泸县人民医院检验科646100;2.泸州医学院附属医院麻醉科,四川泸州646000)
β淀粉样蛋白(βamyloid protein,Aβ)沉积导致血管内皮损伤是阿尔茨海默病(alzheimer disease,AD)发病机制之一[1]。白藜芦醇是多年生草本植物蓼科蓼属虎杖的根茎中的提取物,分子式为C14H12O3,相对分子质量为228.25,白色针状晶体[2]。广泛存在于葡萄、花生、虎杖等天然食物或药物中,以虎杖中含量最高,具有抗炎、抗血小板聚集、抗氧化等生物药理活性[3-4]。但是白藜芦醇能否减少 Aβ1~42致人脐静脉内皮细胞(HUVEC)炎症因子释放,提高 Aβ1~42刺激后 HUVEC活性目前还不清楚。据此,本文通过观察不同剂量白藜芦醇对Aβ1~42刺激后 HUVEC细胞活性及炎性因子IL-6、IL-1、TNF-α释放关系,为白藜芦醇用于治疗AD提供科学依据。
1 材料与方法
1.1 试剂与仪器 HUVEC细胞株(上海拜力生物试剂有限公司);白藜芦醇(成都普瑞法科技开发有限公司,批号:20130409,纯度大于95%);IL-1、TNF-α、IL-6ELISA 试剂盒(晶美生物工程有限公司);Aβ1~42(北京奥普森有限公司);CCK-8试剂盒(碧云天生物技术研究所);超净工作台(苏州净化设备有限公司,SW-CJ-1F型);倒置相差显微镜(日本Olympus公司,CKX41型);酶标仪(美国BIO-RAD公司,550型)。
1.2 CCK-8法检测白藜芦醇对 Aβ1~42干预后 HUVEC细胞活性影响 将Aβ1~42在37℃孵育1周使其变为聚集状态备
用,HUVEC细胞株采用RPMI 1640+10%胎牛血清+青链霉素培养[5]。将对数生长期的 HUVEC按1×105/L接种。每个浓度3个复孔,选择 Aβ1~425×101μmol/L刺激24h作为HUVEC细胞凋亡模型,将细胞分为模型组(Aβ1~42+细胞),白藜芦醇组(白藜芦醇160、80、40、20μg/L+ Aβ1~42+细胞),阴性组(细胞+培养基),24h后每孔加入CCK-8 10μL继续培养1h,酶标仪450nm波长下检测各孔吸光度值,以OD450值反应细胞活力情况,连续重复3次。
1.3 ELISA法检测白藜芦醇对Aβ1~42干预后 HUVEC的IL-1、IL-6和TNF-α影响 将各组处理24h后取上清液,严格按照说明书进行操作,450nm处测量OD450值。
1.4 统计学处理 用SPSS16.0统计软件进行分析,计量资料采用x±s表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 白藜芦醇对Aβ1~42刺激 HUVEC后细胞活性影响 阴性组细胞活性明显强于模型组,差异有统计学意义(P<0.05);白藜芦醇各亚组均可改善Aβ1~42刺激后HUVEC细胞活性,差异有统计学意义(P<0.05),见图1。
2.2 白藜芦醇对 Aβ1~42刺激 HUVEC的IL-1、IL-6和 TNF-α影响 与模型组比较,阴性组IL-1、IL-6和TNF-α表达较低,差异有统计学意义(P<0.01)。白藜芦醇各亚组干预后可减少 Aβ1~42刺激后 HUVEC的IL-1、IL-6和TNF-α的分泌,差异有统计学意义(P<0.01),见表1。

表1 白藜芦醇对 Aβ1~42刺激 HUVEC后IL-1、IL-6和TNF-α的影响(x±s,pg/mL)
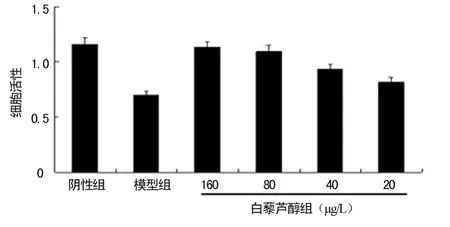
图1 白藜芦醇对Aβ1~42刺激HUVEC后细胞活性情况
3 讨 论
白藜芦醇在脑缺血及再灌注损伤、神经退行性疾病和癫痫发作等神经系统疾病的防治上有一定作用[6-7]。Aβ致血管内皮炎症反应,细胞凋亡可能是产生AD的原因之一[8]。但Aβ如何致血管内皮的过程与机制目前并未完全清楚,有人认为可能与Aβ致血管内皮细胞细胞凋亡,产生炎症反应等有关[9]。研究显示Aβ聚集和沉积激活小胶质细胞并产生TNF-α,诱导胞内产生过多氧自由基,损伤神经元[10]。胶质细胞的活化还可导致IL-1的过度表达和释放,继而诱发IL-6、γ-干扰素(interferon-γ,INF-γ)等细胞因子的表达[11],这些分子通过作用于胶质细胞或神经元,形成交互作用影响胶质细胞或神经元,促成了慢性炎症产物贯穿AD病理损伤的不同阶段,并在病理发展的全过程中发挥作用[12-14]。
HUVEC较为稳定,易于实验操作,故本研究选择HUVEC作为研究。CCK-8结果显示白藜芦醇4个浓度组可以增加Aβ刺激血管内皮细胞后存活率,减轻Aβ致血管内皮细胞损伤;抑制 Aβ致 HUVEC的IL-1、IL-6与TNF-α表达。
综上所述,白藜芦醇能提高Aβ刺激后HUVEC细胞活性,此作用可能与减少炎症因子IL-1、IL-6与TNF-α的产生有关,在防治AD上有一定意义。
[1] Karch CM,Jeng AT,Nowotny P,et al.Expression of novel Alzheimer′s disease risk genes in control and Alzheimer′s disease brains[J].PLoS One,2012,7(11):e50976.
[2] Pirola L,Frojdo S.Resveratrol:one molecule,many targets[J].IUBMB Life,2008,60(5):323-332.
[3] Nakata R,Takahashi S,Inoue H.Recent advances in the study on resveratrol[J].Biol Pharm Bull,2012,35(3):273-279.
[4] Bass TM,Weinkove D,Houthoofd K,et al.Effects of r esveratrol on lifespan in Drosophila melanogaster and Caenorhabditis elegans[J].Mech Ageing Dev,2007,128(10):546-552.
[5] Shen WX,Chen JH,Lu JH,et al.TGF-β1Protection against Aβ1-42-Induced Neuroinflammation and Neurodegeneration in Rats[J].Int J Mol Sci,2014,15(12):22092-22108.
[6] Tomasello B,Grasso S,Malfa G,et al.Double-Face Activity of Resveratrol in Voluntary Runners:Assessment of DNA Damage by Comet Assay[J].J Med Food,2012,15(5):441-447.
[7] Frozza RL,Bernardi A,Hoppe JB,et al.Lipid-core nanocapsules improve the effects of resveratrol against Abetainduced neuroinflammation[J].J Biomed Nanotechnol,2013,9(12):2086-2104.
[8] Maier JA.Endothelial cells and magnesium:implications in atherosclerosis[J].Clin Sci(Lond),2012,122(9):397-407.
[9] Zhang R,Xu J,Liu YY,et al.Propofol may protect PC12 cells fromβ-amyloid25-35induced apoptosis through the GSK-3βsignaling pathway[J].Chin Med J,2013,126(10):1884-1889.
[10]Yang YM,Shang DS,Zhao WD,et al.Microglial TNF-αdependent elevation of MHC classⅠexpression on brain endothelium induced by amyloid-beta promotes T cell transendothelial migration[J].Neurochem Res,2013,38(11):2295-2304.
[11]Frozza RL,Bernardi A,Hoppe JB,et al.Lipid-core nanocapsules improve the effects of resveratrol against Abetainduced neuroinflammation[J].J Biomed Nanotechnol,2013,9(12):2086-2104.
[12]Song SY,Jung YY,Hwang CJ,et al.Inhibitory effect of ent-Sauchinone on amyloidogenesis via inhibition of STAT3-mediated NF-κB activation in cultured astrocytes and microglial BV-2cells[J].J Neuroinflammation,2014,11:118.
[13]Xiong Z,Thangavel R,Kempuraj D,et al.Alzheimer′s disease:evidence for the expression of interleukin-33and its receptor ST2in the brain[J].J Alzheimers Dis,2014,40(2):297-308.
[14]Mitsuhashi M,Taub DD,Kapogiannis D,et al.Aging enhances release of exosomal cytokine mRNAs by Aβ1-42-stimulated macrophages[J].FASEB J,2013,27(12):5141-5150.
