人胰腺癌PANC-1细胞株中不同亚群放射敏感性的比较分析*
2015-03-14胡晨曦夏铀铀宋大安黎世秋蒋晓东
王 磊,胡晨曦,夏铀铀,宋大安,黎世秋,蒋晓东
(江苏省连云港市第一人民医院肿瘤放疗科 222002)
胰腺癌是恶性程度高、进展快、预后极差的消化道恶性肿瘤,80%患者临床确诊时已处于中晚期,70%~80%死于广泛转移[1]。而放射治疗是中晚期胰腺癌姑息治疗的主要手段,并成为延长生存期的有效手段[2]。临床资料证实,放疗对于提高胰腺癌的局部控制率及改善临床症状有着明显优势。但是胰腺癌细胞对放射治疗不敏感,极易局部复发及远处转移。而近年研究表明,肿瘤存在干性细胞,且是导致其复发、转移和治疗耐受的根源[3]。本研究利用流式细胞仪对PANC-1细胞株进行检测并分选,得到该细胞株中的CD44+CD24+干性细胞亚群和其他3个亚群;通过检测各亚群细胞经射线照射后的克隆形成、细胞凋亡、周期分布和活性氧簇(ROS)水平,分析各亚群细胞的放射敏感性,并初步探讨胰腺癌干性细胞放射抗拒的可能机制。
1 材料与方法
1.1 实验材料 人胰腺癌细胞PANC-1购自中国科学院上海生命科学研究院;DMEM培养基、DMEM/F-12培养基及B27添加剂均购自美国GIBCO公司;标准胎牛血清购自浙江天杭生物科技有限公司;细胞凋亡及周期分布试剂盒购自南京凯基生物公司;DCFH-DA荧光探针购自美国的Sigma公司;流式细胞仪购自美国Beckman-Coulter公司;直线加速器购自德国Siemens Primus公司。
1.2 方法
1.2.1 细胞培养与照射条件 培养条件:含10%胎牛血清(FBS)的DMEM/F-12完全培养液(含1%的青霉素和链霉素),5%的CO2、恒温37℃培养箱。照射条件:使用德国Siemens Primus直线加速器,6MV X射线室温下源皮距照射,剂量率为300cGy/min,六孔板上方覆盖1.5cm剂量补偿垫,固定源皮距,SSD=100cm,机架角度为0°,射野大小为15cm×15cm,单次照射。
1.2.2 流式细胞仪检测及分选 细胞生长到对数生长期后,弃培养基,PBS洗1次,加入无EDTA胰酶于37℃培养箱内消化2min,待细胞变圆后加入含血清的培养基5mL左右终止消化,吹打混匀后移入无菌离心管,1 500r/min离心5min,弃上清。细胞沉淀用PBS 1次,加入CD24-PE、CD44-FITC(1∶100稀释)于4℃冰箱轻摇孵育1h,1 000r/min离心5 min,弃上清,用PBS洗1次,500μL PBS悬浮,流式细胞分选仪进行分选,分选后细胞培养用含10%FBS的DMEM/F-12完全培养液(含1%的青霉素和链霉素及B27),放于37℃的CO2培养箱。
1.2.3 流式细胞术测细胞凋亡 分选后的各组细胞经射线照射(照射剂量为2Gy)24h后,用无EDTA胰酶消化成细胞悬液,收集照射处理前后的细胞,冷的PBS洗涤2次(1 500r/min离心5min),弃上清,用100μL Annexin V-FITC binding buffer重悬细胞,再分别加入5μL Annexin V-FITC和PI,4℃避光反应30min,再加入400μL的binding buffer混匀后利用流式细胞仪检测。
1.2.4 克隆形成实验 取对数生长期的各胰腺癌亚群细胞,按一定数量(102~105个/孔)接种于6孔培养板中,每组设3个复孔。继续培养24h后,室温下予X线照射。照射剂量分别为0、2、4、6、8Gy。继续培养10~14d,镜下计数大于或等于50个细胞的克隆数。终止培养,固定,快速Giemsa染色,按说明书操作,将培养板倒置并叠加一张带有网格的透明胶片,肉眼直接计数直径大于或等于0.2mm的克隆数。克隆形成率(PE)=克隆数/接种细胞数×100%,细胞存活分数(SF)=实验组PE/0Gy组PE×100%,计算各放射剂量点的SF,根据单击多靶模型[S=1-(1-eD/D0)N]以 GraphPad prism5绘图软件进行曲线拟合作图。实验重复3次。放射增敏比(SER)=Dq(CD44+CD24+)/Dq(CD44+CD24-、CD44-CD24+、CD44-CD24-),Dq=D0×lnN。
1.2.5 细胞周期分析 处理同1.2.3,收集照射处理前后的细胞,70%冷乙醇固定,4℃24h,将固定后的细胞用PBS洗涤1次,100μL RNAase 37℃水浴30min,离心后加入400μL PI 4℃避光30min,流式细胞仪检测。实验重复4次。
1.2.6 细胞内ROS测定 处理同1.2.3,收集照射处理前后的细胞,细胞用温PBS洗1次,加入1mL无血清培养基配置的DCFH-DA(10μmol/L),恒温37℃的CO2培养箱孵育30 min,弃培养基,加入温PBS洗3次,无EDTA胰酶消化成细胞悬液,1 500r/min离心5min,弃上清,用PBS悬浮,流式细胞仪检测波长(使用488nm激发波长,525nm发射波长),结果用平均荧光强度(MFI)表示。实验重复4次。
1.3 统计学处理 采用SPSS16.0软件行统计分析,实验数据以x±s表示,均数比较采用单因素方差分析及t检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 PANC-1细胞中各细胞占比例 PANC-1细胞中CD44+细胞比例约为92.0%,CD24+细胞比例约为4.7%,CD44+CD24+(0.6±0.2)%、CD44+CD24-(89.3±2.6)%、CD44-CD24+(4.1±1.3)%和CD44-CD24-(6.0±1.7)%。见图1。
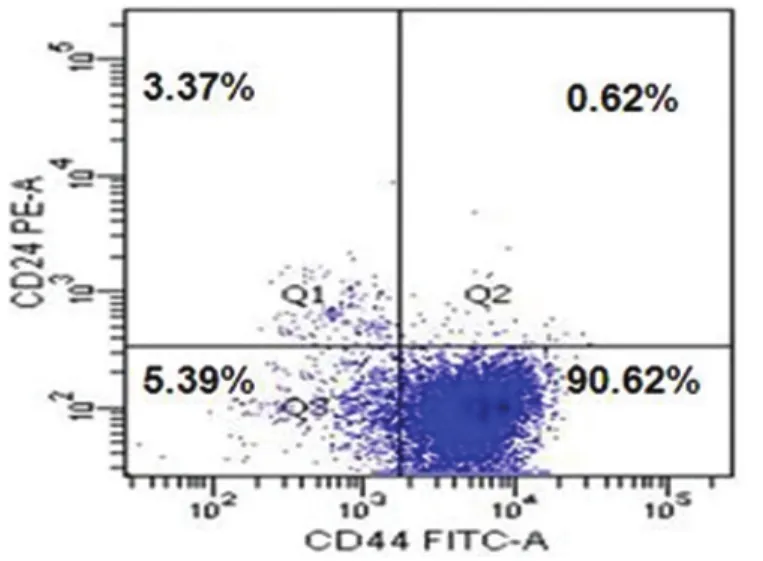
图1 PANC-1细胞内各亚群所占比例情况
2.2 各细胞亚群凋亡情况 放射线照射前,CD44+CD24+(3.3±0.6)%、CD44+CD24-(4.0±0.8)%、CD44-CD24+(3.4±0.7)%和CD44-CD24-(3.5±0.8)%,各组之间比较,差异无统计学意义(P>0.05)。放射线照射24h后,CD44+CD24+(6.8±1.1)%、CD44+CD24-(10.4±2.7)%、CD44-CD24+(13.0±3.1)% 和 CD44-CD24-(26.3±2.4)%,CD44+CD24+凋亡比例最低(P<0.05)。见图2。

图2 放射线照射前后各亚群细胞凋亡情况
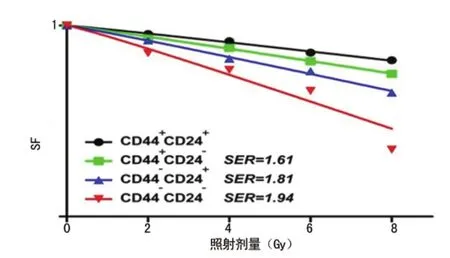
图3 各亚群细胞克隆形成实验
2.3 各亚群细胞克隆形成实验分析 经2、4、6、8Gy剂量X射线照射后,CD44+CD24+、CD44+CD24-、CD44-CD24+、CD44-CD24-的SF发生不同程度改变,其中CD44+CD24+SF下降幅度最低,CD44+CD24-与CD44-CD24+次之,CD44-CD24-下降最明显,见图3。
2.4 各亚群细胞周期分布 放射线照射前后,CD44+CD24+的G0/G1期比例均最高,与其他3组比较,差异有统计学意义(P<0.01)。见表1。
2.5 各细胞内ROS水平 放射线照射前,CD44-CD24-ROS水平最低,MFI低于其他3组,差异有统计学意义(P<0.05)。放射线照射24h后,CD44+CD24+ROS水平最低,MFI低于其他3组,差异有统计学意义(P<0.01)。见图4。
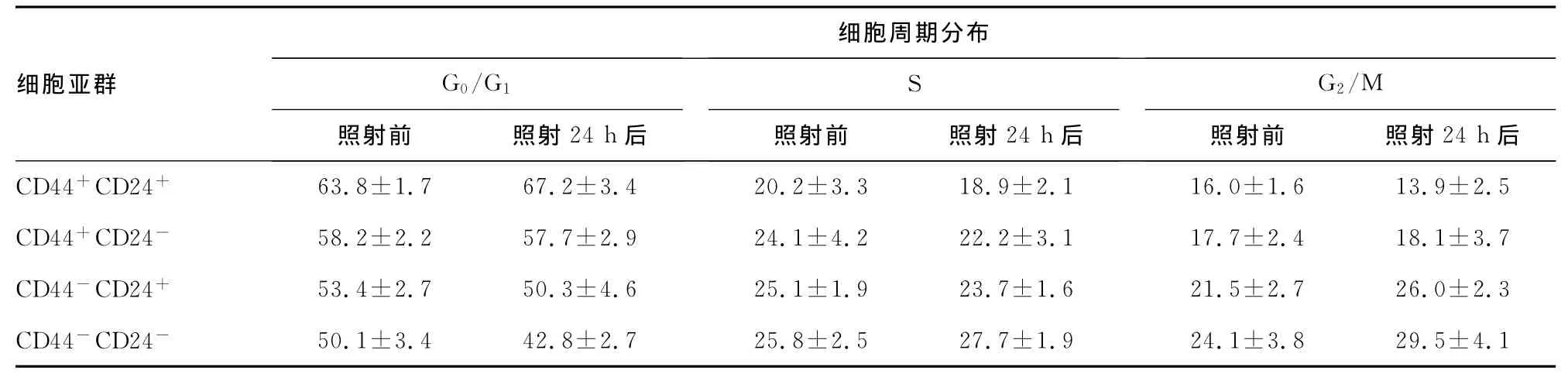
表1 放射线照射前后各亚群细胞周期分布(x±s)
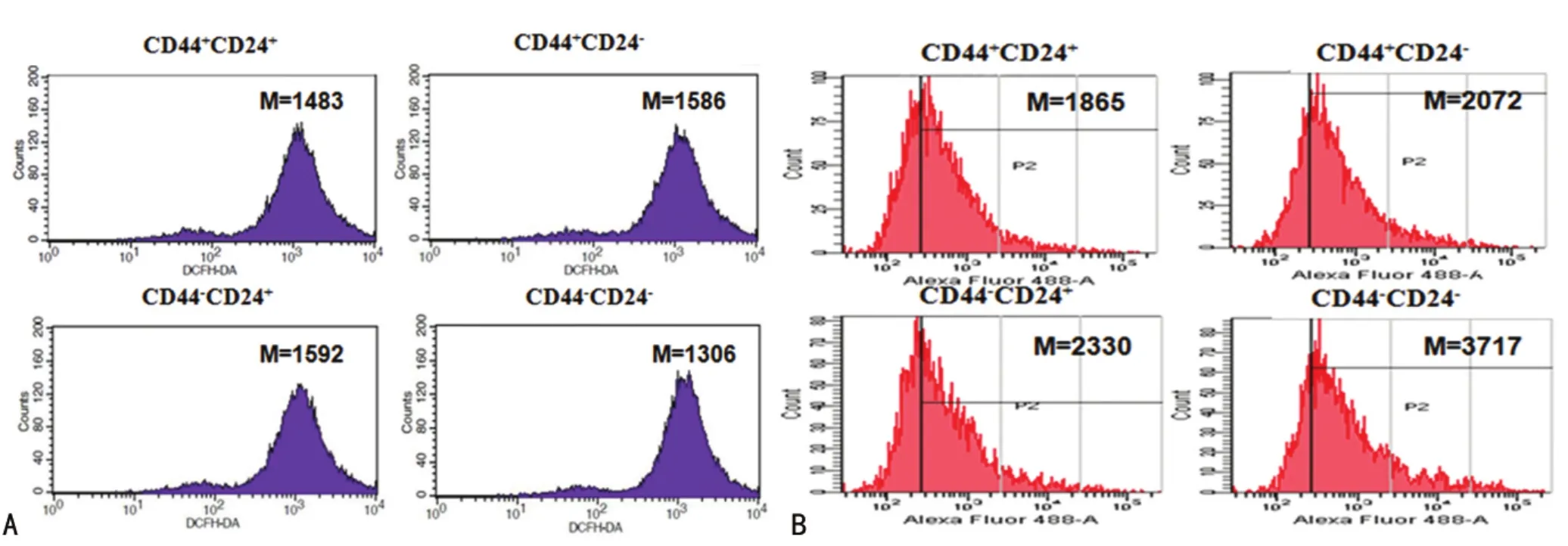
图4 放射线照射前后各亚群细胞内ROS水平
3 讨 论
胰腺癌对放射治疗不敏感,甚至表现出抗拒,导致其预后差。随着研究的深入,人们发现胰腺癌干性细胞是导致肿瘤复发、转移和耐药的根源[4]。本课题研究证实,胰腺癌干性细胞的放射抗拒的原因可能与干细胞大多处于静止期,且干性细胞内低ROS水平有关。
肿瘤干细胞学说认为[5-11],肿瘤组织中存在极少量的瘤细胞,在肿瘤中充当干性细胞的角色,这些细胞具有无限增殖的潜能,在启动肿瘤形成和生长中起着决定性作用。Huang等[12]应用流式细胞仪在胰腺癌PANC-1细胞株中分选出CD44+CD24+细胞,发现其在体外增殖率低于CD44-CD24-细胞,但成瘤率高20倍,认为PANC-1中CD44+CD24+细胞有肿瘤干性细胞的特性,因此本课题选取此细胞株为研究对象,开展了一系列的研究。经过流式检测和分选,获得了4个亚群的细胞。本实验所分选出的CD44+细胞比例明显高于Huang等[12]的实验结果,原因有可能为细胞传代次数多后,部分细胞存在变异可能。克隆形成实验结果显示CD44+CD24+SF下降幅度最低,CD44+CD24-与 CD44-CD24+次之,CD44-CD24-下降最明显(SER=1.94);在检测凋亡的实验中,放射线照射前,4组细胞凋亡比较,差异无统计学意义(P>0.05),而照射24h后CD44+CD24+细胞的凋亡比例最低,CD44-CD24-细胞凋亡最明显,结合以上两项结果表明更具胰腺癌干性细胞特性的CD44+CD24+细胞对放射抗拒。周期结果显示,放射线照射前后,CD44+CD24+的 G0/G1期比例最高,说明更具有肿瘤干性细胞特性的CD44+CD24+是一群相当静止的细胞,有慢周期特点。肿瘤干性细胞自身处于静止期,导致其放射抗拒。Lee等[13]通过CD44+CD24+ESA+肿瘤干性细胞移植瘤模型也证实了胰腺癌干性细胞对放射化学治疗抵抗。他们用放射治疗联合吉西他滨化疗干预上述模型时发现移植瘤的生长不仅不被抑制反受到刺激。
实验结果显示,放射线照射前不具有胰腺癌干性细胞特性的CD44-CD24-ROS水平最低,MFI低于其他3组;而放射线照射24h后,CD44-CD24-ROS水平最高,而最具有干性细胞特性的CD44+CD24+ROS水平最低。ROS是一类含氧的比氧气更加活泼的物质,包括过氧化氢(H2O2)、超氧阴离子(O2-)、羟自由基(OH-)等[14]。细胞内 ROS产生的一个重要来源是线粒体。ROS具有较高的反应活性,易于快速与细胞内的大分子物质反应,引起与许多病理过程有关的细胞结构的广泛损伤,进而触发细胞凋亡。放射治疗的主要生物学效应即是通过对组织水分子电离或激发产生活性很强的OH-,引起细胞DNA损伤或通过脂质过氧化途径诱导细胞凋亡[15]。肿瘤干性细胞的放射抗拒与其细胞内的低ROS水平有关。肿瘤干性细胞高效率的DNA修复是化学治疗和放射治疗抵抗的重要机制;干性细胞得到细胞龛的保护等。胰腺癌为乏氧肿瘤,缺氧可上调端粒酶及CXCR4[16]的表达,因此,肿瘤的耐药性、侵袭性增加。
以上研究表明,更具胰腺癌干性细胞特性的细胞亚群表现出对放射诱导的凋亡抗拒,且初步分析其可能原因为,胰腺癌干性细胞为一群相当静止的细胞,其慢周期导致放射抗拒,此外干性细胞内低ROS水平是导致其放射耐受的重要原因之一,为以后胰腺癌的治疗提供新的靶点。
[1] Lacobuzio-Donahue CA,Fu B,Yachida S,et al.DPC4gene status of the primary carcinoma correlates with patterns of failure in patients with pancreatic cancer[J].J Clin Oncol,2009,27(20):1806-1813.
[2] 田碧.胰腺癌的治疗现状[J].肿瘤基础与临床,2014,27(1):86-89.
[3] Li C,Heidt DG,Dalerba P,et al.Identification of pancreatic cancer stem cells[J].Cancer Res,2007,67(3):1030-1037.
[4] Gelmini S,Mangoni M,Serio M,et al.The critical role of SDF-1/CX-CR4axis in cancer and cancer stem cells metastsis[J].J Endocrinol Invest,2008,31(9):809-819.
[5] Dirks P.Cancer stem cells:Invitation to a second round[J].Nature,2010,466(7302):40-41.
[6] Li YF,Xiao B,Tu SF,et al.Cultivation and identification of colon cancer stem cell-derived spheres from the Colo205cell line[J].Braz J Med Biol Res,2012,45(3):197-204.
[7] Nakanishi Y,Seno H,Fukuoka A,et al.Dclk 1distinguishes between tumor and normal stem cells in the intestine[J].Nat Genet,2013,45(1):98-103.
[8] Chen J,Li Y,Yu TS,et al.A restricted cell population propagates glioblastoma growth after chemotherapy[J].Nature,2012,488(7412):522-526.
[9] Machado HL,Kittrell FS,Edwards D,et al.Separation by cell size enriches for mammary stem cell repopulation activity[J].Stem Cells Transl Med,2013,2(3):199-203.
[10]Driessens G,Beck B,Caauwe A,et al.Defining the mode of tumour growth by clonal analysis[J].Nature,2012,488(7412):527-530.
[11]Hinohara K,Kobayashi S,Kanauchi H,et al.ErbB receptor tyrosine kinase/NF-kB signaling controls mammosphere fofmation in human breast cancer[J].Proc Natl Acad Sci USA,2012,109(17):6584-6589.
[12]Huang P,Wang CY,Gou SM,et al.Isolation and biological analysis of tumor stem cells from pancreatic adenocarcinoma[J].World J Gastroenterol,2008,14(24):3903-3907.
[13]Lee HJ,You DD,Choi DW,et al.Significance of CDl33as a cancer stem cell markers focusing on the tumorigenicity of pancreatic cancer cell lines[J].J Korean Surg Soc,2011,81(4):263-270.
[14]熊珊珊,石英英,石汉平.活性氧与肿瘤研究进展[J].中华肿瘤防治杂志,2014,21(13):1045-1048.
[15]Ozben T.Oxidative stress and apoptosis:impact on cancer therapy[J].J Phar Sci,2007,96(30):2181-2196.
[16]张建波,仲伟霞.胰腺癌CXCL12/CXCR4通路研究进展[J].中华肿瘤防治杂志,2012,19(8):634-637.
