纯硫酸等共价化合物的导电原因*
2015-03-13李大塘
李大塘
(湖南科技大学化学化工学院 湖南 湘潭 411201)
一、问题的提出
由于离子化合物如氯化钠其自身就含有离子,不论在熔融状态还是在水溶液中都能产生自由移动的离子, 这些自由离子在外加电场的作用下能定向移动,因而能导电。液态氯化氢由于自身没有离子的存在故不能导电,只有在水溶液中才能产生自由离子而导电。因此人们常误认为共价化合物其液态一定不能导电。更有甚者,在化学教学的习题分析时一提到不导电的化合物就立马指出:液态共价化合物都不能导电,一定要把纯硫酸、纯硝酸连同液态氯化氢一起排除掉!并反复强调这是“题眼”。然而,所有纯液态共价化合物都一定不能导电吗? 或者说能导电的液态化合物一定不是共价化合物吗?
二、问题分析
1.纯硫酸导电的原因
大家知道,纯H2SO4是无色液体,它是从98%的商品酸首先补加SO3或发烟硫酸,然后用水滴定到正确的比电导或熔点而制得。尽管H2SO4是共价型分子, 在其纯晶态中, 具有S-O 之间的距离为0.142、0.143、0.152 和0.155nm 的SO4四面体,它们以强的氢键相连接。但液态纯H2SO4却表现出强烈的自电离作用,结果产生很高的电导性,即纯H2SO4是具有较强导电性能的。原因可用下列平衡式表示:

上式只是一个因素,由于脱水作用,因而还有几个附加的平衡存在:
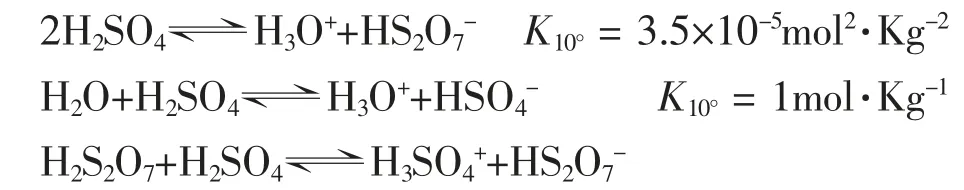
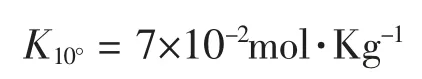
从而能估算出在100% H2SO4中存在的其它组分H3O+、HSO4-、H3SO4+、HS2O7-和H2S2O7的浓度。有报道,在25℃时,HSO4-为0.023 mol·L-1[1,2]。因此,液态纯硫酸能导电,反复实验中也能明显观察到这种实验现象。
2.纯硝酸导电的原因
纯硝酸是无色液体或白色晶态固体。在0℃时用100% H2SO4处理KNO3, 用真空蒸馏法抽走HNO3能制得纯硝酸。HNO3是共价化合物,但实验中也能观察到纯硝酸的导电现象。这是什么原因呢?
事实上,纯硝酸是液体纯酸中自电离最高的酸[1],其起始质子迁移作用为:
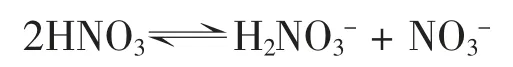
随之快速失水:H2NO3+⇌H2O +NO2-整个自电离过程为:2HNO3⇌NO3-+H2O +NO2+由于强烈自电离的存在,纯硝酸能导电是勿容置疑的。
3.纯五卤化磷导电的原因
PCl5是一种白色固体, 加热到160℃不经过液态阶段就变成蒸气。虽然PCl5也是一种共价化合物,但在加压下于148℃液化,可形成一种能导电的熔体。那么如何理解和解释这种现象呢?
实际上,人们进一步测得这种熔体存在两种P-Cl键长,它们分别为198 pm 和206 pm。于是可推断该熔体中存在下列平衡:2PCl5⇌PCl4++PCl6-[3,4,5,6]
PBr5气态分子结构与PCl5相似,它的熔体也能导电,但经测定其中只存在一种P-Br 键长。为什么PBr5熔体也能导电呢?
由实验事实可推断PBr5熔体存在的平衡如下: PBr5⇌PBr4++Br-[3,4,5,6]
没有PBr6-离子的存在,可能是Br-离子半径太大,P 原子周围容纳不了6 个Br 原子的原因。
4.纯卤氟化物导电的原因
某些卤氟化物,特别是ClF、BrF3和IF5,具有高的气化熵,这反映出它们在液态存在某种缔合。BrF3和IF5也呈现有明显的导电性。其自电离过程为:
2BrF3⇌BrF2++BrF4-[1]
2IF5⇌IF4++IF6-[1]
三、结论
通过上述分析不难看出,尽管纯硫酸、纯硝酸及五氯化磷等化合物都属于共价化合物,但由于它们都存在强烈的自电离作用,使其液态都存在较高浓度的自由离子因而具有导电性能。因此,将所有纯液态共价化合物一概排除在能导电的化合物之外是欠妥的。或者说能导电的液体化合物一定不是共价化合物是缺乏科学依据的。
[1][美]Cotton F.A,Wilkinson G.Advanced Inorganic Chemistry(3rd).北京师范大学,兰州大学,吉林大学等校译.高等无机化学(上册)[M].北京:人民教育出版社,1980:229~232,663
[2]P.A.H.Wyatt,Trans.Faraday Soc.,1965,65,585
[3]吉林大学,武汉大学,南开大学.无机化学(下册)第2 版[M].北京:高等教育出版社,2010:528
[4]武汉大学,吉林大学.无机化学(下册)第3 版[M].北京:高等教育出版社,2004:692
[5]《无机化学》编写组.无机化学(下册)[M].北京:人民教育出版社,1978:161
[6]张灿久.化学奥林匹克竞赛教程[M].长沙:湖南师范大学出版社,1997:288
