奶牛乳腺炎停乳链球菌的分离鉴定及耐药性分析
2015-03-12胡宏伟冯海霞常运朝车团结张成虎
胡宏伟,蔡 元,田 斌,冯海霞,常运朝,张 莹,车团结,张成虎,*
(1.兰州市畜牧兽医研究所,甘肃 兰州730050;2.甘肃省生物芯片工程实验室)
奶牛乳腺炎又叫乳房炎,是由机械性刺激、病原微生物入侵及化学物理性损伤等因素所致的危害性很大的疾病,不仅危害着奶牛业,而且严重威胁着人类的健康,奶牛发病后可引起产奶量和乳品质下降,平均每头牛产奶量降低15%,严重者造成奶牛过早的淘汰,给奶业生产造成很大损失。我国奶牛乳腺炎阳性率在46.4%~85.7%,我国牧场中的乳腺炎80%以上都是由病原微生物引起的,临床上治疗奶牛乳房炎多用抗生素来防治,大量抗生素的滥用使得细菌耐药性明显上升。本研究在2014年4月至8月,抽取了甘肃省河东地区天水市、兰州市不同县区、河西地区金昌市部分奶牛场的乳腺炎(包括临床型和隐形乳腺炎)乳样323 份,采用6%~8%绵羊鲜血琼脂平板培养基、选择性培养基(BETA-SSA琼脂培养基),普通营养琼脂培养基结合革兰染色、镜检及生化试验,分离鉴定出乳样中的停乳链球菌;选用临床常用的10种抗生素对分离株进行药敏试验。分析了甘肃省部分地区奶牛场乳腺炎停乳链球菌对10中常用抗生素的敏感情况和耐药现状,旨在为临床合理用药提供科学依据。
1 材料与方法
1.1 材料
1.1.1 主要仪器 培养箱(南京电器厂生产)、LEICA BME 双目显微镜(德国莱卡仪器有限公司)、超净工作台(ZHJH-1112上海智城分析仪器制造有限公司)、高速冷冻离心机(HERMLE,德国)。
1.1.2 培养基与试剂 普通营养琼脂平板,6%~8%绵羊鲜血琼脂平板培养基、营养肉汤(10%血清),选择性培养基(BETA-SSA 琼脂培养基),革兰染色液等(青岛高科园海博生物技术有限公司)。
1.1.3 药敏纸片 庆大霉素、左氧氟沙星、红霉素、甲砜霉素、四环素、万古霉素、环丙沙星、青霉素、头孢曲松拉、克林霉素共10种药敏纸片(杭州微生物试剂有限公司)。
1.2 方法
1.2.1 乳样采集 采集甘肃省河西地区金昌市、兰州市不同县区、河东地区天水市部分奶牛场的乳腺炎乳样,每头目标牛采集一份样,共计323份。采样前乳头按常规程序消毒,先用干净水冲洗,再用75%酒精消毒4个奶区和工作人员的手指,酒精棉球擦干,去前两把乳汁,每个奶牛取50 mL 乳样放入离心管内,做好标记后放入装有冰块的采样箱里12h内送检。
1.2.2 停乳链球菌的分离鉴定 采集的323份乳腺炎乳样分批以5 000r/min离心15min后,移去管中上层液体,留取离心管底部沉淀物,用无菌生理盐水稀释,吸取上述混悬液,接种于营养肉汤(10%血清)中,于37 ℃富集培养24h。将培养物分别划线接种到普通营养琼脂平板,6%~8%绵羊鲜血琼脂平板培养基,BETA-SSA 琼脂培养基37 ℃培养24h,观察溶血现象。用接种针挑取BETA-SSA琼脂培养基上的单个乳白色菌落再次接种到BETA-SSA 琼脂培养基上纯化培养,纯化培养后经过染色、镜检初步确定为疑似停乳链球菌后进行CAMP试验和生化试验。
1.2.3 CAMP试验 在血琼脂平板上用金黄色葡萄球菌培养物划一条直线,然后将链球菌培养物划一条线,与金黄色葡萄球菌培养物的划线相互垂直,但不要接触,二者相距3~5 mm,各链球菌分离菌划线间距10~20mm。置37℃温箱内培养24h后观察结果。在两划线交界处是否出现箭头样的溶血区,出现为阳性,不出现为阴性。
1.2.4 生化试验 经革兰氏染色、镜检初步鉴定为链球菌的纯化培养物,根据属链球菌的生化特征确定鉴定的生化指标。用七叶苷、甘露醇、山梨醇、乳糖、棉子糖、海藻糖,水杨苷、菊糖、马尿酸钠、6.5%NaCl试验、精氨酸水解试验、溶血试验等生化指标进行生化鉴定。
1.2.5 药敏试验 药敏试验严格按照临床试验标准研究所(CLSI)抗细菌药物敏感试验的规范操作。本实验选择纸片扩散法,将上述方法分离的典型菌株用无菌生理盐水稀释至约1.5×108CFU/mL(采用细菌计数法),接种到MH 琼脂培养基上,每个平板贴上抗生素(写具体抗生素名称)药敏纸片,每张纸片间距不少于24mm,纸片中心距平皿边缘不少于15mm。菌接种后15min内贴完纸片。将平板反转,36±1 ℃孵育18~24h后取出,用游标卡尺测量抑菌圈直径,从平板背面测量最接近的整数毫米数并记录。抑菌环的边缘以肉眼见不到细菌明显生长为限。
图1 停乳链球菌的生长形态

图2 停乳链球菌药敏试验
2 结果
2.1 细菌分离、鉴定
普通琼脂平板上,37 ℃,36h培养后,未见到菌落;在绵羊鲜血琼脂平板培养基上呈直径0.1~1.0mm,灰白色,表面光滑,边缘整齐的圆形和卵圆形呈链状排列或成双排列的小菌落,菌落周围形成不透明的草绿色溶血环,呈α型溶血;在选择性培养基BETA-SSA 琼脂培养基上,呈乳白色菌落,菌落直径为2~3mm,初步判定为疑似菌落。
2.2 CAMP试验
35 ℃培养24h后,划线交界处无箭头样的溶血区,为阴性。
2.3 生化试验结果
按照《常见细菌系统鉴定手册》中链球菌属生理生化指标为判定标准,进行生化试验如表1所示,绝大部分菌株符合停乳链球菌生化反应特性。

表1 生化鉴定结果
综合细菌的形态特征、鲜血平板上溶血情况以及CAMP、生化鉴定试验结果,最终从323 份乳样中分离出216株停乳链球菌。
2.4 药敏试验结果
药敏试验结果表明:216株分离株对青霉素、四环素、红霉素表现出明显耐药(见表2),耐药率分别为71.30%、59.26%、52.78%,而对左氧氟沙星、万古霉素、庆大霉素、甲砜霉素高度敏感,抑菌环明显(见 图2),敏 感 率 分 别 为76.39%、73.61%、65.74%、64.35%。(见图3)。
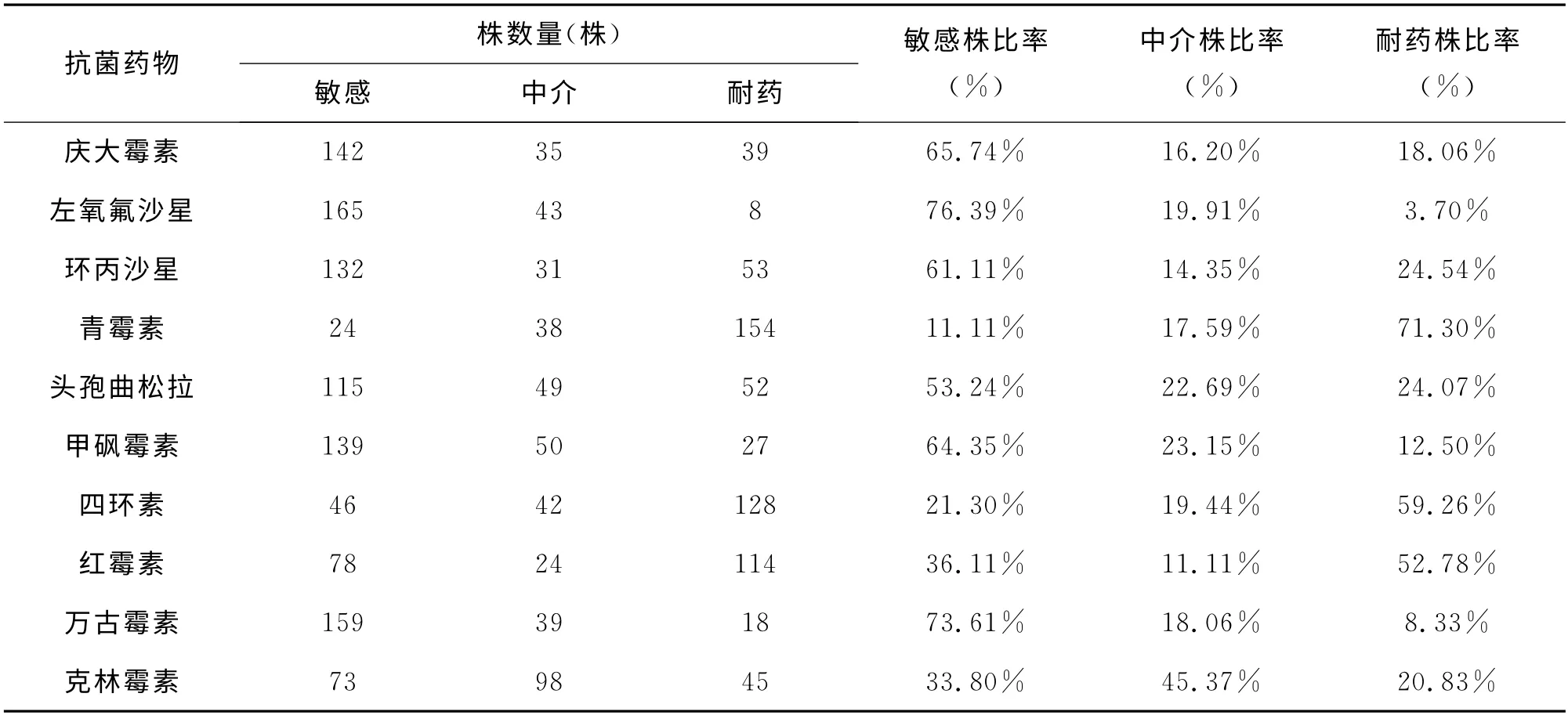
表2 216株停乳链球菌耐药性实验结果
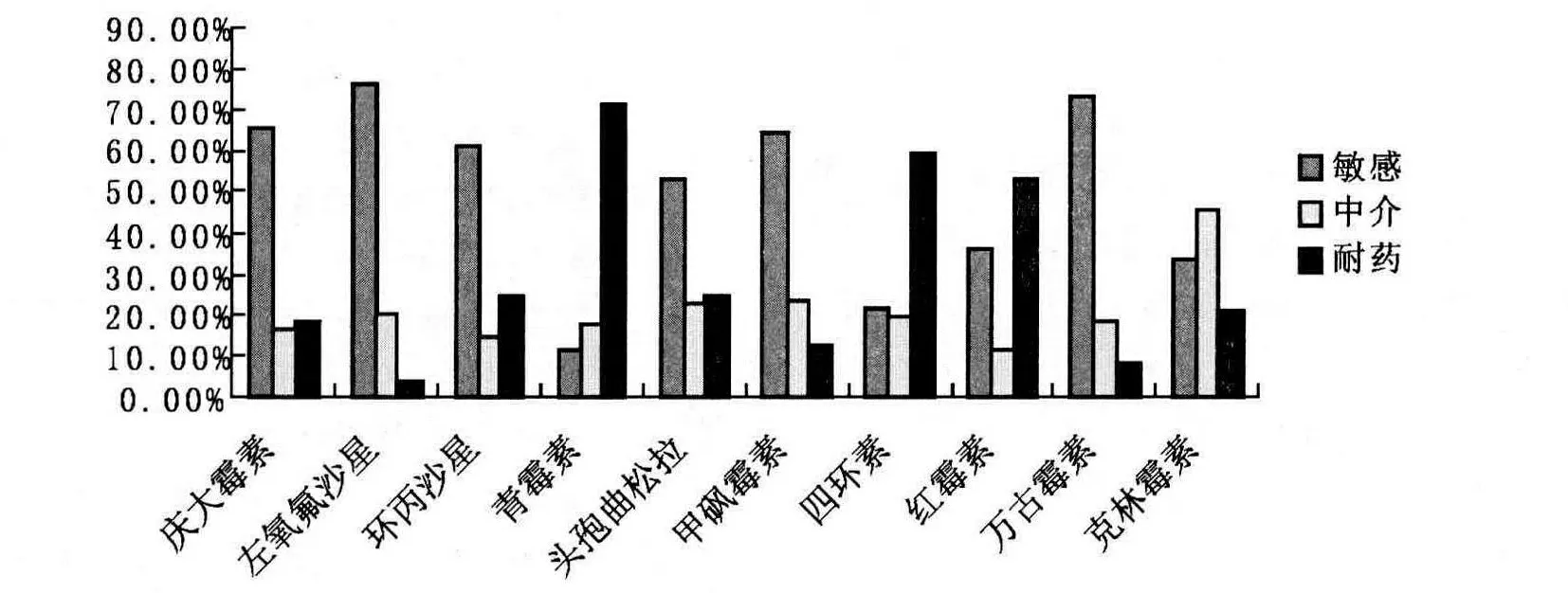
图3 停乳链球菌对10种药物的耐药率
3 讨论
3.1 分离手段多样,羊品采集量大
停乳链球菌作为奶牛乳腺炎的致病菌之一,对奶牛养殖业危害很大,同时对人体健康也带来了严重的威胁。本文通过对甘肃省兰州市,河西地区金昌市、河东地区天水市的部分奶牛场患乳腺炎奶牛共抽取323份乳腺炎乳样(包括临床型和隐形乳腺炎)。采用6%~8%绵羊鲜血琼脂平板培养基、选择性培养(BETA-SSA 琼脂培养基),普通营养琼脂培养基,结合革兰染色、镜检,对可疑菌落分离纯化后进行生化试验,最终从323 份乳样中分离出216株停乳链球菌。
3.2 药敏程度在实验地表现各异
目前,由于抗生素的滥用使得细菌的耐药性十分严重,本研究选用了抽样奶牛场常用的10种抗菌药物,将分离到的216株停乳链球菌进行了药敏试验,结果表明:分离株对青霉素、四环素、红霉素表现出明显耐药,耐药率分别为71.30%、59.26%、52.78%,其中对青霉素耐药的有154株,对四环素耐药的有128株,对红霉素耐药的有114株,说明上述三种抗菌药物在临床中被长期大量滥用,导致停乳链球菌已对上述三种抗菌药高度耐药,耐药性非常严峻。
3.3 应减少或停用大环内酯类药
提醒该地区牛场今后继续用β-内酰胺类抗生素,如:青霉素、头孢曲松钠;大环内酯类,如红霉素,或用四环素类抗生素来对抗停乳链球菌已没有实际意义。而分离株对喹诺酮类药物左氧氟沙星,多肽类抗生素万古霉素、氨基糖苷类庆大霉素、以及酰胺醇类抗菌药甲砜霉素表现出较高的敏感性,敏感率分别为76.39%、73.61%、65.74%、64.35%,敏感株有124株、165株、142株、139株。
3.4 建议
建议当地奶牛场在治疗以停乳链球菌为主要致病菌的乳腺炎疾病时应优先考虑用喹诺酮类、多肽类、氨基糖苷类抗菌药物,同时建议当地兽医临床可交替使用抗菌药或通过借助药敏试验制定联合用药方案,要科学、合理地使用抗菌药物。
4 小结
本研究通过分离鉴定甘肃省部分地区乳腺炎乳样中的停乳链球菌,以及通过药敏试验对分离株的耐药现状进行了分析,对养殖场户及时掌握病情,同时对当地兽医临床正确、合理用药提供了科学依据。
[1] Denis M,Wedlock D N,Lacy-Hulbert S J,et al.Vaccines against bovine mastitis in the New Zealand context;what is the best way forward[J].N Z Vet J,2009,57(3),132-140.
[2] Taverna F,Negri A,Piccinini R,et al.Characterization of cellwall associated proteins of a Staphylococcus aureus isolated from bovine mastitis case by aproteomic approach[J].Vet Microbiol,2007,119(2-4):240-247.
[3] 周利青,王文魁,奶牛乳房炎的研究进展[J].畜牧兽医科技信息,2005(5):8-9.
[4] 朱战波,王红,刘宇,等.奶牛乳房炎链球菌分离株的鉴定及药敏试验[J].现代畜牧兽医,2007(12):8-10.
[5] 白龙,郝永清,范利霞,等.奶牛乳腺炎无乳链球菌的分离鉴定[J].畜牧与饲料科学2010,31(1):96-97.
[6] 李新圃,张礼华,李宏胜,等.奶牛乳房炎主要致病菌的药敏试验[J].中国兽医科技,1995,25(9):27-28.
[7] 刘春杰,杨丽华,张春,等.长春地区奶牛乳腺炎主要致病菌分离鉴定及药敏试验[J].南方农业,2014,8(18):155-156.
[8] 马保臣,李建基,刘锡武.奶牛急性乳腺炎病原菌的分离与鉴定研究[J].黑龙江畜牧兽医,2003(1):35-36.
[9] 陆承平,兽医微生物学[M].北京:中国农业出版社,2007.
[10] Khan A,Dass C,Ramamurthy T,et al.Antibiotic resistance,virulence gene,and molecular profiles of Shiga toxin producing Escherichia coli isolates from diverse sources in calcutta[J].JClin Microbiol,2002,40(6),2009-2015.
[11] 王礼伟,杨亚东,屈勇刚,等,新疆石河子地区奶牛乳房炎链球菌的分离鉴定及药敏试验[J].动物医学进展,2014,35(2):124-127.
[12] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社.2001:248-249.
[13] Erskine R J,Walker R D,Bolin C A,et al.Trends in Antibacterial Susceptibility of Mastitis Pathogens During a Seven-Year Period[J].Dairy Sci,2002,85:1111-1118.
