宫颈癌全外显组测定及易感基因研究*
2015-03-12钟田雨陈晓红
胡 蓉,钟田雨,陈晓红
(赣南医学院第一附属医院检验科,江西赣州341000)
宫颈癌是一种在妇女中多发的恶性肿瘤疾病,其病死率、发病率仅次于乳腺癌,发病年龄越来越趋于年轻[1]。发展中国家宫颈癌的发病率较高,我国宫颈癌患者约占全球总患者的1/3,且发病年龄年轻化,对女性的生命健康造成严重威胁,必须引起重视。人乳头瘤病毒(HPV)感染一直被公认为是导致宫颈癌发病的病因[2-3],这种病毒的感染引发宫颈发生癌前病变,最终引发为宫颈癌。感染HPV妇女主要集中在青年和中年女性,但其中只有很少的妇女会发展为癌症,并且感染的过程需要较长的时间,如果做好预防措施,治愈的可能性很大,因此单独的HPV感染可能不是导致宫颈癌的主要病因。随着对基因研究的不断深入,特别是对基因多态性的研究发现,在HPV感染发展到宫颈癌的过程中,基因的多态性可能起到很大的作用,本研究通过对128例宫颈癌妇女与100例健康妇女微小RNA-96(MiR-96)、缺氧诱导因子-1α(HIF-1α)、Twist与Slug基因表达水平的对比分析,评估其表达对宫颈癌发病的影响。
1 资料与方法
1.1 一般资料 选择2010年3月至2014年5月在本院就诊的宫颈癌患者128例,为观察组。其中鳞癌110例(85.9%),腺癌10例(7.8%),腺鳞癌8例(6.3%),年龄22~67岁,平均(45.0±3.4)岁,手术之前均未接受化疗或者放疗。同时收集同期进行常规体检的健康者100例作为对照组,对照组各项化验指标正常并且无肿瘤史。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 HIF-1α表达检测 采用HIF-1α试剂盒(苏州普泰生物技术有限公司)对单克隆抗体HIF-1α进行检测,按照试剂盒要求进行染色及组织标本制备,用显微镜对制备组织进行观察,计数阳性染色细胞数。根据肿瘤细胞染色强度及显色比例,计算阳性细胞率,大于10%为阳性。
1.2.2 MiR-96表达检测 将组织标本切成薄片,再研磨成粉末,用Trizol试剂按照Trizol试剂盒(Invitrogen公司)的说明提取总RNA,将RNA进行反转录,通过PCR定量检测MiR-96的相对表达值,其正向引物:5′-TTT GGC ACT AGC ACA TT-3′;反向引物:5′-TTT GGC ACT AGC ACA TT-3′。引物序列长度肿瘤的分期是按照WHO以及国际妇产科协会(FIGO)的肿瘤分期标准。MiR-96表达以U6参数,测得到△Ct值,△Ct=MiR-96平均Ct值-U6平均Ct值,而2-△△Ct就可以反应MiR-96的相对表达情况。
1.2.3Twist与Slug基因表达检测 将组织标本切成薄片,再研磨成粉末,Trizol试剂盒(Invitrogen公司)提取组织RNA,根据Twist与Slug基因的序列编号来进行引物的设计,Twist上游引物序列:5′-ACG AGC TGG ACT CCA AGA TG-3′,下游引物序列:5′-GGC ACG ACC TCT TGA GAA TG-3′;Slug上游引物序列:5′-CCT GGT TGC TTC AAG GAC AC-3′,下游引物序列:5′-TCC ATG CTC TTG CAG CTC TC-3′,通过PCR定量检测Twist与SlugmRNA的相对表达值。TwistmRNA相对表达水平=Twist拷贝数/β-actin拷贝数,SlugmRNA相对表达水平=Slug拷贝数/β-actin拷贝数。
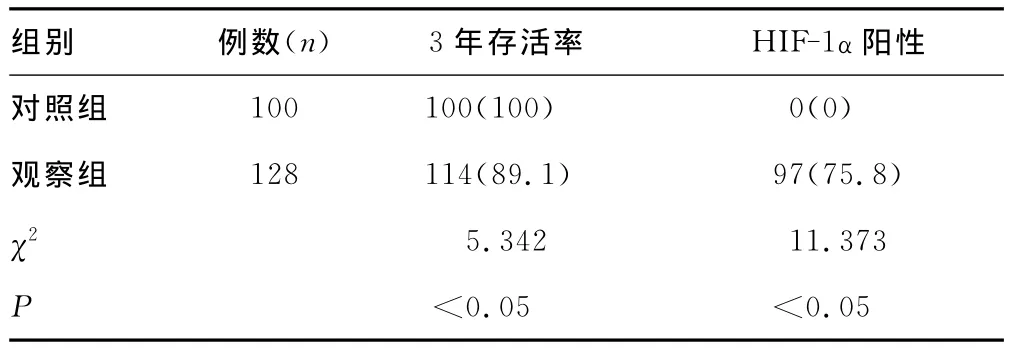
表1 HIF-1α在两组妇女宫颈组织中的表达结果[n(%)]
1.3 统计学处理 采用数据处理软件包为SPSS16.0,计量资料符合正态分布、方差齐性的数据用±s表示,组间比较采用t检验,计数资料用率表示,组间采用χ2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 HIF-1α在两组妇女宫颈组织中的表达 HIF-1α在肿瘤组织中的阳性表达率为75.8%,在正常组织中的表达率为0%,两组比较差异有统计学意义(P<0.05),详细见表1。
2.2 MiR-96在两组妇女宫颈组织中的相对表达值 MiR-96在正常组织的相对表达值为1.01±0.16,在肿瘤组织中为44.56±3.67,在肿瘤组织中的相对表达值远远高于正常组织,两组进行比较,差异有统计学意义(P<0.05);肿瘤组织Ⅰ期、Ⅱ期、Ⅲ期MiR-96相对表达值分别为15.43±2.01、84.42±7.65、456.32±37.32,两两比较差异有统计学意义(P<0.05)。
2.3Twist与Slug基因在两组妇女宫颈组织中的表达Twist基因在正常组织的相对表达量为(2.02±0.46)×10-3,在肿瘤组织中为(6.54±1.23)×10-3,在肿瘤组织中的相对表达量远远高于正常组织,两组进行比较差异有统计学意义(t=38.29,P<0.05);Slug基因在正常组织的相对表达量为(1.32±0.34)×10-2,在肿瘤组织中为(4.68±1.02)×10-2,在肿瘤组织中的相对表达量远远高于正常组织,两组比较,差异有统计学意义(t=34.87,P<0.05)。
3 讨论
宫颈癌是一种在中老年妇女中高发的癌症疾病,发生率有逐年上升的趋势。HPV病毒感染一直以来被公认为是导致宫颈癌的主要因素,针对此类病毒的疫苗研制取得了重大进展[4]。但随着人们对宫颈癌疾病研究的不断深入,发现只有少数的病毒感染者会最终发展为宫颈癌,提示宫颈癌的发生除了HPV感染导致以外,环境致癌因素与遗传因素也可能是导致宫颈癌发生的主要因素。遗传因素并不直接导致肿瘤的发生,但它会改变个体的易感性,并且在特殊的条件下被激发。
大量研究报道,MiR-96[5]、HIF-1α[6]、Twist与Slug基因表达升高可使患宫颈癌的概率大大提高,宫颈癌发生与上述基因的表达有很大的关系[7]。MiR-96可能通过调控参与基因的信号通路,从而导致癌细胞的侵袭能力增强,在这个过程当中MiR-96发挥了与癌基因类似的功能,间接参与了宫颈癌的发生[8];Twist与Slug基因,对宫颈癌的发生、侵袭,甚至耐药都有着很大影响,它们的过度表达与乳腺癌、卵巢癌、胃癌等肿瘤的发生、发展关系密切[9]。HIF-1α在肿瘤的发生中起着不可忽视的作用[10]。肿瘤细胞的快速生长势必会造成肿瘤组织缺氧,HIF-1α在应付组织缺氧方面起着重大作用[11-12],缺氧情况下HIF-1α上调,引起多血管的形成[13-14],细胞适应缺氧的环境导致肿瘤细胞的继续生长、扩散[15]。本研究通过对MiR-96、HIF-1α、Twist与Slug等易感基因在宫颈癌组织及正常组织中的表达水平测定,结果显示:HIF-1α在正常组织中基本没有阳性表达,而在肿瘤组织中阳性表达率远远高于正常组织;MiR-96在肿瘤组织中的相对表达值远远高于正常组织,并且随着疾病的进展表达量显著提高;Twist与Slug基因在肿瘤组织中的相对表达量远远高于正常组织;两组进行比较差异有统计学意义(P<0.05)。
综上所述,MiR-96、HIF-1α、Twist与Slug等易感基因均与肿瘤的发生有关,甚至可能是导致宫颈癌发生的重要因素。有必要对上述基因进行进一步的研究,为临床妇科肿瘤的诊断、治疗提供一定的科学依据。
[1] 张铭,张一鸣,左伟,等.干细胞标志物SALL4在宫颈癌中的表达研究[J].重庆医学,2014,43(3):285-287.
[2] Lei T,Mao WM,Lei TH,et al.Incidence and mortality trend of cervical cancer in 11cancer registries of China[J].Chin J Cancer Res,2011,23(1):10-14.
[3] Duggan C,Coronado G,Martinez J,et al.Cervical cancer screening and adherence to follow-up among Hispanic women study protocol:a randomized controlled trial to increase the uptake of cervical cancer screening in Hispanic women[J].BMC Cancer,2012,12(1):170.
[4] Hu SY,Hong Y,Zhao FH,et al.Prevalence of HPV infection and cervical intraepithelial neoplasia and attitudes towards HPV vaccination among Chinese women aged 18-25in Jiangsu province[J].Chin J Cancer Res,2011,23(1):25-32.
[5] Meng F,Zhao X,Zhang S.Expression and significance of SHP-2in human papillomavirus infected cervical cancer[J].J Huazhong Univ Sci Technolog Med Sci,2012,32(2):247-251.
[6] 徐晓英,汤春辉,薛晓玲.高危型HPV、p16、COX-2在宫颈癌中的表达及临床意义[J].重庆医学,2011,40(12):1199-1201,1204.
[7] Wang D,Wu M,Feng FZ,et al.Pretreatment neutrophilto-lymphocyte and platelet-to-lymphocyte ratios do not predict survival in patients with cervical cancer treated with neoadjuvant chemotherapy and radical hysterectomy[J].Chin Med J,2013,126(8):1464-1468.
[8] Chen HW,Liu SS,Miao LF,et al.Inhibitory effect of lanthanum chloride on migration and invasion of cervical cancer cells[J].J Rare Earth,2013,31(1):94-100.
[9] Liu N,Zhao LJ,Li XP,et al.Histone deacetylase inhibitors inducing human cervical cancer cell apoptosis by decreasing DNA-methyltransferase 3B[J].Chin Med J,2012,125(18):3273-3278.
[10] Ma YY,Cheng XD,Zhou CY,et al.Value of P16expression in the triage of liquid-based cervical cytology with atypical squamous cells of undetermined significance and low-grade squamous intraepithelial lesions[J].Chin Med J,2011,124(16):2443-2447.
[11] Li B,Li W,Sun YC,et al.Nerve plane-sparing radical hysterectomy:a simplified technique of nerve-sparing radical hysterectomy for invasive cervical cancer[J].Chin Med J,2011,124(12):1807-1812.
[12] Chadza E,Chirwa E,Maluwa A,et al.Factors that contribute to delay in seeking cervical cancer diagnosis and treatment among women in Malawi[J].Health,2013,4(11):1015-1022.
[13] Wu S,Lu S,Tao H,et al.Correlation of polymorphism of IL-8and MMP-7with occurrence and lymph node metastasis of early stage cervical cancer[J].J Huazhong Univ Sci Technolog Med Sci,2011,31(1):114-119.
[14] Li K,Jin X,Fang Y,et al.Correlation between physical status of human papilloma virus and cervical carcinogenesis[J].J Huazhong Univ Sci Technolog Med Sci,2012,32(1):97-102.
[15] 李婵玉.MMP-9及其相关因子与宫颈癌[J].重庆医学,2012,41(33):3545-3547.
