玻璃化冷冻及程序冷冻对人卵巢组织卵泡活性的影响
2015-03-11刘丽英曲文玉蒋丽张晓丽刘晓莉孔刚
刘丽英 曲文玉 蒋丽 张晓丽 刘晓莉 孔刚
(辽宁省沈阳市妇婴医院生殖中心,辽宁沈阳 110014)
·论著·
玻璃化冷冻及程序冷冻对人卵巢组织卵泡活性的影响
刘丽英曲文玉蒋丽张晓丽刘晓莉孔刚
(辽宁省沈阳市妇婴医院生殖中心,辽宁沈阳110014)
摘要目的:比较玻璃化冷冻及程序冷冻对人卵巢组织卵泡活性的影响。方法: 将15例人卵巢组织20 min内运至实验室,切割成1 mm×5 mm×5 mm大小的卵巢皮质片,随机分为新鲜组、玻璃化冷冻组及程序冷冻组。玻璃化冷冻组及程序冷冻组均采用优化的实验方法进行。新鲜及复苏组织体外培养后,在光镜及电镜下分析卵泡的形态正常率,采用激素释放试验及异体移植试验检测冷冻复苏的人卵巢组织的功能,并与新鲜组比较。结果:冷冻复苏组及新鲜对照组卵巢组织皮质内均可见形态正常和异常的始基及初级卵泡,新鲜对照组卵泡形态正常率显著高于玻璃化冷冻组和程序冷冻组(P<0.05);程序冷冻组形态正常率稍高于玻璃化冷冻组(P>0.05)。3组均可见超微结构正常及异常的原始卵泡、初级卵泡。卵巢皮质片体外培养后持续分泌雌二醇和孕酮。新鲜组激素分泌水平高于玻璃化冷冻组和程序冷冻组,但差异无统计学意义(P>0.05)。异体移植试验显示,程序冷冻组较玻璃化冷冻组具有更高的移植物回收数及卵泡密度。结论:由于程序冷冻人卵巢组织卵泡具有较高的发育潜能,因此其较玻璃化冷冻更有应用前景。
关键词玻璃化冷冻;程序冷冻;人卵巢组织;激素释放试验;超微结构;移植
基本项目:辽宁省沈阳市科学技术委员会基金项目(编号:F14-158-9-13)通讯作者
刘丽英,E-mail: llying007@sohu.com
近年来,人卵巢组织冷冻复苏技术的临床应用已经取得巨大进展,全球已有十余例活婴出生[1-2]。研究[3]表明,卵巢组织冷冻保存是保存女性生育能力和内分泌功能的有效方法。卵巢组织冷冻不延误癌症患者的最佳治疗时机、不需要复杂的促排卵及取卵过程,是青春期前及年轻女性患者保存生育能力的最佳方法[4]。目前用于卵巢组织冷冻的方法主要有玻璃化冷冻和程序冷冻。有研究[5-6]比较了这2种方法的冷冻效果,所得出的结论有所不同。本研究旨在比较玻璃化冷冻及程序冷冻对人卵巢组织卵泡活性的影响。
1资料与方法
1.1标本来源卵巢组织来源于辽宁省沈阳市妇婴医院妇科2013年6月—2014年7月因卵巢良性肿瘤需行腹腔镜或手术切除的15例患者,术后病理证实为卵巢良性肿瘤。15例患者年龄为25~35岁,平均(30.8±2.2)岁;且近半年无服用激素药物史,具有内分泌功能,术前至少3个月未进行过放疗和(或)化疗。收集病理检查证实的正常卵巢组织。本研究经辽宁省沈阳市妇婴医院医学伦理委员会批准,患者均签署知情同意书。
1.2卵巢组织的制备将术中取出的卵巢组织置于装有预冷卵泡冲洗液(G-mops Vireolife)的无菌试管内,置于冰上,20 min内送实验室,用磷酸盐缓冲液(PBS)反复冲洗卵巢组织3次,用刀片切除髓质部分,仅保留卵巢皮质,切割成1 mm×5 mm×5 mm大小的组织块,整个切割过程在15 min内完成。将每例患者的卵巢组织均随机分为3组:新鲜对照组、玻璃化冷冻组及程序冷冻组。
1.3卵巢组织的冷冻与解冻
1.3.1玻璃化冷冻冷冻:卵巢皮质片在冷冻基础液[PBS+10%人血清白蛋白(HSA)]中平衡5 min后,转入冷冻液VS1[0.35 mol/L 二甲基亚砜(DMSO)、0.38 mol/L 丙二醇(PROH)、0.38 mol/L 乙二醇(EG)、冷冻基础液]5 min,VS2(0.7 mol/L DMSO、0.75 mol/L PROH、0.75 mol/L EG、冷冻基础液)5 min ,VS3[1.4 mol/L DMSO、1.5 mol/L PROH、1.5 mol/L EG、质量体积比(W/V)10% 的聚乙烯吡咯烷酮(PVP)、冷冻基础液]5 min,VS1及VS2均在室温下轻轻震荡平衡,VS3在4 ℃条件下平衡,采用坚硬表面玻璃化冷冻法冷冻。复温:37 ℃解冻,依次经过解冻液1、2、3、4(解冻液1:0.5 mol/L蔗糖(S)、PBS、10% HSA;解冻液2:0.25 mol/L S、PBS、10% HSA;解冻液3:0.125 mol/L S、PBS、10% HSA;解冻液4:PBS、10%HSA),各5 min,室温轻轻震荡,去除冷冻保护剂。
1.3.2程序冷冻冷冻:卵巢组织装入含6 mL卵巢冷冻液的15 mL试管中(含10%胎牛血清、1.5 mol/L EG、0.1 mol/L S的PBS),于4 ℃摇床平衡30 min,装入1.8 mL的细胞冻存管,置于Planner程序降温仪中。-2~-9 ℃,2 ℃/min;-9~-40 ℃,0.3 ℃/min;-40~-140 ℃,10 ℃/min;-9 ℃植冰,冷冻曲线保存于计算机中,冻存管转移至液氮保存。解冻:37 ℃水浴,直至冻存管中的冰晶全部溶解,卵巢皮质片依次经过解冻液1、2、3(解冻液1:含0.75 mol/L EG,0.25 mol/L蛋白S;解冻液2:含0.25 mol/L S;解冻液3:PBS)各10 min,室温轻轻震荡,去除冷冻保护剂。
1.4体外培养将新鲜及解冻的卵巢皮质片转移到含有2 mL卵泡培养液[含1%胰岛素转铁蛋白硒(Its)、100 U/L的卵泡刺激素(FSH)、10 U/L的黄体生成素(LH)、5%胎牛血清(FCS)的α-MEM]的35 mm培养皿中,37 ℃、CO2体积分数为5%的条件下培养,隔日换液,收集培养液,冻于-80 ℃冰箱中待用。培养12 d后收集培养的卵巢皮质片用于组织学鉴定。
1.5组织学鉴定
1.5.1光镜分析冷冻复苏卵泡的组织学结构将所有新鲜和冷冻复苏后培养的卵巢皮质片在4%多聚甲醛固定24 h,然后进行脱水、二甲苯透明、乙醇逐级脱水和石蜡包埋,连续切片,切片厚5 μm。用切片进行常规HE染色,树胶封片。为避免卵泡的重复计数,每10张连续片计数1次。按照Gougeon等[7]的标准观察卵泡形态,计数形态正常及异常的卵泡。
1.5.2透射电镜观察冷冻复苏卵泡的超微结构新鲜及冷冻复苏后培养的卵巢皮质片置于2.5%的戊二醛中固定,包埋修块后切片,甲苯胺蓝染色,光镜下定位组织学形态正常的卵泡,用钻石刀进行超薄切片后经醋酸铀及硝酸铅双重染色,在透射电镜下观察卵泡超微结构。
1.6激素释放试验解冻冷冻保存的培养液,采用电化学发光免疫分析法测定雌二醇(E2)及孕酮(P)水平,E2的敏感性为5.0 μg/L,P的敏感性为0.1 ng/mL。
1.7卵巢组织植入裸鼠体内8周龄SPF级性成熟雌性裸鼠(SCID)30只,体质量21~26 g,由中国医科大学实验动物中心提供。将30只裸鼠随机分为新鲜组、玻璃化冷冻组、程序冷冻组,每组10只。腹腔注射氯胺酮75 mL/kg麻醉小鼠;75%乙醇消毒裸鼠腹部皮肤,剪开腹部皮肤,分离腹部皮下组织,将待移植的卵巢皮质片切割成1 mm×1 mm×1 mm大小,用眼科镊夹取卵巢组织块并将其多点移植于腹部皮下,缝合皮肤、标记并再次消毒。移植1个月后取出移植物,进行组织学评价。
1.8统计学处理采用SPSS 13.0软件进行统计分析。样本率的比较采用Fisher's确切概率法或χ2检验。以α=0.05为检验水准,P<0.05为差异有统计学意义。
2结果
2.1光镜分析结果本研究主要对原始卵泡及初级卵泡进行分析,因其他发育阶段的卵泡数目较少。形态正常的卵泡表现为圆形卵泡、卵母细胞,颗粒细胞分布均匀,基底膜完整。如果卵泡与卵母细胞形态不规则,颗粒细胞不完整,出现核固缩,则为形态异常的卵泡。冷冻复苏组及新鲜组卵巢组织皮质内均可见形态正常和异常的始基卵泡及初级卵泡,见图1。新鲜组卵泡形态正常率显著高于玻璃化冷冻组和程序冷冻组(P<0.05),程序冷冻组形态正常率稍高于玻璃化冷冻组(P>0.05)。见表1。
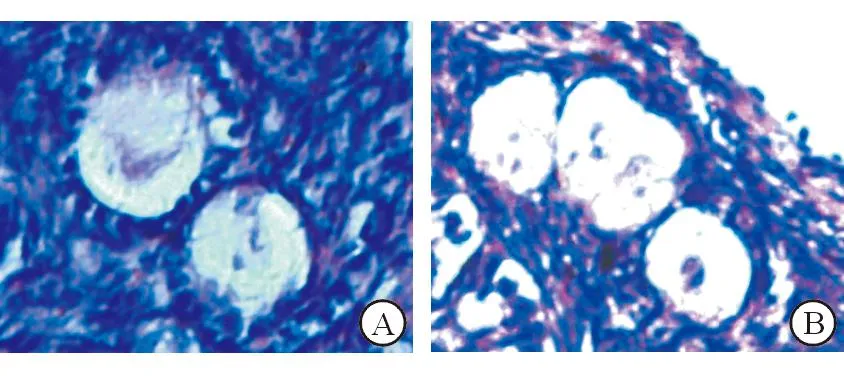
A:形态正常的始基卵泡、初级卵泡;B:形态异常的始基卵泡、初级卵泡、卵母细胞皱缩
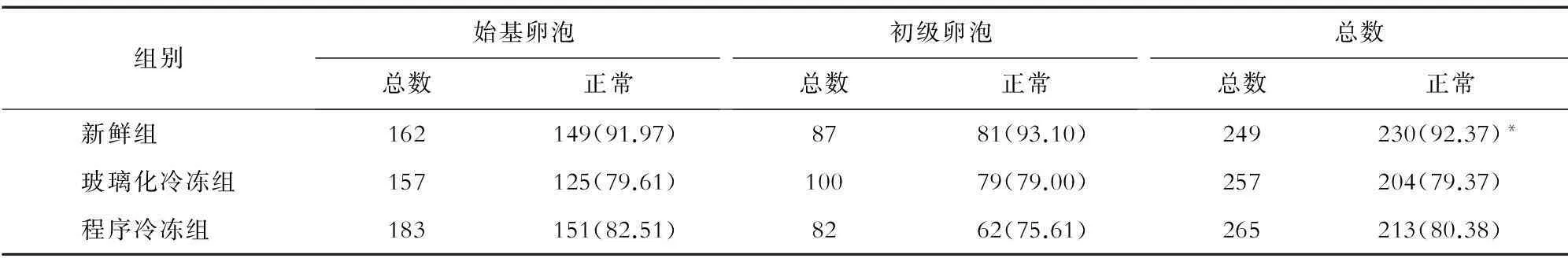
图1 光镜下观察人卵泡的形态(HE染色,×200)
注:与其他2组比较,*P<0.05
2.2透射电镜分析结果3组中均可见超微结构正常的原始卵泡、初级卵泡。卵母细胞居中、圆形,核膜及核仁清晰完整,卵母细胞膜、线粒体膜、内质网膜完整,颗粒细胞膜完整,排列整齐,细胞间连接紧密,细胞核完整,染色质分布均匀。冷冻标本中可见部分卵子的胞核及胞浆模糊,不能清晰辨认内质网结构,线粒体肿胀,基质暗淡,个别卵母细胞及颗粒细胞胞浆中无细胞器区和空泡增多。见图2。
2.3激素释放试验卵巢皮质片体外培养后持续分泌E2和P,新鲜组激素分泌水平高于玻璃化冷冻组和程序冷冻组,但差异无统计学意义(P>0.05),见图3。

A:正常原始卵泡:卵母细胞核规整,有明显的核仁及异染色质,胞浆内细胞器丰富;B:异常的初级卵泡:胞浆内出现空泡(#)及无细胞器区(*),颗粒细胞内出现大量无细胞器区域(+++)
图2透射电镜下观察人卵泡的形态(×30 000)
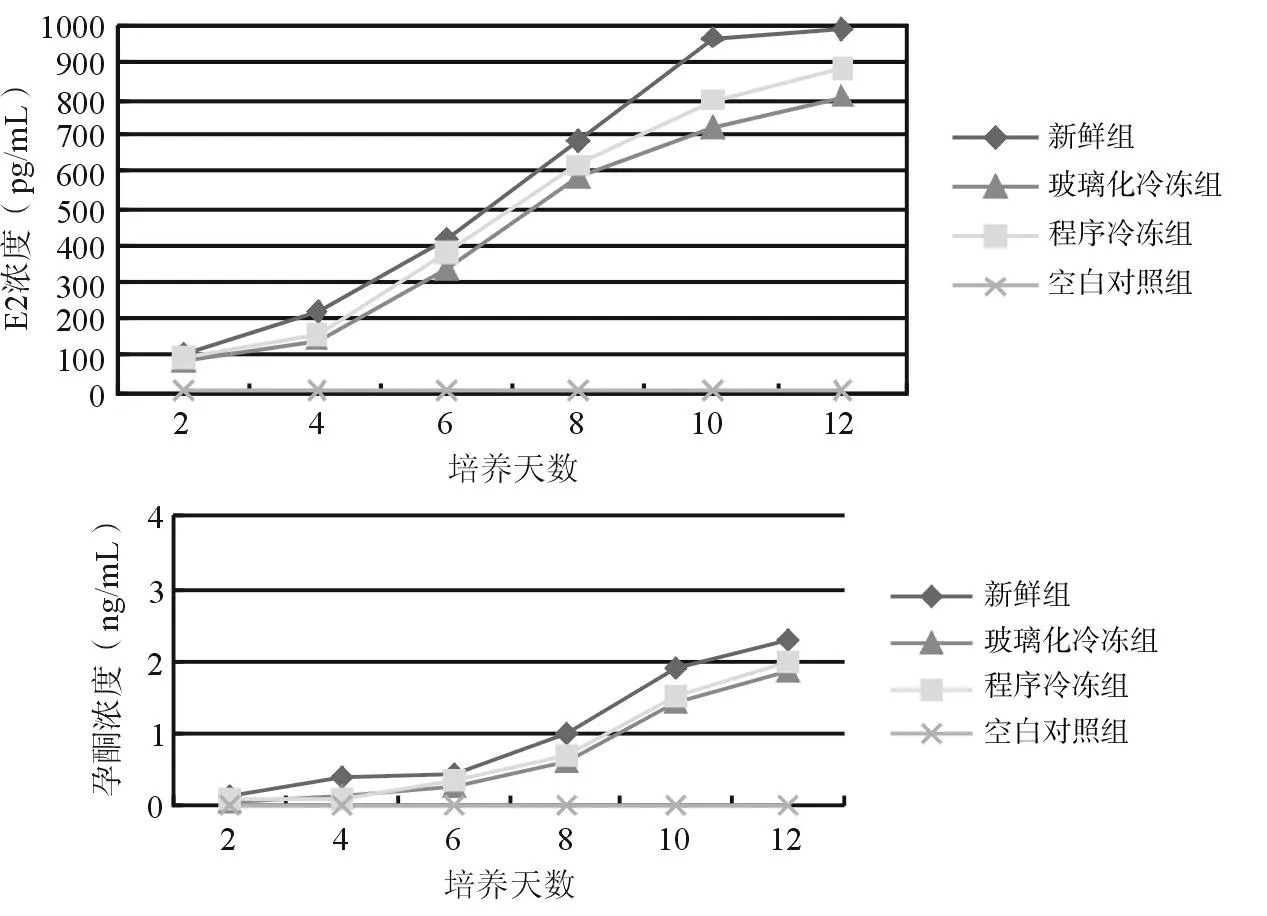
图3 新鲜及冷冻复苏卵巢组织经体外培养后E2及P值的变化
2.4卵巢组织异体移植结果解剖裸鼠后寻找移植物。30只裸鼠中25只找到移植物,其余5只移植失败,仅见很小的纤维化结节。组织学检测显示移植物已有新生血管生成,可见不同发育阶段的卵泡。新鲜组移植效果最好,15个移植物中共见36个卵泡;程序冷冻组12个移植物中共见25个卵泡;玻璃化冷冻组移植效果较差,8个移植物中共见13个卵泡。见图4。
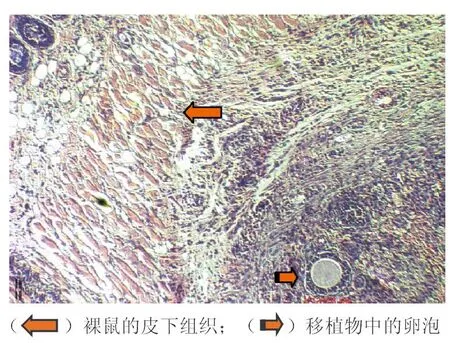
图4 经冷冻复苏异体移植后卵巢组织的组织学检测结果
3讨论
程序冷冻是传统的冷冻方法,目前已经广泛应用于卵巢组织的冷冻。该方法应用低浓度冷冻保护剂,使其在缓慢降温过程中脱水,避免细胞内冰晶形成。冷冻保护剂的类型及浓度是影响冷冻保存效果的重要因素。我们的前期研究发现,采用EG(1.5 mol/L)的冷冻效果最好,因此,本研究亦采用EG(1.5 mol/L)作冷冻保护剂。
玻璃化冷冻是近年来新发展起来的冷冻保存技术。该方法应用的高浓度冷冻保护剂能充分渗透至细胞内,经过快速降温,使细胞内外的液态直接转化成黏稠、无结构的非晶体玻璃化状态,从而最大限度地降低了细胞内冰晶的形成,减轻了对细胞的冷冻损伤。Vajta等[8]研究认为,玻璃化冷冻比慢速冷冻更为有效和可靠,是未来冷冻技术的发展方向。
目前已有多项研究比较了玻璃化冷冻及程序冷冻的效果,但得出的结论不同。2004年Rahimi等[5]对人卵巢组织玻璃化及程序冷冻进行了比较,结果发现冷冻效果的差异无统计学意义。2006年Gandolfi等[6]对人、牛及猪的卵巢组织进行了玻璃化冷冻及程序冷冻,得出的结论是,慢速冷冻能够更好地保存卵泡中的各种细胞。2007年Li等[9]对玻璃化冷冻及程序冷冻的研究中,第1组采用2.5 mol/L DMSO+2.5 mol/L 丙二醇+0.2 mol/L蔗糖作为冷冻保护剂直接投入液氮的玻璃化冷冻方法;第2组采用1.5 mol/L DMSO+0.1 mol/L蔗糖的程序冷冻方法;培养2周后检测正常卵泡的比例,结果发现2组效果差异无统计学意义。Isachenko 等[10]2007年应用Li等[9]的玻璃化冷冻方法检测玻璃化冷冻的效果,结果发现程序冷冻的卵泡质量更好。随后,玻璃化冷冻的方法得到优化,经冷冻复苏、培养后可获得较高质量的卵泡[11]。2009年,Isachenko等[12]将优化的玻璃化冷冻方案与程序冷冻法进行比较,结果发现,这2种方法冷冻的卵巢组织在形态及内分泌功能方面差异无统计学意义,但在分子生物学水平差异有统计学意义,玻璃冷冻组有大量的完整RNA的降解[12]。他们的结论是,程序化冷冻具有更好的发育潜能,更有应用前景。2009年Keros等[13]对2种程序冷冻法以及2种玻璃化冷冻法进行了比较,结果发现,联合应用PROH、EG、DMSO和PVP的玻璃化冷冻方案可更好地保持卵泡完整性。坚硬表面玻璃化法(SSV)是将含有卵巢组织的液滴直接滴到在液氮中预冷的固体表面,进行玻璃化冷冻。一些学者[14-15]采用SSV作为载体对卵巢组织进行玻璃化冷冻,发现复苏后卵泡的活力优于传统玻璃化冷冻法。因此本研究采用Keros等[13]的玻璃化冷冻法,采用SSV作为冷冻载体进行玻璃化冷冻。
本研究采用玻璃化冷冻及程序冷冻法冷冻人卵巢组织,观察新鲜卵巢组织与冷冻复苏卵巢组织的形态。结果显示,经过冷冻后,2种方法复苏的卵巢组织的卵泡形态正常率均低于新鲜组织,差异有统计学意义,可见在冷冻和复苏过程中人卵巢组织受到一定的损伤。程序冷冻卵巢组织的形态正常率稍高于玻璃化冷冻组,但差异不显著。程序冷冻组始基卵泡的形态正常率比初级卵泡高,这可能是由于始基卵泡的体积小,代谢率低、缺少细胞器及皮质颗粒,对低温敏感性差,比其他卵泡更能耐受冷冻过程,因此冻融后始基卵泡的存活率较高。但是,玻璃化冷冻组始基卵泡及初级卵泡的形态正常率相差不多,这可能是由于高浓度的冷冻保护剂及快速的降温速度更适用于体积稍大的初级卵泡。对人卵巢组织超微结构的研究表明:无论程序冷冻还是玻璃化冷冻,经培养后均可造成部分卵泡超微结构的改变,这些细微的结构改变是否对卵泡生物活性产生影响,还需要进一步研究。
冷冻复苏后培养组织的激素活性测定是评价冷冻方案有效性的一个佐证。本研究发现,新鲜及冷冻卵巢组织中E2及P的含量随着培养时间的延长而增高,提示卵巢组织在体外培养条件下生长发育良好;3组间差异无统计学意义。有研究[16]显示,不仅仅是卵泡可以产生类固醇激素,取自绝经期卵巢皮质片中增生的基质细胞(在体或离体)也能产生E2。因此,冷冻卵巢组织的内分泌功能与生殖功能之间的关系值得进一步研究。卵巢组织的异体移植更加确切地说明了冷冻过程对卵巢功能的影响,经过异体移植发现,程序冷冻法较玻璃化冷冻法具有更高的移植物回收率及卵泡密度。
通过组织学、激素释放试验及异体移植试验能够更好地检测卵泡的存活状态。本研究的结果表明,玻璃化冷冻法与程序冷冻法虽然在形态学检测及激素释放试验方面的差异无统计学意义,但在异体移植试验中程序冷冻法的效果优于玻璃化冷冻法。因此,本研究得出结论是:由于程序冷冻法冷冻的人卵巢组织卵泡具有较高的发育潜能,因此较玻璃化冷冻法更有应用前景。
参考文献
[1]Donnez J, Dolmans MM, Demylle D, et al. Livebirth after orthotopic transplantation of cryopreserved ovarian tissue[J]. Lancet,2004,364(9443):1405-1410.
[2]Andersen CY,Rosendahl M,Byskov AG,et al.Two successful pregnancies following autotransplantation of frozen/thawed ovarian tissue[J].Hum Reprod,2008,23(10):2266-2272.
[3]Meirow D,Levron J,Eldar-Geva T,et al.Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy[J]. N Engl J Med,.2005,353(3):318-321.
[4]Schmidt KT,Rosendahl M,Ernst E,et al.Autotransplantation of cryopreserved ovarian tissue in 12 women with chemotherapy-induced premature ovarian failure: the Danish experience[J].Fertil Steril,201l,95(2):695-701.
[5]Rahimi G, Isachenko E, Isachenko V,et al. Comparison of necrosis in human ovarian tissue after conventional slow conventional freezing or rapid freezing and transplantation in ovariectomized SCID mice[J]. Reprod Biomed Online,2004,9(2):187-193.
[6]Gandolfi F,Paffoni A,Papasso Brambilla E,et al. Efficiency of equilibrium cooling and vitrification procedures for the cryopreservation of ovarian tissue:comparative analysis between human and animal models.Fertil Steril[J].2006,85(Suppl 1):1150-1156.
[7]Gougeon A. Dynamics of follicular growth in the human: a model from preliminary results[J]. Hum Reprod, 1986,(2):81-87.
[8]Vajta G, Nagy ZP.Are programmable freezers still needed in the embryo laboratory? Review on vitrification[J]. Reprod Biomed Online,2006,12(6):779-796
[9]Li YB1,Zhou CQ,Yang GF,et al.Modified vitrification method for cryopreservation of human ovarian tissues[J].Chin Med J (Engl),2007,120(2):110-114.
[10]Isachenko V,Isachenko E,Reinsberg J,et al.Cryopreservation of human ovarian tissue:comparison of rapid and conventional freezing[J]. Cryobiology,2007,55(3):261-268.
[11]Isachenko E, Isachenko V, Nawroth F,et al. Human ovarian tissue preservation: is vitrification acceptable method for assisted reproduction? [J]. Cryo Letters,2008,29(4):301-314.
[12]Isachenko V, Lapidus I, Isachenko E, et al. Human ovarian tissue vitrification versus conventional freezing: morphological, endocrinological, and molecular biological evaluation[J]. Reproduction, 2009,138(2): 319-327.
[13]Keros V, Xella S, Hultenby K, et al. Vitrification versus controlled-rate freezing in cryopreservation of human ovarian tissue[J]. Hum Reprod, 2009, 24(7):1670-1683.
[14]Santos RR,Tharasanit T,Van Haeften T,et al. Vitrification of goat preantral follicles enclosed in ovarian tissue by using conventional and solid-surface vitrification methods[J]. Cell Tissue Res,2007,327(1):167-176.
[15]Huang L,Mo Y,Wang W,et al.Cryopreservation of human ovarian tissue by solid-surface vitrification[J]. Eur J Obstet Gynecol Reprod Biol,2008,139(2):193-198.
[16]Wotiz HH,Davis JW,Lemon HM,et al.The conversion of testosterone to estrogens by human ovarian tissue[J]. J boil chem,1956, 222(1): 487-501.
Effects of Vitrification and Program Freezing on the Follicular Viability of Human Ovarian Tissues
LIULiyingQUWenyuJIANGLiZHANGXiaoliLIUXiaoliKONGGangCenterofReproductiveMedicine,Women′sandChildren′sHospitalofShenyanginLiaoningProvince,Shenyang110014,China
AbstractObjective:To compare the effect of vitrification and program freezing on the follicular viability of human ovarian tissues. Methods: Ovarian tissues from 15 patients were transported to the laboratory within 20 min after excision. Pieces of ovarian tissues (1 mm×5 mm×5 mm)were randomly divided into fresh group, vitrification group and program freezing group.Optimal experimental method was used in vitrification group and program freezing group. The fresh and resuscitated tissues were cultivated in vitro, and the follicular morphology was analyzed by using light and electron microscope.The viability of ovarian tissues resuscitated from freezing was detected by hormones releasing assay and allograft assay, and then compared with that of fresh group. Results: Morphologically normal and abnormal primordial and primary follicles could be seen in resuscitated freezing group and fresh group. The rate of morphologically normal follicles in fresh group was significantly higher than those in vitrification group and program freezing group(P<0.05).The rate of morphologically normal follicles was slightly higher in program freezing group than that in vitrification group(P>0.05). Primordial and primary follicles with normal and abnormal ultrastructure could be seen in all the three groups.Ovarian cortical pieces secreted estradiol and progesterone continuously after in vitro culture. Hormone levels in fresh group were higher than those in vitrification group and program freezing group(P>0.05). Allograft assay showed that there were more graft recovery number and higher follicular density in program freezing group than those in vitrification group. Conclusions: Follicle has higher potentiality of development in program freezing human ovarian tissues,so program freezing is more promising than vitrification in application.
Key WordsVitrification;Program freezing;Human ovarian tissues;Hormone releasing assay;Ultrastructure;Transplantation
通讯作者刘敏,E-mail:lm18950009388@sina.com
中图分类号R71
文献标识码A
