黄山陈村水库上游河源溪流的鱼类群落及其纵向梯度格局
2015-03-10王文剑闫莉莉严云志
储 玲,王文剑,闫莉莉,严云志,朱 仁,司 春
安徽师范大学生命科学学院,安徽省高校生物环境与生态安全省级重点实验室,芜湖 241000
黄山陈村水库上游河源溪流的鱼类群落及其纵向梯度格局
储 玲,王文剑,闫莉莉,严云志*,朱 仁,司 春
安徽师范大学生命科学学院,安徽省高校生物环境与生态安全省级重点实验室,芜湖 241000
确定鱼类群落的分布格局及其对人类活动的响应,是合理保护、恢复和管理鱼类多样性的基础。基于2011年5月和10月自黄山陈村水库上游3条河源溪流共39个样点的调查数据,比较研究了溪流间鱼类群落及其纵向梯度格局的异同,着重探讨了人类活动对溪流鱼类群落纵向梯度格局的影响。研究结果显示,同人为干扰较轻的舒溪相比,人为干扰严重的浦溪和麻溪中水宽、底质和植被覆盖率等局域栖息地条件显著变化,这造成了后者的鱼类多样性显著下降及物种组成的显著变化,主要表现为敏感性的地方物种(如宽鳍鱲、光唇鱼、原缨口鳅等)数量减少、耐受性的广布物种(如泥鳅、麦穗鱼、高体鰟鲏等)数量增多。舒溪的鱼类物种数及其组成均与海拔显著相关,但这种“海拔-鱼类群落”关系在麻溪和浦溪中削弱甚至消失。底质、植被覆盖率对舒溪鱼类群落具有重要影响,但对浦溪和麻溪鱼类群落却无显著影响。研究结果表明,在子流域空间尺度上,诸如城镇化发展、土地利用、河道治理等人类活动可通过对局域栖息地条件的影响,导致溪流鱼类多样性下降及其物种组成的变化,破坏鱼类群落的纵向梯度格局,并改变栖息地与鱼类群落之间的联系。
溪流鱼类;群落结构;物种多样性;纵向梯度格局;人为干扰
沿河源至河口的纵向梯度,河流中众多非生物环境因子和生物因子及其生态过程都呈现出显著的空间异质性,除了直接体现在海拔、坡度、水流流态、流量、流速等理化因子的变化上以外[1],还包括能量生产与消费[2- 3]、栖息地容纳量及其多样性[4- 5]、环境稳定性等[6- 7]。1980年,Vannote等首次提出了河流连续统概念,该概念详尽地描述了水流流态、水温、食物有效性和底质等环境因素及大型无脊椎动物的纵向梯度格局及二者之间的联系[2]。此后,有关河流鱼类群落的纵向梯度格局逐渐被大量报道[3,5,8- 11],并形成了一些具有普遍性的规律,如:沿河流纵向梯度,鱼类物种数逐渐增多,其物种组成可通过替代或递增2种模式发生变化。但是,最大鱼类物种数往往出现于中等大小的河段而非最下游河段,这是因为中游河段的栖息地多样性及其复杂性一般最大[3,12]。基于此,Robert和Hitt指出,至少在可涉水性的河源溪流中,其鱼类物种数由上游至下游逐渐增多,且物种组成变化模式多为递增,因而鱼类群落呈现出嵌套格局[13]。
当前,全球的大多数溪流生态系统已遭到土地利用[14- 15]、水坝修建[16- 17]、外来物种引入[18]等人类活动的影响,其溪流鱼类资源正面临多重威胁:物种多样性严重下降,敏感性地方物种日益濒危甚至绝灭,鱼类区系同质化愈发明显[19- 20]。尽管上述人类活动对局域溪流鱼类群落的影响已得到大量报道,但迄今为止,在溪流纵向梯度这一空间尺度上,人类活动如何影响溪流鱼类群落的空间分布及其同环境因子之间的联系,尚未见报道。本研究以黄山地区陈村水库上游的河源溪流为研究区域,选择3条位置接近、大小相似、但代表不同人为干扰程度的溪流,分别自上游至下游连续设置研究样点,于2011年5月和10月完成两次取样,研究了其鱼类群落结构及其多样性的纵向梯度格局,旨在探讨人类活动对溪流鱼类群落及其纵向梯度格局的影响。本研究的具体研究目标为:(1)整体上,确定3条溪流间鱼类群落结构及其多样性是否存在差异;(2)确定每条溪流的鱼类物种组成和多样性的纵向梯度格局,及其是否存在溪流间差异;(3)确定每条溪流的局域栖息地条件对鱼类多样性和群落结构的影响,及其是否存在溪流间差异。
1 材料与方法
1.1 研究区域
青弋江流域地处安徽省境内,正源出自黄山北麓,呈东北流向,汇入长江;地处我国亚热带湿润季风气候区,全年四季分明,春温秋爽,夏热冬寒;年平均气温17.8 ℃,月平均温度为-2.1—27.5 ℃;年降水量接近2000 mm/a,但主要降水集中在4—9月份,约占全年的71.0%。陈村水电站(长江下游最大的水电站)于20世纪中后期修建于青弋江干流的中游河段,其蓄水区即为陈村水库(现名太平湖)。该水库的水源补给主要有发源于黄山的5条河源溪流,自东向西分别为麻溪河(简称麻溪)、浦溪河(浦溪)、穰溪河、舒溪河(舒溪)和清溪河(图1)。
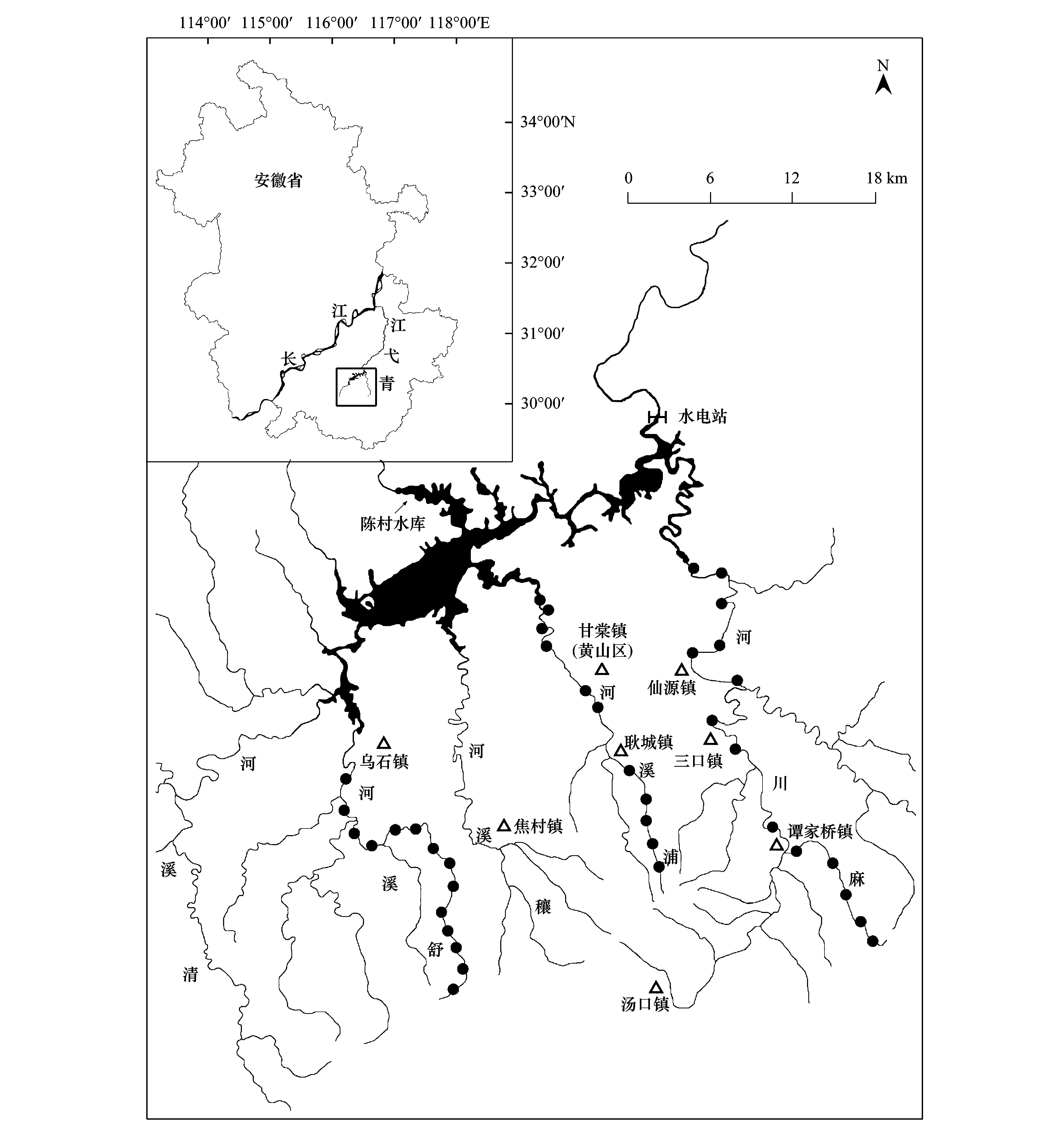
图1 黄山陈村水库上游河源溪流示意图(黑色圆圈示调查样点)Fig.1 Map of the headwater streams upper the Chencun Reservoir of the Huangshan Mountain (black circles indicated the sampling sites)
本研究选择舒溪、浦溪和麻溪为研究溪流,这3条溪流的位置接近、大小相似,但当前所承受的人为干扰强度不同。舒溪位于黄山西北侧,正源出自黄山北麓的九龙峰,流经焦村镇的部分乡村和乌石镇,全长约40 km。浦溪位于黄山北面,正源出黄山光明顶和北海诸峰,流经耿城镇和甘棠镇(黄山区县城所在地),全长约34 km。麻溪位于黄山东侧,正源出自黄山南麓的汤岭诸峰,流经汤口镇、谭家桥镇、三口镇、仙源镇,全长49 km。仅以子流域境内的乡镇数来看,舒溪、浦溪和麻溪当前所承受的人为干扰强度明显不同。舒溪子流域内的乡镇数最低,麻溪的最高。尽管浦溪仅涉及2个乡镇,但其中的甘棠镇是黄山区县城的所在地,人口居住更为密集,尤其是自1999年启动河道综合治理以来,近10 km的河道被截弯取直、砌筑河堤、水利建设。
1.2 样点设置与鱼类采集
沿上游至下游的纵向梯度,分别在舒溪、浦溪和麻溪设置研究样点(图1)。就每条溪流而言,其样点设置原则为:1)样点在空间上具有连续性,能反映溪流的纵向梯度特点;2)样点间最小间距1 km以上;3)在野外作业中,根据实际的可抵达性和可操作性来选择具体调查样点;4)每样点尽可能避开明显的人为干扰(如避开低头坝的蓄水区、居民用水排水口等);5)每样点尽可能包括所处河段的各类生境,尤其是最典型、最常见的急滩(riffle)和深潭(pool)。舒溪和麻溪的实际调查样点均14个,浦溪由于中游河段修建大量低头坝、蓄水水域大,仅设置11个样点。
2011年5月(丰水期)和10月(枯水期),共两次对上述39个样点进行鱼类标本采集。采集工具为背式电鱼器,一人电鱼,两人以捞网捕捞。每样点采用相同的捕捞努力进行取样,即采样河道长度50 m,采样时间30 min。采集后的标本在新鲜状态下进行鉴定,统计物种数与个体数。疑难种以甲醛进行固定后带回实验室进一步鉴定,剩余活体标本释放至采集地。
1.3 局域栖息地因子测度
第1次采样时,以GPS现场测度海拔。每次取样时,现场测度了10组局域栖息地变量,包括:水宽(WW,m)、水深(WD,m)、流速(CV,m/s)、流量(Di,m3/s)、水温(WT,℃)、溶氧(DO,mg/L)、pH、电导率(Co,mS/cm)、植被覆盖率(Ca,%)、底质大小(Su)。沿每采样河段,取5个等距截面分别测量水宽,再于每截面取5个等距点并分别测量水深,于每个等距点的60%水深处测量流速(便携式流速仪,FP111,美国)。使用便携式水文仪现场测度水温、电导率、溶氧(JENCO6350,JENCO9010)。根据每样点的平均水深、水宽和流速,估算流量大小:Di=WW×WD×CV。参照Bain等[21]的方法,根据底质结构的直径大小以目测打分法估算底质类型,共6类(0,<0.06 mm;1,0.06—1 mm;2,2—5 mm;3,15—63 mm;4,64—256 mm;5,>256 mm);沿着采样点中间截面,将河道分为10等分对其底质打分,共10个数据,取其平均值反映底质大小。
1.4 数据分析
根据某物种的出现样点数与总样点数的比值确定该物种的出现频率(Fi),Fi≥40%、10%≤Fi<40%、Fi<10%的物种分别被视为常见种、偶见种和稀有种[22]:
Fi=(Si/S)×100%
式中,Si为物种i的出现样点数,S为全部样点数。根据某物种的个体数量与该样点的全部渔获物数量的比值确定相对多度(Pi):
Pi=(Ni/N)×100%
式中,Ni为物种i的个体数,N为全部物种的个体数。根据相对多度确定每样点的鱼类香农指数(H):
H=-∑(Pi)(log2Pi)
式中,Pi为物种i的相对多度。
运用双因素方差分析(Two-way ANOVA)检验空间因素(3条溪流)和时间因素(2个季节)对鱼类多样性和局域栖息地因子的影响,其中鱼类多样性分别按照鱼类物种数、个体数、香农指数独立进行,局域栖息地因子按照溶氧、水温、pH值、电导率、水宽、水深、流苏、流量和植被覆盖率独立进行。运用Pearson′s相关分析分别检验各溪流各季度的鱼类物种数、个体数和香威指数同海拔之间的关系;运用逐步线性回归分别检验局域栖息地变量对3条溪流中的鱼类物种数、个体数和香威指数的影响。为满足数据的正态性和方差齐性,将数据log(X+1)转换。以上分析均在SPSS13.0软件下进行,视P<0.05为显著性水平。
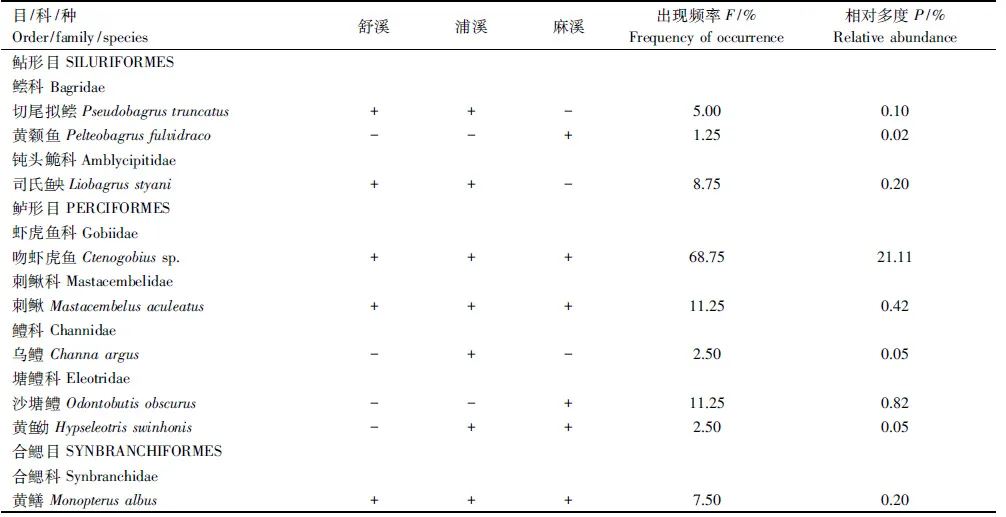
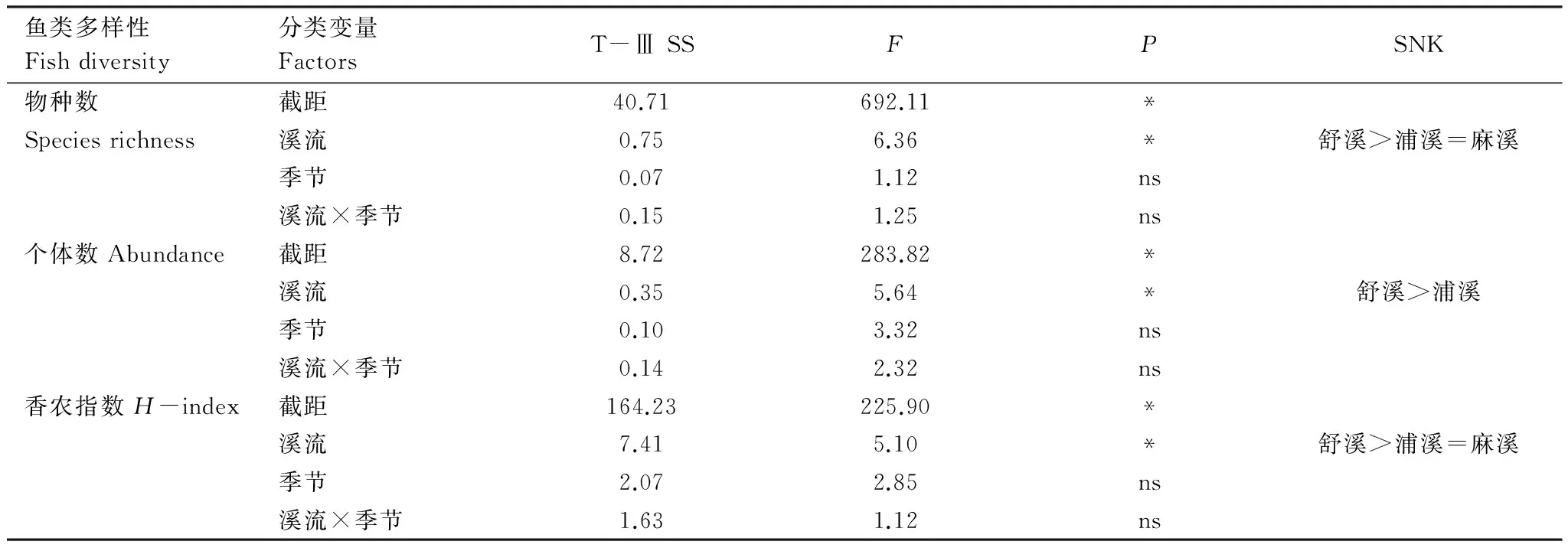
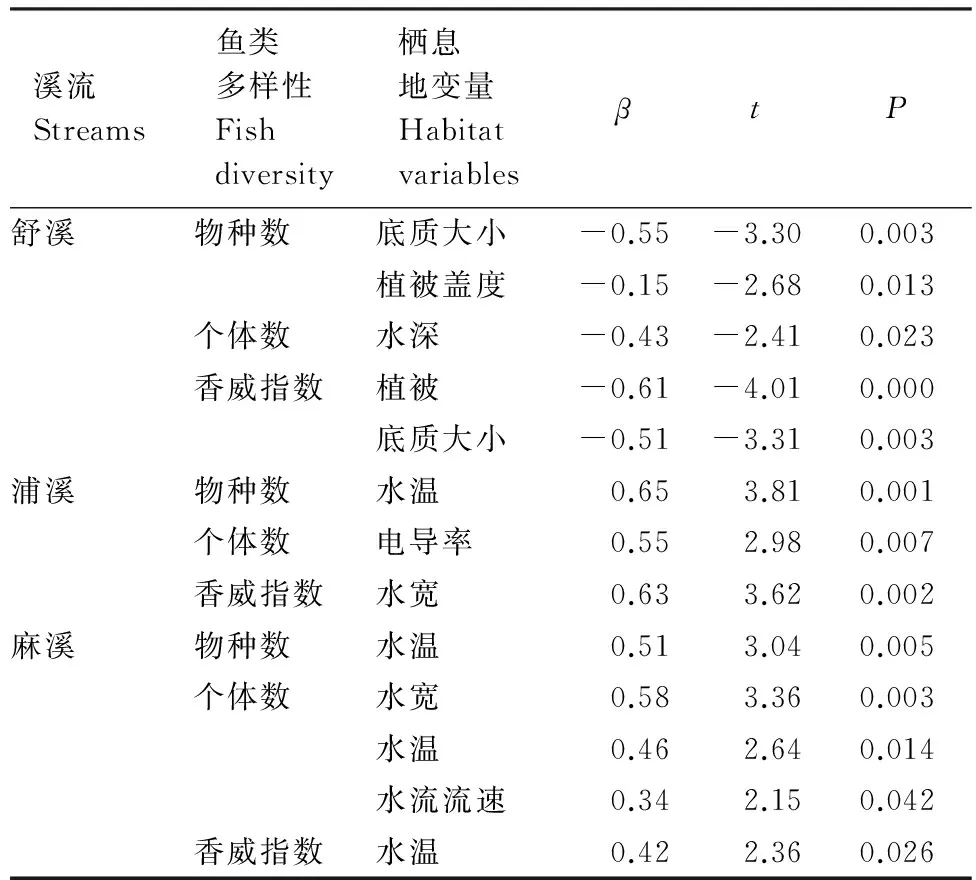
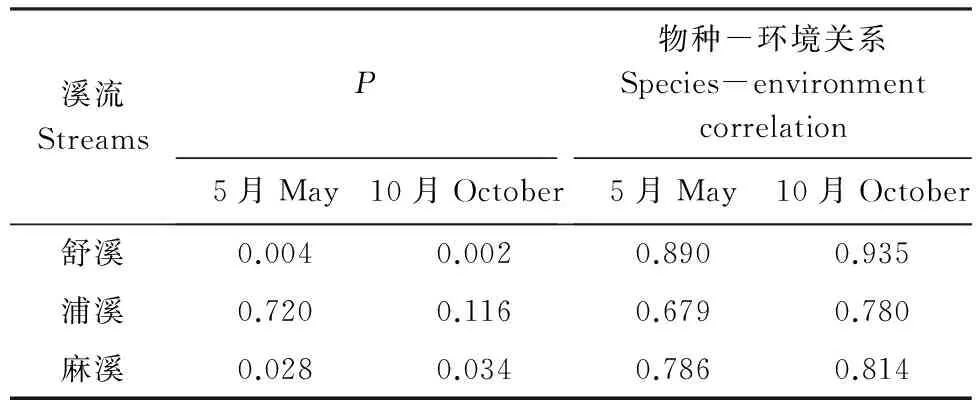
在Primer5.0软件下,运用双因素交叉相似性分析(Two-way crossed ANOSIM)检验溪流和季节对鱼类群落结构的影响,根据R值确定鱼类群落的分离程度:R>0.75,群落完全分离;0.5 以Canoco 4.5软件为工具,运用冗余分析(Redundancy analysis,RDA)检验海拔对3条溪流的鱼类物种组成的影响,以及检验局域栖息地变量对3条溪流鱼类群落结构的影响。根据向前选择程序(forward selection procedure)确定哪些变量最终被保留在RDA分析中,再以手动选择(manual selection)对每个变量的贡献率和显著性进行计算,并应用Monte Carlo置换检验,将显著性(P<0.05)变量选入模型[24]。为降低极端数据的负面权重,全部鱼类数据和环境数据在log(X+1)转换后进行分析。 2.1 鱼类物种组成概况 共采集鱼类4041尾,隶属4目10科28种。鲤形目鱼类物种最多,占全部物种的67.9%。每样点采集的物种数为5.2±3.1(平均值±标准差),鱼类个体数为(51.2±44.9)尾。舒溪和麻溪的鱼类各24种,浦溪鱼类22种。黄颡鱼和沙塘鳢仅见于麻溪,而乌鳢仅见于浦溪。宽鳍鱲最常见且数量最大,其出现频率和相对多度分别达到77.5%和35.1%;吻虾虎鱼次之(出现频率和相对多度分别为68.8%和21.1%;光唇鱼和高体鳑鲏出现频率(>30.0%)和相对多度(>6.0%)也较高。乌鳢和黄鱼幼仅见于2次采样,累计数量仅2尾;黄颡鱼仅见于1个样方,仅1尾(表1)。 表1 鱼类物种组成及其出现频率与相对多度Table 1 Species composition, frequency of the occurrence (F) and relative abundance (P) fishes collected 续表 + 和 - 分别代表某物种在某溪流中是否被采集 2.2 局域栖息地条件 运用双因素方差检验溪流和季节对各局域栖息地因子的影响,结果显示,溶氧、电导率率、水宽、底质大小和植被覆盖率存在显著性的溪流间差异(P<0.05,F=3.76(溶氧)、4.67(电导率)、3.58(水宽)、3.98(底质)和3.64(植被));经post-hoc多重比较,舒溪的溶氧和水宽均显著低于浦溪和麻溪(P<0.05),但其底质和植被覆盖率均显著高于浦溪和麻溪(P<0.05),而电导率显著差异仅见于浦溪和麻溪间(P<0.05)。pH值、水温和流量存在显著性的季节动态(P<0.05,F=7.39(pH)、6.50(水温)、5.78(流量)),同5月份相比,10月份的pH值显著上升,但水温和流量显著降低(P<0.05)。此外,溪流和季节仅对水温(F=9.95)、pH(F=7.39)和电导率(F=4.01)具有显著性的交互影响(P<0.05)。 2.3 鱼类多样性 2.3.1 鱼类多样性的时空变化 运用双因素方差分析检验溪流和季节对鱼类多样性的影响,结果显示,鱼类物种数、个体数和香农指数都存在显著的溪流间差异(P<0.05),但其季节变化无显著性(P>0.05),溪流与季节对鱼类多样性无显著交互影响(P>0.05)。舒溪的鱼类物种数(6.61±2.73种)和香农指数(1.87±0.70)均显著高于麻溪(物种数:4.18±2.87种,香农指数:1.20±0.92)和浦溪(4.45±3.41种,1.28±0.98)(P<0.05),而鱼类个体数显著差异仅见于舒溪(78.11±57.53尾)和浦溪间(31.17±28.60尾)(P<0.05)(表2)。 2.3.2 鱼类多样性同海拔的关系 运用Pearson′s相关分析分别检验各溪流各季度的鱼类物种数、个体数和香威指数同海拔之间的关系,结果显示,就鱼类物种数而言,舒溪物种数与海拔的相关性在5月和10月都具有显著性(P<0.05),麻溪物种数仅在5月份与海拔显著相关(P<0.05),而浦溪鱼类物种数与海拔无显著性相关(P>0.05)。鱼类个体数与海拔的显著性相关仅见于舒溪5月份的渔获物(P<0.05),而各溪流各季度下的香威指数与海拔都无任何显著性相关(P>0.05)(表3)。 2.3.3 局域栖息地变量对鱼类多样性的影响 运用逐步线性回归分别检验局域栖息地变量对3条溪流中的鱼类物种数、个体数和香威指数的影响,结果显示,舒溪鱼类物种数与底质大小和植被盖度呈显著性负相关(P<0.05),但浦溪和麻溪物种数均与水温呈 表2 双因素方差分析检验不同溪流和季节对鱼类物种数、个体数和香农指数的影响Table 2 Variations in fish species richness, abundance and H-index across streams and seasons based on Two-way ANOVA T-Ⅲ SS,Type Ⅲ平方和;SNK,Student-Newman-Keuls检验;*,P<0.05;ns,P>0.05 表3 鱼类物种数、个体数和香威指数同海拔的Pearson′s相关性分析Table 3 Correlations between elevation and fish species richness, abundance and H-index based on Pearson′s correlation analysis 表4 逐步线性回归解析显著影响鱼类物种数、个体数和香威指数的局域栖息地变量 Table 4 Key local habitat variables affecting fish species, abundance and H-index based on stepwise linear regression analysis 溪流Streams鱼类多样性Fishdiversity栖息地变量HabitatvariablesβtP舒溪物种数底质大小-0.55-3.300.003植被盖度-0.15-2.680.013个体数水深-0.43-2.410.023香威指数植被-0.61-4.010.000底质大小-0.51-3.310.003浦溪物种数水温0.653.810.001个体数电导率0.552.980.007香威指数水宽0.633.620.002麻溪物种数水温0.513.040.005个体数水宽0.583.360.003水温0.462.640.014水流流速0.342.150.042香威指数水温0.422.360.026 显著性正相关(P<0.05)。舒溪和浦溪鱼类个体数分别仅受水深(负相关)和电导率(正相关)的显著性影响(P<0.05),而麻溪鱼类个体数则受水宽(负相关)、水温和水流流速(正相关)3个栖息地变量的显著影响(P<0.05)。舒溪鱼类香威指数同物种数一样与底质大小和植被盖度显著相关(P<0.05),而浦溪和麻溪鱼类香威指数则分别仅受到水宽和水温(正相关)的显著影响(P<0.05)(表4)。 2.4 鱼类群落结构 2.4.1 鱼类群落结构的时空变化 运用双因素交叉相似性分析检验溪流和季节对鱼类群落结构的影响,结果显示,季节间鱼类群落结构几乎完全重叠(GlobalR=0.05)且无显著性差异(P>0.05),溪流间鱼类群落尽管存在明显重叠(GlobalR=0.05)但存在显著性差异(P<0.01)。当对3条溪流的鱼类群落结构进行两两比较时,发现浦溪和麻溪的鱼类群落结构几乎完全重叠且无显著性差异(R=0.02,P>0.05),两者都与舒溪鱼类群落结构尽管存在明显重叠但差异显著(R=0.21,P<0.01,舒溪-浦溪;R=0.17,P<0.01,舒溪-麻溪)。 运用相似性百分比分析分别确定3条溪流中维持溪流内鱼类群落结构相似性的重要物种(累积贡献率达90%),结果显示,舒溪、浦溪和麻溪的重要物种分别为5种、7种和5种,3条溪流的前2位重要物种都是宽鳍鱲和吻虾虎鱼,但这2种鱼类在舒溪中具有更高的相对多度。光唇鱼在舒溪和浦溪均为第三重要物种,但在舒溪具有更高的多度;高体鳑鲏同属浦溪和麻溪的重要物种。另外的7种鱼类仅在1条溪流中具有重要性,其中原缨口鳅和稀有花鳅是舒溪重要物种,泥鳅、马口鱼和麦穗鱼是浦溪重要物种,而尖头魚歲和沙塘鳢则是麻溪重要物种(表5)。 表5 相似性百分比分析解析维持同一溪流鱼类群落结构相似性的重要物种Table 5 Important species for the similarity of fish assemblages within the identical stream based on SIMPER analysis 按贡献率大小列出物种,累积贡献率达90%后不再罗列 2.4.2 鱼类物种组成同海拔的关系 表6 冗余分析检验海拔与鱼类物种组成的相关性 Table 6 Correlation between elevation and fish species composition based on RDA 溪流StreamsP5月May10月October物种-环境关系Species-environmentcorrelation5月May10月October舒溪0.0040.0020.8900.935浦溪0.7200.1160.6790.780麻溪0.0280.0340.7860.814 运用冗余分析检验海拔对3条溪流2个季度鱼类物种组成的影响,结果显示,海拔对浦溪鱼类物种组成无显著性影响(P>0.05),但对舒溪和浦溪的鱼类物种组成具有显著影响(P<0.05),其中在舒溪中达到极显著水平(P<0.01);就鱼类物种组成与海拔的相关性来说,也是舒溪的最高,浦溪的最低,麻溪居中(表6)。 2.4.3 局域栖息地变量对鱼类群落结构的影响 运用冗余分析检验局域栖息地变量对3条溪流鱼类群落结构的影响,结果显示,根据RDA生成的4个轴对全部物种变异的解释率,它们分别解释了43.1%(舒溪)、46.5%(浦溪)河46.9%(麻溪)的物种变异;根据4个轴对全部物种-环境关系变异的解释率,它们分别解释了87.1%(舒溪)、86.5%和85.4%的物种-环境关系变异。舒溪鱼类群落结构受到底质、电导率、水温和水深的显著性影响(P<0.05),其中底质的影响最大,但底质对浦溪和麻溪的鱼类群落结构无显著性影响(P>0.05);水宽、电导率、水温对浦溪和麻溪的鱼类群落结构都有着显著影响(P<0.05),此外,浦溪和麻溪鱼类群落结构还受到流量(浦溪)与pH值和溶氧的显著影响(P<0.05)(图2)。 已有大量研究表明,土地利用[14- 15]、城镇化[25- 26]、河道治理[27]、水利工程[16- 17]等人类活动对溪流生态系统的栖息地条件及生物群落有着严重影响和危害,如:人为干扰可降低溪流的栖息地多样性和复杂性,破坏溪流中原有的“急滩(riffle)-深潭(pool)”交替格局,扰乱了溪流中原有的水流流态和水文节律,减少溪流与沿岸陆地的临界面,等等[15,27- 28]。上述栖息地条件的变化对溪流鱼类的物种组成及其多样性产生深远影响[3,29- 30]。本研究结果显示,同舒溪的水宽显著低于浦溪和麻溪,但前者的底质大小和植被覆盖率却显著高于后者。本研究中舒溪、浦溪和麻溪的地理位置相近,同属青弋江流域陈村水库上游的3条大小相近的溪流,因此,有理由相信本研究所观察到的溪流间水宽、底质和植被盖度等局域栖息地条件差异极有可能是人类活动所造成的。相对于舒溪而言,浦溪和麻溪正承受着更多样、更严重的人为干扰,仅以子流域内的乡镇数量来看,舒溪、浦溪和麻溪子流域内坐落的乡镇分别为1个(乌石镇,位于舒溪的下游段)、2个(耿城镇和甘棠镇,其中甘棠镇为目前黄山区的县城所在地)和4个(汤口镇、谭家桥镇、三口镇和仙源镇,其中汤口镇为黄山风景区南大门的所在地,也是黄山每年数百万游客的歇脚地)。已有报道显示,城镇化发展、人口居住密集、人类活动频繁等,通过对溪流岸边陆地生态系统的利用(公路、住房、农田等)及对溪流水资源的直接利用,将会严重影响和破坏溪流生态系统的水化学和物理栖息地,并因此对鱼类的物种组成及其数量施加重要影响[25- 26]。在本研究结果中,在鱼类多样性上,浦溪和麻溪的鱼类物种数、个体数和香农指数均显著低于舒溪;在物种组成上,同舒溪相比,浦溪和麻溪中宽鳍鱲、吻虾虎鱼、光唇鱼、原缨口鳅和稀有花鳅等数量下降,但泥鳅、麦穗鱼、高体鰟鲏和沙塘鳢等数量增多。需要指出的是,在本研究区域内,宽鳍鱲、光唇鱼、原缨口鳅等属典型的敏感性地方鱼类,一般分布于山区溪流水域,而泥鳅、麦穗鱼、高体鰟鲏等则属于耐受性的广布鱼类,常分布于低地缓流或静水水域[31- 32]。因此,本研究表明,城镇化发展及其他人类活动不仅降低了溪流鱼类的物种多样性,也改变其物种组成,原有的地方敏感型鱼类逐渐被一些广布耐受性鱼类所替代。 已有研究表明,在美国的一些山地河源溪流中,土地利用和森林砍伐等人类活动通过改变溪流中的物理栖息地条件,降低了地方敏感性鱼类的适合度但提高了其他耐受性鱼类的适合度,不仅导致了溪流生态系统中鱼类区系的同质化现象,也引发了“本土入侵”现象——原栖居于某流域中下游低地河段的鱼类成功入侵其上游的河源溪流[19,33]。在本研究中,3条研究溪流同属陈村水库的入库溪流,尽管目前未见该水库的鱼类资源及其物种组成的报道,但考虑到该水库作为一类静水水体,有理由相信在浦溪和麻溪中非常常见的麦穗鱼、高体鰟鲏等静水性或缓流性鱼类在该水库中有分布。根据Johnson等所提出的“水坝入侵者”概念[34],大型水坝通过蓄水改变了局域水文条件,能够促进外来水生生物对蓄水区的成功入侵和建群,并加大该蓄水区上游河段的被入侵风险。由此,我们推测,陈村水库在本研究区域内充当了一个类似于“本土入侵鱼类物种库”的角色,库区的很多耐受性鱼类都具有潜在的上溯入侵河源溪流的风险,而人类活动对河源溪流水文条件及其物理栖息地条件等的影响,可直接导致这些耐受性鱼类成功实现对河源溪流的“本土入侵”。 沿河源至下游的纵向梯度,溪流生态系统中众多非生物环境因子和生物因子及其生态过程都呈现出显著的空间异质性,包括能量生产与消费[2- 3]、栖息地容纳量及其多样性[4- 5]、环境稳定性等[6- 7],这造成了溪流鱼类群落也呈现出相应的纵向梯度格局,即:鱼类物种组成通过递增或替代模式而变化,物种数则逐渐上升[5,13,35]。在本研究中,分别根据线性相关分析和冗余分析,舒溪的鱼类物种数与物种组成均与海拔显著相关,这进一步证实了上述有关溪流鱼类群落沿纵向梯度的一般分布格局。但是,本研究还显示,鱼类物种数及其组成同海拔的相关性,在麻溪中明显减弱,甚至在浦溪中则完全消失。已有研究表明,诸如土地利用、城镇化、河道治理、水利建设等人类活动,改变了局域栖息地条件和水流流态,破坏了溪流中理化条件的空间连续性,由此改变了溪流鱼类及其他生物类群的纵向梯度格局,譬如,Ward和Stanford在河流连续统概念的基础上,基于溪流生态系统中普遍存在的人为干扰(如水利建设),进一步提出了溪流“连续中断概念”,该概念较为详尽的描述了人类活动对溪流中的环境因素与生物成分及其生态过程的影响[36]。此外,上述人类活动也降低了溪流中栖息地多样性,并引起栖息地同质化现象,由此造成溪流鱼类区系的同质化[19,33]。基于此,无论是溪流连续中断还是栖息地同质化,都将改变局域鱼类群落的物种组成及其数量,由此改变溪流鱼类原有的纵向梯度格局,这可解释本研究中麻溪和浦溪的鱼类群落同海拔的关系较舒溪明显弱化甚至完全消失这一观察结果。 本研究还表明,除水深、电导率以外,底质大小和植被盖度对舒溪的鱼类群落有着重要影响,但对浦溪和麻溪的鱼类群落却无显著影响。底质是反映溪流栖息地质量的重要指标之一,可为很多溪流鱼类提供重要的栖息地场所,鱼类的很多活动(如摄食、繁殖等)都依赖于底质条件,甚至有时,鱼类也通过底质来逃避被捕食风险和躲避灾害(如洪水)[21]。不同的溪流鱼类物种对底质的选择性往往存在差异,如光唇鱼、原缨口鳅往往栖息于大石块的底缝中,稀有花鳅往往栖息于水流清急、底质砂质的水体中,吻虾虎鱼也是栖息于大小不等的石块上及其缝隙间,宽鳍鱲对底质的选择相对宽泛,当属溪流生态系统中的泛化种[31,37]。城镇化发展及其所带来的土地利用、河道治理、水利建设等,可严重破坏溪流的底质条件,如:水利建设的坝上蓄水作用,可导致蓄水区沉积作用加大,由此导致泥沙沉积[17];河道治理可直接改变河床的基本结构,造成底质条件的彻底变化[27];森林砍伐、土地利用,可加大山区溪流系统的水土流失,并由此影响底质条件[33]。同舒溪相比,浦溪和麻溪的植被覆盖率减少且底质减小,这种生境变化不仅造成了其鱼类物种组成及其数量的变化,也改变了鱼类群落同局域栖息地条件之间的联系。 综上所述,本研究表明,诸如城镇化发展、土地利用、河道治理、水利建设等人类活动改变了溪流生态系统中的栖息地条件,降低了溪流鱼类物种多样性,改变了鱼类物种组成(敏感性地方物种减少、耐受性广布物种增多),破坏了鱼类群落原有的纵向梯度格局,并导致了鱼类-栖息地关系的变化。诚然,本研究中有关人类活动的分析尚存在不足,仍处于较粗放的描述性研究阶段。在未来的有关溪流鱼类群落生态学研究中,有必要引入地理信息系统的研究手段,将自然景观因素与人为景观因素进行量化,从而有效定性和定量分析人类活动对溪流鱼类多样性及其物种组成的影响。 致谢:张一新博士对本文写作给予帮助,特此致谢。 [1] Allan J D, Castillo M M. Stream Ecology: Structure and Function of Running Waters. 2nd ed. Dordrecht: Springer Press, 2007. [2] Vannote R L, Minshall G W, Cummins K W, Sedell J R, Cushing C E. The river continuum concept. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37(1): 130- 137. [3] Oberdorff T, Guilbert E, Lucchetta J C. Patterns of fish species richness in the Seine River basin, France. Hydrobiologia, 1993, 259(3): 157- 167. [4] Sheldon A L. Species diversity and longitudinal succession in stream fishes. Ecology, 1968, 49(2): 193- 198. [5] Schlosser I J. Fish community structure and function along two habitat gradients in a headwater stream. Ecological Monographs, 1982, 52(4): 395- 414. [6] Horwitz R J. Temporal variability patterns and the distributional patterns of stream fishes. Ecological Monographs, 1978, 48(3): 307- 321. [7] Taylor C M, Warren M L Jr. Dynamics in species composition of stream fish assemblages: environmental variability and nested subsets. Ecology, 2001, 82(8): 2320- 2330. [8] Oberdorff T, Porcherc J P. An index of biotic integrity to assess biological impacts of salmonid farm effluents on receiving waters. Aquaculture, 1994, 119(2/3): 219- 235. [9] Mazzoni R, Lobón-Cerviá J. Longitudinal structure, density and production rates of a neotropical stream fish assemblage: the river Ubatiba in the Serra do Mar, southeast Brazil. Ecography, 2000, 23(5): 588- 602. [10] Torgersen C E, Baxter C V, Li H W, McIntosh B A. Landscape influences on longitudinal patterns of river fishes: spatially continuous analysis of fish-habitat relationships. American Fisheries Society, 2006, 48: 473- 492. [11] Suvarnaraksha A, Lek S, Lek-Ang S, Jutagate T. Fish diversity and assemblage patterns along the longitudinal gradient of a tropical river in the Indo-Burma hotspot region (Ping-Wang River Basin, Thailand). Hydrobiologia, 2012, 694(1): 153- 169. [12] Minshall G W, Cummins K W, Petersen R C, Cushing C E, Bruns D A, Sedell J R, Vannote R L. Developments in stream ecosystem theory. Canadian Journal of Fisheries and Aquatic Sciences, 1985, 42(5): 1045- 1055. [13] Roberts J H, Hitt N P. Longitudinal structure in temperate stream fish communities: evaluating conceptual models with temporal data. American Fisheries Society Symposium, 2010, 73: 281- 302. [14] Harding J S, Benfield E F, Bolstad P V, Helfman G S, Jones E B D III. Stream biodiversity: the ghost of land use past. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(25): 14843- 14847. [15] Allan J D. Landscapes and Riverscapes: The influence of land use on stream ecosystems. Annual Review of Ecology, Evolution, and Systematics, 2004, 35: 257- 284. [16] Rosenberg A, Bigford T E, Leathery S, Hill R L, Bickers K. Ecosystem approaches to fishery management through essential fish habitat. Bulletin of Marine Science, 2000, 66(3): 535- 542. [17] March J G, Benstead J P, Pringle C M, Scatena F N. Damming tropical island streams: problems, solutions, and alternatives. BioScience, 2003, 53(11): 1069- 1078. [18] Rahel F J, Olden J D. Assessing the effects of climate change on aquatic invasive species. Conservation Biology, 2008, 22(3): 521- 533. [19] Rahel F J. Homogenization of freshwater faunas. Annual Review of Ecology and Systematics, 2002, 33: 291- 315. [20] Vitule J R S, Skóra F, Abilhoa V. Homogenization of freshwater fish faunas after the elimination of a natural barrier by a dam in Neotropics. Diversity and Distributions, 2012, 18(2): 111- 120. [21] Bain M B, Stevenson N J. Aquatic Habitat Assessment: Common Methods. Bethesda: American Fisheries Society, 1999. [22] 代应贵, 李敏. 梵净山及邻近地区鱼类资源的现状. 生物多样性, 2006, 14 (1): 55- 64. [23] Clarke K R, Warwick R M. Changes in Marine Communities: An Approach to Statistical Analysis and Interpretation. 2nd ed. Plymouth: PRIMER-E Ltd, 2001. [24] ter Braak C J F, Verdonschot P F M. Canonical correspondence analysis and related multivariate methods in aquatic ecology. Aquatic Sciences, 1995, 57(3): 255- 289. [25] Wang L, Lyons J, Kanehl P, Bannerman R. Impacts of urbanization on stream habitat and fish across multiple spatial scales. Environmental Management, 2001, 28(2): 255- 266. [26] Morgan R P, Cushman S F. Urbanization effects on stream fish assemblages in Maryland, USA. Journal of the North American Benthological Society, 2005, 24(3): 643- 655. [27] Gehrke P C, Brown P, Schiller C B, Moffatt D B, Bruce A M. River regulation and fish communities in the Murray-Darling river system, Australia. Regulated Rivers: Research & Management, 1995, 11(3/4): 363- 375. [28] Poff N L, Hart D D. How dams vary and why it matters for the emerging science of dam removal. BioScience, 52(8): 659- 668. [29] 严云志, 占姚军, 储玲, 陈毅峰, 邬春华. 溪流大小及其空间位置对鱼类群落结构的影响. 水生生物学报, 2010, 34(5): 1022- 1030. [30] Heino J, Mykrä H, Kotanen J, Muotka T. Ecological filters and variability in stream macroinvertebrate communities: do taxonomic and functional structure follow the same path? Ecography, 2007, 30(2): 217- 230. [31] Yan Y Z, Xiang X Y, Chu L, Zhan Y J, Fu C Z. Influences of local habitat and stream spatial position on fish assemblages in a dammed watershed, the Qingyi Stream, China. Ecology of Freshwater Fish, 2011, 20(2): 199- 208. [32] Yan Y Z, Wang H, Zhu R, Chu L, Chen Y F. Influences of low-head dams on the fish assemblages in the headwater streams of the Qingyi watershed, China. Environmental Biology of Fishes, 2013, 96(4): 495- 506. [33] Scott M C, Helfman G S. Native Invasions, homogenization, and the mismeasure of integrity of fish assemblages. Fisheries, 2001, 26(11): 6- 15. [34] Johnson P T J, Olden J D, Zanden M J V. Dam invaders: impoundments facilitate biological invasions into freshwaters. Frontiers in Ecology and the Environment, 2008, 6(7): 357- 363. [35] Matthews W J. Patterns in Freshwater Fish Ecology. Dordrecht: Kluwer Academic Publishers, 1998. [36] Ward J V, Stanford J A. The serial discontinuity concept of lotic ecosystems // Fontaine T D, Bartell S M, eds. Dynamics of Lotic Ecosystems. Ann Arbor: Ann Arbor Science, 1983: 29- 42. [37] 朱仁, 严云志, 孙建建, 黄海玲, 谈小龙, 林璐. 黄山陈村水库河源溪流鱼类群落的食性. 生态学杂志, 2012, 31(2): 359- 366. Fish assemblages and longitudinal patterns in the headwater streams of the Chencun Reservoir in the Huangshan Area CHU Ling, WANG Wenjian, YAN Lili, YAN Yunzhi*, ZHU Ren, SI Chun ProvincialKeyLaboratoryofBioticEnvironmentalandEcologicalSafety,CollegeofLifeSciences,AnhuiNormalUniversity,Wuhu241000,China Studying the spatial and temporal patterns of stream fish assemblages and identifying how human land-use activities impact these patterns are crucial for fish species conservation, ecosystem restoration and management. The objectives of this study were (1) to examine the influences of human perturbations on the longitudinal patterns of fish species diversity and assemblage structures in headwater streams, (2) to assess the correlations between local habitat factors and fish assemblages, and their longitudinal and temporal patterns. We sampled fish at 39 segments during May and October 2011 from three headwater streams of the Chencun Reservoir in the Huangshan Area, which were influenced by different extents of human activities. A total of 4041 fish were collected, representing four orders, 10 families, and 28 species, among which family Cypriniformes comprised 67.9% of total species richness. 24, 22 and 24 species were sampled from the Shuxi, Puxi and Maxi Streams, respectively. Two-way ANOVA was used to test the influences of streams and seasons on habitat and fish-diversity variables, respectively. Results showed that habitat variables varied significantly across three streams and in different seasons. Results from the Shuxi Stream showed lower numbers in dissolved oxygen and wetted width but higher levels in substrate size and canopy cover than those from the Puxi and Maxi Streams, and May showed lower pH but higher water temperature and discharge than October. However, species richness, fish abundance and the Shannon′s index varied significantly across streams but not between seasons. In overall, fish diversity was higher in the Shuxi Stream than that in the Puxi and Maxi Streams. Results of two-way crossed ANOSIM indicated that fish assemblage structures varied substantially across streams but not between seasons. The assemblage structures in the Puxi and Maxi Streams did not show significant differences, however, they significantly differed from those in the Shuxi Stream. SIMPER analysis indicated that some endemic specialized species (e.g.,Zaccoplatypus,Acrossocheilusfasciatus,Vanmaneniastenosoma) were more abundant in the Shuxi Stream, while those cosmic generalized species (e.g.,Misgurnusanguillicaudatus,Pseudorasboraparva,Rhodeusocellatus) were more in the Puxi and Maxi Streams. The results of Pearson′s correlation and redundancy analysis showed that fish species richness in the Shuxi Stream significantly increased with elevation decreasing in both May and October, respectively. However, this "species richness-elevation" correlation lessened in the Maxi Stream and even disappeared in the Puxi Stream. Similarly, elevation showed significant correlation with assemblage structures in the Shuxi and Maxi Streams but not the Puxi Stream. In addition, the effects of local habitat variables on fish assemblage structures were examined using linear regression model and redundancy analysis, respectively. Results showed that fish assemblages in the Shuxi Stream were significantly affected by substrate and canopy, but those in the Puxi and Maxi Streams were related to water temperature and wetted width. In conclusion, our results suggest that, at the sub-watershed scale, the alteration of local habitat conditions in headwater streams associated with human activities (e.g., urbanization, land-use and river-regulation) may decrease stream fish diversity, modify the correlations between local habitat and fish assemblage, and change the longitudinal pattern of fish assemblages. stream fish; assemblage structure; species diversity; longitudinal pattern; human disturbance 国家自然科学基金(31172120, 31372227); 国家重点基础研究发展计划项目(2009CB119200) 2013- 04- 14; 日期:2014- 04- 03 10.5846/stxb201304140706 *通讯作者Corresponding author.E-mail: yanyunzhi7677@126.com 储玲,王文剑,闫莉莉,严云志,朱仁,司春.黄山陈村水库上游河源溪流的鱼类群落及其纵向梯度格局.生态学报,2015,35(3):900- 910. Chu L, Wang W J, Yan L L, Yan Y Z, Zhu R, Si C.Fish assemblages and longitudinal patterns in the headwater streams of the Chencun Reservoir in the Huangshan Area.Acta Ecologica Sinica,2015,35(3):900- 910.2 结果



3 讨论
