浙江天童太白山不同群落植物构型比较
2015-03-10张志浩杨晓东孙宝伟黄海侠马文济史青茹阎恩荣
张志浩,杨晓东,孙宝伟,黄海侠,马文济,史青茹,阎恩荣,*
1 华东师范大学生态与环境科学学院,上海 200241 2 浙江天童森林生态系统国家野外科学观测研究站,宁波 315114
浙江天童太白山不同群落植物构型比较
张志浩1,2,杨晓东1,2,孙宝伟1,2,黄海侠1,2,马文济1,2,史青茹1,2,阎恩荣1,2,*
1 华东师范大学生态与环境科学学院,上海 200241 2 浙江天童森林生态系统国家野外科学观测研究站,宁波 315114
植物构型是植株构件在空间上的分配方式,反映了植物对环境的响应策略。通过对浙江天童太白山海拔差异很小的栲树(Castanopsisfargesii)、小叶青冈(Cyclobalanopsisgracilis)和云山青冈(Cyclobalanopsissessilifolia)群落类型中所有植株的树高、树冠厚度、树冠面积、叶片聚集度、枝下高和距地45 cm基径等植物构型性状,以及树冠曝光指数、土壤含水率、空气温湿度、土壤pH值和风速6个环境因子的测定,分别分析乔灌木层植物构型性状及性状关系在3个群落间的变化规律。结果表明:(1)从栲树到小叶青冈至云山青冈群落,灌木层的树高、树冠厚度、枝下高和距地45 cm基径增加,叶片聚集度减小;乔木层的树高、树冠厚度、树冠面积、枝下高和距地45 cm基径均减小,叶片聚集度增大;(2) 3个群落灌木层构型性状间显著相关(P< 0.001),而乔木层只在中低海拔群落存在相关性;(3)从栲树到小叶青冈至云山青冈群落,乔灌木层的冠层曝光指数显著增加(P< 0.05);(4)多元逐步回归表明,树冠曝光指数对灌木层构型性状变异的贡献最大,而风速、土壤含水率和pH值对乔木构型性状的变异起主导作用。综上得知,天童太白山乔灌木植物在不同群落间存在构型分异,植物对光资源的竞争是引起灌木构型在不同群落间变化的主要驱动因子,而对乔木植物,其构型变化更多受到风速和土壤含水量的影响。
植物构型;海拔;冠层曝光指数;风速;土壤含水量;常绿阔叶林
植物构型是植株建造结构在空间上的配置模式和形态体现,包括植株高度、冠层面积、枝条伸展方向和枝叶的空间搭配方式等。它与光捕获、水运输、植物抗机械损伤和竞争的能力有关,可指示植物的生活史策略[1- 2]。如树高和树冠面积反映植物在垂直和水平方向上的光资源竞争能力[1]。叶下高联系植物叶片光合作用在群落内能利用光资源的最低高度。基径与树干对冠层和高度的机械支撑有关[3]。
植物构型在群落间的变异反映了植被对资源环境变异的适应与响应[4]。因此,不同群落间环境因子的差异,如由海拔改变而引起的林内风速和光照强度、土壤湿度、温度等的改变[5],会使植物构型在群落间出现分异。此外,不同构型性状间的相关关系也能反映植物在各器官间的营养投资策略,以及与水分运输、机械支持和光资源获取间的权衡。在群落环境条件改变时,植物会统筹各个构型性状的物质投入[6- 7],使各构型性状相关性随群落转化发生改变。
Poorter等认为,光是导致热带雨林内乔冠层植物间构型差异的最主要因子[8],因为群落内部光资源变化诱导了植物构型变异[3],而其他环境因子由于其在环境中的非限制性,对构型在不同植物生活型间变化的影响不大。然而,对于常绿阔叶林植物,土壤养分、风等因子的分布格局在群落间变异较大,在一定程度上影响植物的生活史过程。如随海拔上升,风干扰和光照强度增加、土壤湿度和温度降低等,均能从不同侧面增加乔木层植物的环境胁迫性[9],引起构型改变。相反,灌木层处于群落下层,土壤水分、风等环境因子对构型的影响比乔木层小,光照是引起灌木构型改变的主要限制因素。因此,乔木和灌木的构型在不同群落内也会表达出不同的环境适应性。但截至目前,对于以上结论仅限于科学推测,有关常绿阔叶林植物构型变异的报道甚少。
基于此,本文选择浙江天童国家森林公园内太白山的3个典型常绿阔叶林群落,通过对植物构型、冠层曝光指数和环境因子进行调查及分析。力图回答如下三个问题:(1)不同群落之间植物构型是否存在分异?(2)随群落转变,植物构型间关联性会发生改变,那么乔、灌木层的变化是否不同?(3)除光资源外,其他环境因子是否也影响乔、灌木植物的构型特征?
1 材料和方法
1.1 研究区概况
浙江天童国家森林公园位于浙江省鄞县东南部(N 29°48′,E 121°47′),面积达349 hm2,森林植被保存良好。全年温和多雨,四季分明,年均温度为16.2 ℃,年降水量为1374.7 mm,年蒸发量为1320.1 mm,年均相对湿度达82%。公园内的土壤主要为山地黄红壤,土层厚度一般在1 m左右,质地以中壤至重壤为主,全氮和有机质含量较高[10]。
森林公园主峰太白山海拔653.3 m,整个山体呈沙发型,由南向北逐渐升高。常绿阔叶林是太白山的主要植被类型,由于水热条件的差异,分布着以不同常绿阔叶植物为优势种组成的植物群落,形成了典型的低海拔植被垂直带谱。其中低海拔为木荷-栲树群丛(Schimeto-CastanopsietumfargesiiAssociation)的典型亚群丛(Schimeto-CastanopsietumtypicumSubass.)栲树木荷群落类型,中海拔为含杨梅叶蚊母树的亚群丛(Schimeto-CastanopsietumdistylietosumSubass.),以小叶青冈(Cyclobalanopsisgracilis)为优势种,山顶较高海拔区域为长叶石栎-云山青冈群丛(Lithocarpushenryi-CyclobalanopsisnubiumAssociation)中的云山青冈群落。
1.2 调查方法
在森林公园内,沿太白山海拔梯度选择三类典型群落:栲树群落(群落A)、小叶青冈群落(群落B)和云山青冈群落(群落C)。在每个群落内选择地势相当的代表性地段随机设置3个20 m × 20 m的样方,对其中树高大于1 m的所有植株进行群落学和植物构型调查。本研究中共计调查了1087个植株,包含70个物种。各个群落的详细信息见表1。
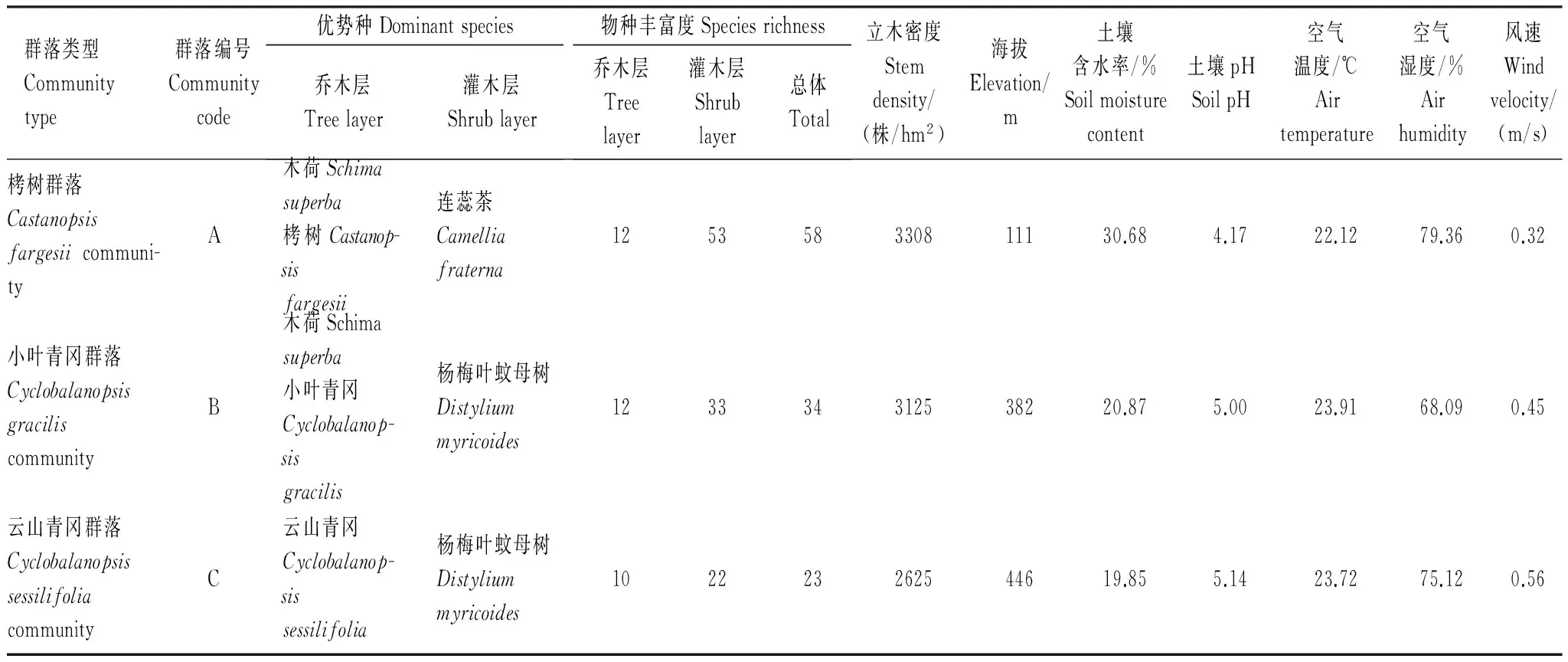
表1 浙江天童太白山海拔梯度上三种典型群落的基本特征Table 1 Plot description of three typical communities differing in altitude in Taibai Mountain, Tiantong region, Zhejiang Province
对于环境因子,在各样地中心安装小气候要素观测仪1台(Em50/R,Decagon Company, America),每群落类型共3台。观测仪主要测量土壤水分、空气温湿度和风速(数据记录时间设定为5 min),由于天童常绿阔叶林中20 cm土层是生物与土壤交互作用最强烈的区域,比如细根主要分布在该土层,因此,土壤因子的测定土壤深度为20 cm[11]。数据采集时间持续5个月(2009年6—10月,即植物生长季)。此外,在每个样方内,从6月到10月为止,每月采用五点法采集0—20 cm土样,后在天童国家野外森林观测站内利用IQ150土壤原位pH计(IQ Scientific Instruments, America)测量土壤pH值。最后将各个环境因子的生长季平均值作为本文构型与环境因子关系的分析数据(表1)。
对于测量植株,首先逐木鉴定种类,记录物种丰富度与各物种的数量。随后对每个植株进行构型性状的测量。由于部分灌木胸径较小或未生长至1 m,无法与乔木在同一类型下比较,另外为排除树木基部膨大对基径的影响,选择了所有个体距地45 cm基径进行测量。如同胸径对乔木而言,45 cm基径对灌木也具有相似的意义,是灌木层物种立木测定的重要因子之一。而当植物在距地45 cm以下存在分支时,最粗枝为其45 cm径。对于植株的树高、枝下高和叶下高,采用Haglof-Ⅵ型测高仪(Haglof, Sweden)测量。而对于叶片聚集度,其记录分2种类型(1表示叶片离散分布,2表示聚集分布)。树冠曝光指数依据Poorter定义[12],记录如下:1 表示树冠不受到直射光线照射,2为树冠受到侧面光线照射,3为10%—90%树冠受到光线照射,4为大于90%的树冠受到光线照射,5表示树冠全受到光线照射。
由于叶片聚集度和树冠曝光指数是定性数据,为减小测量误差,每个观测项分2组人单独记录,后用平均数表示实际观测值。树冠面积依据公式(1)计算。树冠厚度的计算参照Masahiro Aiba的研究方法[13],依据公式(2)计算。
CA=L1×L2
(1)
CD=H-HF
(2)
式中,CA为树冠面积,L1为植株树冠在东西向垂直投影的长度,L2为植株树冠在南北向垂直投影的长度;CD为树冠厚度,H为树高,HF为叶下高。
1.3 数据处理
依据达良俊和杨同辉对天童常绿阔叶林群落乔灌木层的区分标准[14],太白山海拔梯度上3个典型群落依高度划分成2层:灌木层(1.5 m
对于每个群落类型的3个随机设置样方,依植物高度,将3个样方内同高度的所有个体合并,后用所有个体的平均值代表乔木和灌木层的构型性状,以判断其在不同群落间的变化趋势。随后,基于不同的群落类型,对不同群落内的全部植株的构型性状值用单因素方差分析(One-Way ANOVA)检验了乔木和灌木层的构型性状在海拔上差异的显著性。同时,为理解几何构型间的关系及构型在不同群落内发生变异的驱动因素,本文采用了Spearman相关系数和多元逐步回归的方法。其中Spearman相关系数是对不同群落内全部个体构型性状进行分析;而在多元逐步回归中,鉴于乔木层和灌木层处于同一群落内部,环境因子较难区分,因此对每个样方分别进行了环境因子的采集,之后将该环境因子的均值赋值于样方内的所有调查个体,基于个体统计构型在群落间的变化。所有数据均在SPSS 19.0完成。
2 结果
2.1 植物构型的变化
在3个调查群落间,依栲树至小叶青冈到云山青冈的序列 (从低海拔到高海拔群落),灌木层高度、树冠厚度、枝下高和距地45 cm均持续增加 (图1)。具体表现为,栲树、小叶青冈群落的树高、枝下高和距地45 cm基径与云山青冈群落间差异显著(P<0.05),树冠厚度在3个群落间均差异显著(P<0.05)。而灌木的树冠面积并没有持续增加,其在小叶青冈群落最大,与另外两个群落差异显著(P<0.05)。对于叶片聚集度,在栲树至小叶青冈到云山青冈的3个群落间呈现出不显著的下降趋势(P= 0.129)。
对于乔木层,构型性状的变化与灌木层差异较大(图1)。从栲树至小叶青冈到云山青冈群落,树高、枝下高和距地45 cm基径均持续降低,具体表现为,树高和距地45 cm基径在栲树、小叶青冈群落中与云山青冈群落间差异显著(P<0.05),枝下高在3个群落间均差异显著(P<0.05)。而与灌木层类似,乔木层的树冠面积的最大值也存在于小叶青冈群落。对于树冠厚度,不同于灌木层,乔木层并没有呈现出增加的趋势,其在小叶青冈群落最小。另外,从栲树至小叶青冈到云山青冈群落,乔木层的叶片聚集度显著增加(P<0.05)。
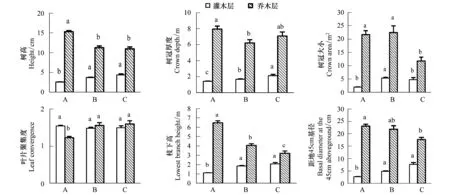
图1 浙江天童太白山三种群落植物构型的比较Fig.1 Comparison of plant architecture among three communities in Taibai Mountain, Tiantong, Zhejiang ProvinceA: 栲树群落 Castanopsis fargesii community; B: 小叶青冈群落 Cyclobalanopsis gracilis community; C:云山青冈群落 Cyclobalanopsis sessilifolia community; 同一高度层次不同柱图中的不同字母表示不同群落间存在显著差异(P < 0.05);误差棒为标准误
2.2 植物构型性状关系随海拔的变化
3个群落灌木层植物的树高、树冠厚度、树冠面积和距地45 cm基径之间显著相关(P<0.01),且相关系数随着3个群落的分布海拔梯度呈增加趋势(表2)。枝下高与其它植物构型性状(叶片聚集度除外)之间也显著相关(P<0.01),从栲树至小叶青冈到云山青冈群落,相关系数先增大后减小。不同群落灌木层的叶片聚集度与树冠厚度显著相关(P< 0.01),但与其它植物构型性状间没有一致性的相关性(表2)。
表2 浙江天童太白山3种群落灌木层构型性状的相关性
Table 2 Correlations among architectural traits in shrub layer across three communities in Taibai Mountain, Tiantong region, Zhejiang Province
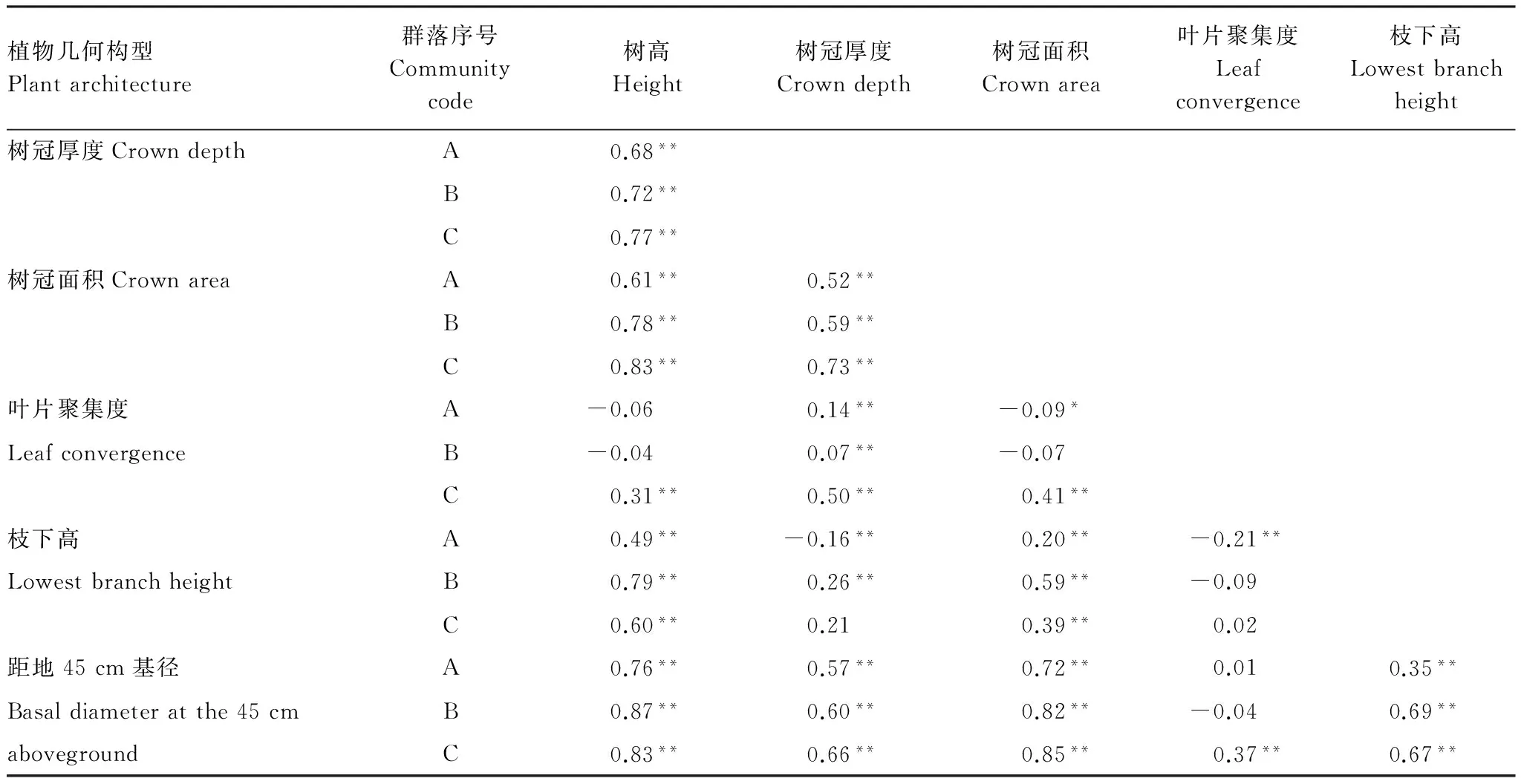
植物几何构型Plantarchitecture群落序号Communitycode树高Height树冠厚度Crowndepth树冠面积Crownarea叶片聚集度Leafconvergence枝下高Lowestbranchheight树冠厚度CrowndepthA0.68**B0.72**C0.77**树冠面积CrownareaA0.61**0.52**B0.78**0.59**C0.83**0.73**叶片聚集度A-0.060.14**-0.09*LeafconvergenceB-0.040.07**-0.07C0.31**0.50**0.41**枝下高A0.49**-0.16**0.20**-0.21**LowestbranchheightB0.79**0.26**0.59**-0.09C0.60**0.210.39**0.02距地45cm基径A0.76**0.57**0.72**0.010.35**Basaldiameteratthe45cmB0.87**0.60**0.82**-0.040.69**abovegroundC0.83**0.66**0.85**0.37**0.67**
**P< 0.01, *P<0.05
不同于灌木层,乔木层并没有在不同群落间呈现出构型性状关系增加或减小的变化趋势(表3)。树高和树冠厚度在3个群落均显著相关(P<0.01),树高、树冠厚度、树冠面积和距地45 cm基径只在栲树和小叶青冈群落显著相关(P<0.01),且相关系数在小叶青冈群落内高于栲树群落。
表3 浙江天童太白山3种群落乔木层构型性状的相关性
Table 3 Correlations among architectural traits in tree layer among three communities in Taibai Mountain, Tiantong region, Zhejiang Province
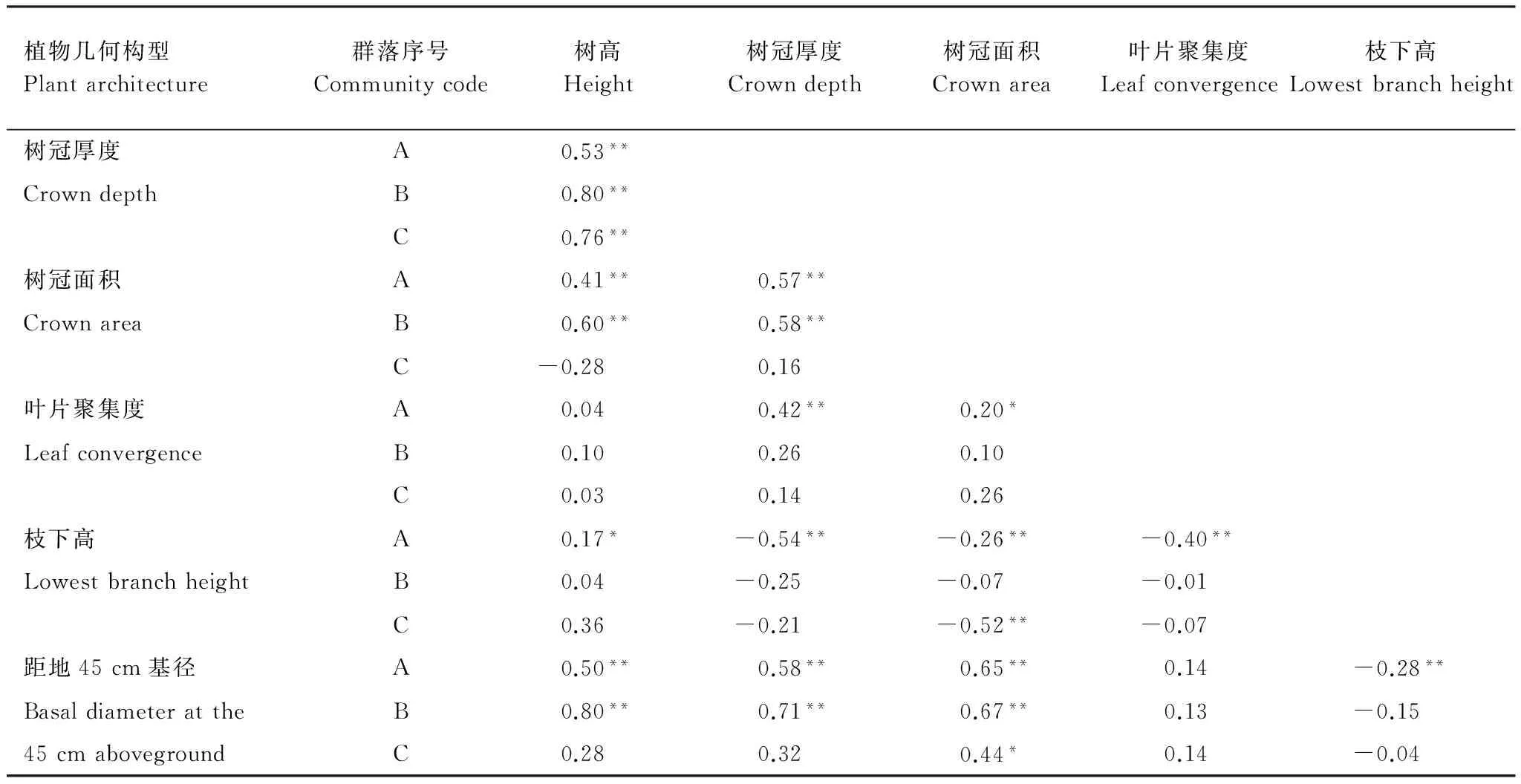
植物几何构型Plantarchitecture群落序号Communitycode树高Height树冠厚度Crowndepth树冠面积Crownarea叶片聚集度Leafconvergence枝下高Lowestbranchheight树冠厚度A0.53**CrowndepthB0.80**C0.76**树冠面积A0.41**0.57**CrownareaB0.60**0.58**C-0.280.16叶片聚集度A0.040.42**0.20*LeafconvergenceB0.100.260.10C0.030.140.26枝下高A0.17*-0.54**-0.26**-0.40**LowestbranchheightB0.04-0.25-0.07-0.01C0.36-0.21-0.52**-0.07距地45cm基径A0.50**0.58**0.65**0.14-0.28**BasaldiameterattheB0.80**0.71**0.67**0.13-0.1545cmabovegroundC0.280.320.44*0.14-0.04
**P< 0.01, *P< 0.05
2.3 植物树冠曝光指数随海拔的变化
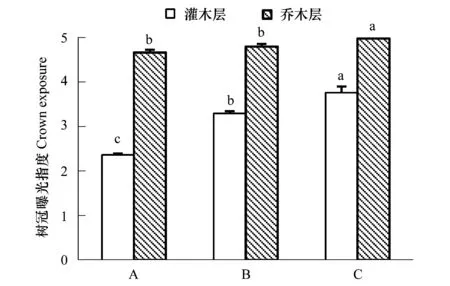
图2 浙江天童太白山3种群落乔灌木植物树冠曝光指数的比较Fig.2 Comparison of crown exposure index among three communities in Taibai Mountain, Tiantong region, Zhejiang Province A: 栲树群落 Castanopsis fargesii community; B: 小叶青冈群落 Cyclobalanopsis gracilis community; C:云山青冈群落 Cyclobalanopsis sessilifolia community; 同一高度层次不同柱图中的不同字母表示不同群落间存在显著差异(P < 0.05);误差棒为标准误
从栲树至小叶青冈到云山青冈群落,灌木和乔木层植物的树冠曝光指数增加(图2)。灌木在3个群落间差异显著(P<0.05),而乔木层在栲树和小叶青冈群落间不存在显著差异(P= 0.401),但与云山青冈群落间存在显著差异(P<0.05)。
2.4 植物构型与环境因子相关性
将各群落内的所有个体合并,对各构型性状和树冠曝光指数及其他6个环境因子进行多元逐步回归,结果表明,对于灌木层植物,除枝下高外,树冠曝光指数的标准回归系数均高于其它环境因子(表4),即树冠曝光指数对植物构型随海拔变异的解释贡献度最大。而乔木层的回归结果相反,树冠曝光指数对不同群落内植物构型变异的解释贡献度均小于其它环境因子,不是影响乔木层构型改变的最重要因子。而其余环境因子也对构型变化未有一致趋势。如土壤含水率是影响树高和叶片聚集度的最重要的环境因子,风速是影响树冠面积和距地45 cm基径的最重要环境因子,而空气湿度和土壤pH值分别是影响树冠厚度和枝下高的最重要因子(表4)。
表4 浙江天童太白山三种群落乔灌木层植物构型性状与环境因子的逐步回归
Table 4 Stepwise regression of plant architectural traits against environment factors in each of shrub and tree layers among three communities in Taibai Mountain, Tiantong region, Zhejiang Province
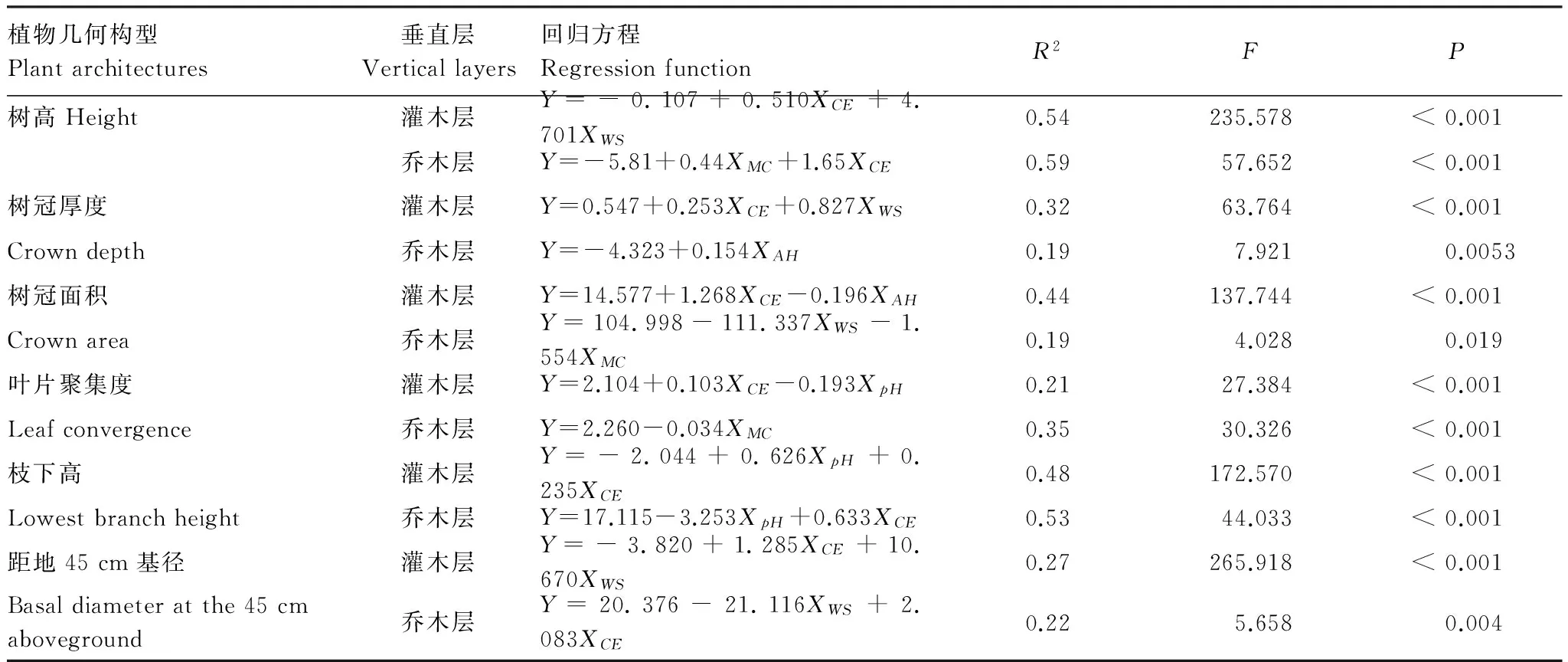
植物几何构型Plantarchitectures垂直层Verticallayers回归方程RegressionfunctionR2FP树高Height灌木层Y=-0.107+0.510XCE+4.701XWS0.54235.578<0.001乔木层Y=-5.81+0.44XMC+1.65XCE0.5957.652<0.001树冠厚度灌木层Y=0.547+0.253XCE+0.827XWS0.3263.764<0.001Crowndepth乔木层Y=-4.323+0.154XAH0.197.9210.0053树冠面积灌木层Y=14.577+1.268XCE-0.196XAH0.44137.744<0.001Crownarea乔木层Y=104.998-111.337XWS-1.554XMC0.194.0280.019叶片聚集度灌木层Y=2.104+0.103XCE-0.193XpH0.2127.384<0.001Leafconvergence乔木层Y=2.260-0.034XMC0.3530.326<0.001枝下高灌木层Y=-2.044+0.626XpH+0.235XCE0.48172.570<0.001Lowestbranchheight乔木层Y=17.115-3.253XpH+0.633XCE0.5344.033<0.001距地45cm基径灌木层Y=-3.820+1.285XCE+10.670XWS0.27265.918<0.001Basaldiameteratthe45cmaboveground乔木层Y=20.376-21.116XWS+2.083XCE0.225.6580.004
XCE: 冠层曝光指数crown exposure index;XWS: 风速wind velocity;XMC: 土壤含水率soil moisture content;XAH: 空气湿度air humidity;XpH: 土壤pH
3 讨论
3.1 植物构型在不同群落的变异
构型是植物外貌对环境适应的具体表现,它随环境胁迫压力的改变出现调整,以获取最大的资源量[15]。如植物会改变树冠面积、干材密度等来适应群落内光、水资源的变化[16]。本研究中,从栲树至小叶青冈到云山青冈群落,灌木层的树高、距地45 cm处基径、树冠厚度和枝下高上升,叶片聚集度下降。这是因为,具有较高树高和枝下高的植物有利于占据光资源丰富区域,增加光资源的获取量[17]。另外,更大的面积和较低的叶片聚集度意味着植株的叶片占据了更充分的空间位置,也有利于截获光资源[12]。
此外,浙江天童地区位于亚热带季风气候区,存在季节性台风干扰,植物为增加抗风胁迫能力,常诱导植物增粗茎干以提供较强机械支撑能力[18]。距地45 cm基径反映了植物树干的粗细程度,也在一定程度上反映了植物的机械支撑能力。因此,随着风速的增加,植物机械支撑能力将呈现上升趋势。这也在本研究得到证明,即:从栲树至小叶青冈到云山青冈群落,海拔上升,风速增加,灌木层距地45 cm基径增加。同时,季节性的台风干扰又能不规则地损伤植物的外貌结构,在机械支持和光资源获取的构型间存在权衡,致使云山青冈群落灌木层植物的树冠面积略有下降,以减小风害的损伤。
对乔木层,在3个典型群落间,树高、枝下高和距地45 cm基径均在栲树群落中最高,小叶青冈居中,而云山青冈群落其值最小,表现出与灌木层相反的构型变异趋势。这是因为云山青冈群落分布的海拔范围较高,其土壤含水量最小(表1),水分可利用性限制了树高的增加,这也在Feldpausch等人的研究结果有所证明[19]。另外,天童地区台风活动频繁,风对乔木层的影响在栲树群落中最小,而由于海拔的增加,风对云山青冈群落的干扰最大。此时,为减少风胁迫造成的损伤,植株通常采取较矮树高[20]和小面积树冠的构型策略。且台风的不规则干扰能使林冠的枝叶生长更聚集,叶片聚集度增大。de Gouvenain等人对澳洲热带森林的研究也认为风的干扰致使其相对树高较低[21]。
3.2 植物构型性状关系在群落间的差异
植物构型是植物适应环境的结果,反映了植物适应环境的信息[22- 24]。根据最优化分配理论,植物应该增大获取限制资源器官的投入分配,因此,构型间对于环境胁迫,存在营养投资的权衡[25],各构型性状间具有一定相关性。如阳性物种会投入更多资源于垂直生长以快速占据林冠层[26],造成冠幅与高度间相关性较强。而在进入林冠层之后,乔木同时投资于横向扩展冠幅、树干加粗以获取光资源并维持机械支撑,此时冠幅与胸径相关性减弱。
本研究中,从栲树到小叶青冈到云山青冈群落,构型性状间相关性在灌木层逐渐增大,这是因为群落分布于不同的海拔高度所致。光资源竞争随海拔高度的上升引起植物对获取光资源构型的偏利投资[25],使得各构型性状相关性增强。在亚热带常绿阔叶林的下木层,随海拔上升,乔木层平均高度在海拔梯度上降低,对灌木层的遮阴作用减弱,使高海拔灌木的生长限制得以释放,因而构型性状间的相关性增强。且对于灌木层,台风干扰的影响并不如乔木层显著。而光作为群落灌木层构型改变的主要限定因子[8],由于光资源可供给性增大,各类构型性状都可在光资源获取中受益,呈现出与随海拔升高对应的变化趋势。因此,导致不同群落构型间的相关性随海拔持续增大。
对乔木层,构型性状间相关性在3个群落间没有明显变化趋势,说明在3个群落内对乔木构型变异限定的环境因子具有不确定性。因为,从山腰的栲树群落到山脊及山顶的小叶青冈和云山青冈群落,虽然常绿阔叶林群落的冠层平均曝光指数增加(图2),但光已不是群落构型改变的主要限制因子。除光资源影响外,台风干扰能极大程度地影响植物的构型改变[21],因为植物为减少风胁迫造成的损伤,不同于灌木层光资源获取的限制,乔木层植物向机械支持投资偏移。另外,在前人的研究中,植物的木质部的水分运输能力也能极大程度地影响植物构型的改变[27]。云山青冈群落内,其位处山顶,土壤中可供植物吸收的水分减少,引起植物构型变化[19]。因此,随群落所在海拔位置增加,均衡化的因子限制要求乔木植物采取多头下注的投资策略,构型投资方向由群落内某一时间或空间上最小的限定因子决定,在构型间不存在明显趋势。这一结果也在本文第3部分逐步回归的结果予以了验证。
总体来看,对亚热带常绿阔叶林乔灌木层植物构型与环境因子逐步回归后发现,树冠曝光指数对灌木层植物构型在不同群落间变异的解释贡献度最大,而对乔木层植物构型变异的解释贡献度较小。说明对亚热带常绿阔叶林,和热带雨林类似,光资源的利用率是引起灌木层植物构型随海拔变化的主要因子,而对乔木层,植物构型与其它环境因子,尤其是水分的联系更为紧密。
[1] King D A, Davies S J, Noor N S M. Growth and mortality are related to adult tree size in a Malaysian mixed dipterocarp forest. Forest Ecology and Management, 2006, 223(1/3): 152- 158.
[2] Fisher J B. Branching pattern and angles in trees // Givnish J T, ed. On the Economy of Plant form and Function. London: Cambridge University Press, 1986: 493- 518.
[3] Poorter L, Bongers F, Sterck F J, Wöll H. Architecture of 53 rain forest tree species differing in adult stature and shade tolerance. Ecology, 2003, 84(3): 602- 608.
[4] 孙书存, 陈灵芝. 辽东栎植冠的构型分析. 植物生态学报, 1999, 23(5): 433- 440.
[5] 潘红丽, 李迈和, 蔡小虎, 吴杰, 杜忠, 刘兴良. 海拔梯度上的植物生长与生理生态特性. 生态环境学报, 2009, 18(2): 722- 730.
[6] Sterck F J, Bonger F, Newbery D M. Tree architecture in a Bornean lowland rain forest: intraspecific and interspecific patterns. Plant Ecology, 2001, 153(1/2): 279- 292.
[7] Thomas S C. Asymptotic height as a predictor of growth and allometric characteristics in Malaysian rain forest trees. American Journal of Botany, 1996, 83(5): 556- 566.
[8] Poorter L, Wright S J, Paz H, Ackerly D D, Condit R, Ibarra-Manríquez G, Harms K E, Licona J C, Martínez-Ramos M, Mazer S J, Muller-Landau H C, Pena-Claros M, Webb C O, Wright I J. Are functional traits good predictors of demographic rates? Evidence from five neotropical forests. Ecology, 2008, 89(7): 1908- 1920.
[9] Nishimura M, Setoguchi H. Homogeneous genetic structure and variation in tree architecture ofLarixkaempferialong altitudinal gradients on Mt. Fuji. Journal of Plant Research, 2011, 124(2): 253- 263.
[10] 宋永昌, 王祥荣. 浙江天童国家森林公园的植被和区系. 上海: 上海科学技术文献出版社, 1995: 1- 16.
[11] 曾凡荣, 施家月, 阎恩荣, 张仁良, 王希华. 天童常绿阔叶林次生演替过程中细根的生物量动态. 华东师范大学学报: 自然科学版, 2008, (6): 56- 62.
[12] Poorter L, Bongers L, Bongers F. Architecture of 54 moist-forest tree species: traits, trade-offs, and functional groups. Ecology, 2006, 87(5): 1289- 1301.
[13] Aiba M, Nakashizuka T. Architectural differences associated with adult stature and wood density in 30 temperate tree species. Functional Ecology, 2009, 23(2): 265- 273.
[14] 杨同辉, 达良俊, 宋永昌, 杨永川, 王良衍. 浙江天童国家森林公园常绿阔叶林生物量研究(Ⅰ)群落结构及主要组成树种生物量特征. 浙江林学院学报, 2005, 22(4): 363- 369.
[15] 李钰, 赵成章, 侯兆疆, 马小丽, 张茜. 高寒退化草地狼毒种群个体大小与茎、叶的异速生长. 生态学杂志, 2013, 32(2): 241- 246.
[16] Wright S J, Kitajima K, Kraft N J B, Reich P B, Wright I J, Bunker D E, Condit R, Dalling J W, Davies S J, Díaz S, Engelbrecht B M J, Harms K E, Hubbell S P, Marks C O, Ruiz-Jaen M C, Salvador C M, Zanne A E. Functional traits and the growth-mortality tradeoff in tropical trees. Ecology, 2010, 91(12): 3664- 3674.
[17] Poorter L, Lianes E, Moreno-de las Heras M, Zavala M A. Architecture of Iberian canopy tree species in relation to wood density, shade tolerance and climate. Plant Ecology, 2012, 213(5): 707- 722.
[18] Kooyman R M, Westoby M. Costs of height gain in rainforest saplings: main-stem scaling, functional traits and strategy variation across 75 species. Annals of Botany, 2009, 104(5): 987- 993.
[19] Feldpausch T R, Banin L, Phillips O L, Baker T R, Lewis S L, Quesada C A, Affum-Baffoe K, Arets E J M M, Berry N J, Bird M, Brondizio E S, de Camargo P, Chave J, Djagbletey G, Domingues T F, Drescher M, Fearnside P M, França M B, Fyllas N M, Lopez-Gonzalez G, Hladik A, Higuchi N, Hunter M O, Iida Y, Salim K A, Kassim A R, Keller M, Kemp J, King D A, Lovett J C, Marimon B S, Marimon-Junior B H, Lenza E, Marshall A R, Metcalfe D J, Mitchard E T A, Moran E F, Nelson B W, Nilus R, Nogueira E M, Palace M, Patio S, Peh K S H, Raventos M T, Reitsma J M, Saiz G, Schrodt F, Sonké B, Taedoumg H E, Tan S, White L, Wöll H, Lloyd J.. Height-diameter allometry of tropical forest trees. Biogeosciences, 2011, 8(5): 1081- 1106.
[20] Henry H A L, Aarssen L W. The interpretation of stem diameter-height allometry in trees: biomechanical constraints, neighbour effects, or biased regressions?. Ecology Letters, 1999, 2(2): 89- 97.
[21] de Gouvenain R C, Silander J A Jr. Do tropical storm regimes influence the structure of tropical lowland rain forests? Biotropica, 2003, 35(2): 166- 180.
[22] 孙书存, 陈灵芝. 不同生境中辽东栎的构型差异. 生态学报, 1999, 19(3): 359- 364.
[23] 王丽娟, 孙栋元, 赵成义, 李菊艳, 盛钰. 准噶尔盆地梭梭、白梭梭植物构型特征. 生态学报, 2011, 31(17): 4952- 4960.
[24] 何明珠, 张景光, 王辉. 荒漠植物枝系构型影响因素分析. 中国沙漠, 2006, 26(4): 625- 630.
[25] Bloom R G, Mallik A U. Indirect effects of black spruce (Piceamariana) cover on community structure and function in sheep laurel (Kalmiaangustifolia) dominated health of eastern Canada. Plant and Soil, 2004, 265(1/2): 279- 293.
[26] King D A. Allometry of saplings and understorey trees of a Panamanian forest. Functional Ecology, 1990, 4(1): 27- 32.
[27] Ryan M G, Phillips N, Bond B J. The hydraulic limitation hypothesis revisited. Plant Cell and Environment, 2006, 29(3): 367- 381.
Comparison of plant architecture among communities in taibai mountain of tiantong region, Zhejiang Province
ZHANG Zhihao1,2, YANG Xiaodong1,2, SUN Baowei1,2, HUANG Haixia1,2, MA Wenji1,2, SHI Qingru1,2, YAN Enrong1,2,*
1CollegeofEcologicalandEnvironmentalSciences,EastChinaNormalUniversity,Shanghai200241,China2TiantongNationalForestEcosystemObservationandResearchStation,Ningbo315114,China
Plant architecture, reflecting ecologically adaptive strategy of plants in response to changing environment, refers to the overall shape and size of the wood plants and the spatial arrangement of its components such as crowns, stems, branches and leaves. For mechanical and hydraulic reasons, architecture of a plant can greatly affect whole-plant function such as photosynthesis, transpiration and energy balance. As one of the leading dimensions in shaping plant function, plant architecture is also fundamental to influence species demographics, and consequently species coexistence. Therefore, variation in plant architecture among communities that differ in site properties is considered to indicate relationship between plant architecture and environmental stress. Linking spatial pattern of plant architecture with changes in altitude is important for understanding plant adaptive strategies in relation to biomass allocation. However, little is currently understood whether plant architectural traits correlate to the site properties with changing altitude in the evergreen broad-leaved forests. In this study, our objectives were to elucidate variation in plant architectural traits among communities, and to explain the mechanical relationships between plant architectural traits and environmental conditions. Specifically, three community types, i.e.,Castanopsisfargesiicommunity,Cyclobalanopsisgraciliscommunity andCyclobalanopsissessilifoliacommunity, differing in altitude, were selected in Taibai Mountain in Tiantong region, Zhejiang Province, to examine plant architectural traits including tree height, crown depth and area, leaf convergence, the lowest branch height (LBH) and basal diameter at the 45 cm aboveground (D45). In addition, crown exposure index, soil moisture content, air humidity, air temperature, soil pH, and windy velocity in each of three communities were determined. Then variation in architectural traits for plants in each of tree and shrub layers among communities, and their relationships with environmental factors were analysized. The results shown that, for plants in shrub layer, plant height, crown depth, the lowest branch height and basal diameter at the 45 cm aboveground increased, but proportion of leaf convergence decreased gradually fromCastanopsisfargesiitoCyclobalanopsissessilifoliacommunity with increasing altitude. However, for plants in tree layer, tree height, crown depth, crown area, LBH andD45decreased, while leaf convergence increased. Significant correlations among architectural traits (P<0.01) was found in three altitudinal communities for plants in shrub layer, but for plants in tree layer, architectural traits correlated significantly in the lowest and intermediate altitudinal communities only. Crown exposure index in both shrub and tree layers increased significantly fromCastanopsisfargesiitoCyclobalanopsissessilifoliacommunity with increasing elevation (P< 0.05). Multiple stepwise regression demonstrated that, for plants in the shrub layer, crown exposure index was mainly responsible for variation in plant architecture, whereas, soil moisture content, wind velocity, and soil pH were the determinant factors influencing plant architecture for plants in the tree layer. In conclusion, plant architectural traits vary differently with community change for plants in each of shrub and tree layers in Taibai Mountain in Tiantong region. Variability of plant architecture in shrub layer results largely from light competition, while plant architecture in tree layer was driven by wind velocity and soil moisture content.
plant architecture; altitude; crown exposure index; wind velocity; soil moisture content; evergreen broad-leaved forest
国家自然科学基金(31270475, 31070383)
2013- 04- 14;
日期:2014- 04- 03
10.5846/stxb201304140705
*通讯作者Corresponding author.E-mail: eryan@des.ecnu.edu.cn
张志浩,杨晓东,孙宝伟,黄海侠,马文济,史青茹,阎恩荣.浙江天童太白山不同群落植物构型比较.生态学报,2015,35(3):761- 769.
Zhang Z H, Yang X D, Sun B W, Huang H X, Ma W J, Shi Q R, Yan E R.Comparison of plant architecture among communities in taibai mountain of tiantong region, Zhejiang Province.Acta Ecologica Sinica,2015,35(3):761- 769.
