落叶松八齿小蠹与长喙壳真菌间的种特异性伴生关系
2015-03-10孟贤静刘学伟焦相杰张星耀
孟贤静,吕 全,*,刘学伟,焦相杰,梁 军,张星耀
1 国家林业局森林保护学重点实验室,中国林业科学研究院森林生态环境与保护研究所,北京 100091 2 内蒙古赤峰市克什克腾旗广兴林场,赤峰 025350
落叶松八齿小蠹与长喙壳真菌间的种特异性伴生关系
孟贤静1,吕 全1,*,刘学伟1,焦相杰2,梁 军1,张星耀1
1 国家林业局森林保护学重点实验室,中国林业科学研究院森林生态环境与保护研究所,北京 100091 2 内蒙古赤峰市克什克腾旗广兴林场,赤峰 025350
小蠹虫与长喙壳类真菌(Ophiostomatoid fungi)在自然界中形成稳定的伴生关系,是森林生态系统内一种普遍的生态学现象。已有研究表明欧亚大陆的齿小蠹属(Ips)昆虫与多种长喙壳类真菌形成广泛的伴生关系,其中部分真菌是重要的针叶树病原菌。随着借助于DNA信息特征的系统发育分析,揭示出形态特征和亲缘关系十分接近的3种齿小蠹属昆虫,云杉八齿小蠹(I.typographus),欧洲落叶松八齿小蠹(I.cembrae)和亚洲落叶松八齿小蠹(I.subelongatus)确定为不同种之后,相应地与之稳定伴生的长喙壳类真菌Ceratocystispolonica也由过去一个种揭示为3个种的复合体,各自与3种小蠹虫稳定伴生,形成密切的种特异性伴生关系。小蠹虫与真菌的种特异性伴生被认为是处于同一森林生态系统内的生物协同进化的结果。通过对我国东北地区落叶松八齿小蠹虫体、坑道标本上伴生真菌菌株的采集、分离和生理学、形态学特征观察,以及基于ITS、β-tubulin、MAT- 2 HMG box多位点DNA序列的系统发育分析,首次确定了长喙壳真菌Ceratocystisfujiensis在我国东北地区异域分布的3种落叶松林内普遍存在,与落叶松八齿小蠹形成稳定的伴生关系。作为亚洲落叶松八齿小蠹伴生的主要真菌,也是伴生菌区系中的先锋种和致病力最强的病原菌,C.fujiensis在我国落叶松人工林的广泛分布值得高度重视,将为制定防治病虫复合危害的有效策略和措施提供科学基础。研究结果进一步支持了齿小蠹属昆虫与长喙壳真菌间的种特异性伴生假说。同时,多基因序列特征表明落叶松八齿小蠹与C.fujiensis在亚洲范围内的不同地理种群存在着显著的遗传多样性,预示特异性伴生在不同种群间发生的可能,可以为种特异性伴生假说和小蠹虫-真菌间共生关系的研究提供良好的模式材料。
亚洲落叶松八齿小蠹;Ceratocystisfujiensis; 系统发育; 落叶松; 病原菌
落叶松属植物(Larixspp.)作为落叶松八齿小蠹(Ipssubeolongatus)的主要寄主,是速生丰产用材林基地建设的首选树种,在我国广泛分布。然而,落叶松纯林的大量营造为落叶松的广泛分布和大量纯林为落叶松八齿小蠹的发生和传播蔓延提供了条件。目前发现,落叶松八齿小蠹在我国的地理分布范围极广[1],主要危害东北和华北异域分布的兴安落叶松(L.gmelini)、长白落叶松(L.olgensis)和华北落叶松(L.prineipis-rupprechtii)[2]。
落叶松八齿小蠹作为次期性害虫的先锋种,主要侵害伐倒木、濒死木,发生盛期也可危害健康或衰弱的的活立木,给我国的落叶松人工林造成巨大的损失和威胁[3,4],被列入“全国林业危险性有害生物名单”(国家林业局2013年第4号公告)[5],同时也是欧洲和地中海植物保护组织(EPPO)预警名单A2(http://www.eppo.org/QUARANTINE/listA2.htm)里的种类。
小蠹虫和真菌之间的伴生是森林生态系统内一种普遍的生态学现象,是生物长期协同进化的结果。伴生真菌,尤其是长喙壳类真菌(ophiostomatoid fungi)在与昆虫形成广义上的共生关系体内,起到影响昆虫种群建立、协同克服寄主抗性、引起树木病害和造成木质部变色的作用[6- 7],带来直接和间接的经济损失。长喙壳类真菌主要包括微囊目(Microascales)的长喙壳属(Ceratocystis)、穴喙壳属(Sphaeronaemella)、Gondwanamyces属和Cornuvesica属,以及蛇口壳目(Ophiostomatales)的蛇口壳属(Ophiostoma)、Grosmannia属和拟长喙壳属(Ceratocystiopsis),以及对应于这些有性型的多种无性属[8]。
自Hartig首次发现真菌与小蠹虫的伴生现象以来[9],二者之间的协同进化关系得到了越来越多的研究材料和个例的证实。小蠹虫和真菌各自形成了特定的形态构造以利于保持双方共生体的延续,其中小蠹虫体表形成的贮菌器(mycangium)是这种进化最有力的证据[6]。
齿小蠹属目前包括约36个种,全部分布于北半球的针叶林内。其中13个种分布于欧亚大陆[10]。形态和亲缘关系十分相似的3种齿小蠹,云杉八齿小蠹(Ipstypographus)、欧洲落叶松八齿小蠹(I.cembrae)和亚洲落叶松八齿小蠹(I.subelongatus)作为欧亚大陆针叶林内的种类,引起了大范围的危害。云杉八齿小蠹在欧洲被列为危害最为严重的十大蠹虫之首[11],目前发现与云杉八齿小蠹及其日本变种(I.typographusf.japonicus)相伴生的长喙壳真菌约有30种,其中形成稳定伴生关系的主要是Ceratocystispolonica(Siem.) C. Moreau,是伴生菌区系中的先锋种,往往在真菌侵染寄主的最前端分离率最高。Ceratocystispolonica是一种强致病性病原菌[12],其致病性增强了害虫的危害性[6,13]。
在欧洲目前发现11种长喙壳真菌与欧洲落叶松八齿小蠹伴生[6,14- 18],其中与强致病性病原菌C.laricicola形成稳定的伴生关系。日本也较早开展了落叶松八齿小蠹伴生菌的研究[19],到目前报道与12个长喙壳真菌的种类伴生[20- 22]。尽管最初认为这两种小蠹虫属同种,而且都可与病原菌C.laricicola稳定伴生,但随后借助DNA序列为工具的系统发育学研究揭示了害虫和伴生菌分属两个不同种,在日本与亚洲落叶松八齿小蠹伴生的主要真菌为Ceratocystisfujiensis[23],而不是C.laricicola。
上述3种八齿小蠹形态极为相似,与此类似的是,3种小蠹虫各自稳定的伴生菌C.polonica、C.laricicola和C.fujiensis之间形态上也几乎无法区别,但基于多基因序列分析的系统发育分析清晰的表明它们属于不同种,而且它们也可以通过寄主、媒介昆虫和地理区域的分化特征进行区分[23]。即小蠹虫与伴生真菌在长期协同进化过程中,特定种的小蠹虫只与特定种的真菌形成稳定的“种特异性伴生”关系假说(species-specific association of fungi with bark beetles)[24- 26]。
我国近几年也对落叶松八齿小蠹伴生菌有一些零星的研究和报道[27- 29],但缺乏系统性。本研究通过对3种异域分布的落叶松林内的齿小蠹伴生菌进行系统调查和分析,期望验证种的特异性伴生假说,以明确稳定伴生的长喙壳病原菌在我国森林生态系统中的分布范围,为森林病虫害的有效治理提供科学依据。
1 材料与方法
1.1 标本采集
于2011—2012年,分别在内蒙古阿荣旗,根河,五岔沟,赤峰;黑龙江省古城,伊春;吉林长白,辽宁抚顺等地区选择兴安落叶松、长白落叶松和华北落叶松进行标本采集。标本包括落叶松八齿小蠹虫体标本与坑道标本。
1.2 真菌分离纯化
采用组织分离法进行伴生真菌分离。将坑道标本切成3 mm×3 mm大小的组织块,用1.5%的次氯酸钠溶液(每100 mL含1滴吐温20)进行表面消毒处理1 min,再用无菌水冲洗3次。无菌滤纸吸干组织块上的水分后接于2%的无菌水琼脂培养基上进行真菌分离培养。利用1.5%的次氯酸钠溶液对落叶松八齿小蠹进行体表消毒30 s,用无菌的镊子将虫体置于2%水琼脂培养基上进行虫体表面真菌分离。
采用菌丝先端纯化法对组织分离培养的真菌进行纯化,纯化后得到的真菌接于2%MEA培养基,置于25 ℃恒温培养箱中,黑暗条件下培养。
1.3 菌株形态学
将分离纯化得到的菌株在2%MEA培养基上培养20 d,每天记录菌丝形态,生长情况,待其长出子实体释放出孢子后,在显微镜下观察菌株的子囊壳、子囊、子囊孢子、分生孢子梗、分生孢子的形态特征,并进行描述、测量和拍摄。每一形态特征测量50组数据进行分析处理。
1.4 菌株生长速率测定
用直径为5 mm的无菌打孔器从在2%MEA培养基上旺盛生长的实验菌株边缘切下菌饼,置于相同培养基成分的培养皿中央。菌饼生长菌丝的一面与培养基直接接触,每个菌株做3个重复,25 ℃黑暗条件下恒温培养,每天观察菌落生长情况,采用十字交叉法测量菌落直径。
1.5 DNA提取
对纯化所得菌株采用2%液体PDA培养基置于25 ℃摇床下黑暗培养7 d,挑取适量菌丝于滤纸上,用无菌水冲洗菌丝至滤液澄清,菌丝烘干,备用。DNA提取采用CTAB法用植物基因组DNA提取试剂盒进行提取。
1.6 PCR扩增
试验采用25 μL的PCR反应体系:模板1 μL,浓度1 μmol/L的引物各1 μL,2×Taq PCR MasterMix(0.1 U Taq Polymerase/μL, 500 μmol/L dNTP each, 20 mmol/L Tris-HCL(pH8.3), 100 mmol/L KCl, 3 mmol/L MgCl2)12.5 μL, 9.5 μL ddH2O。不同DNA基因片段的扩增条件及所需引物如表1所示[27]。PCR产物采用2.2%琼脂糖凝胶电泳检测,条带单一、清晰的送往北京宝锐通生物科技有限公司进行双向测序。
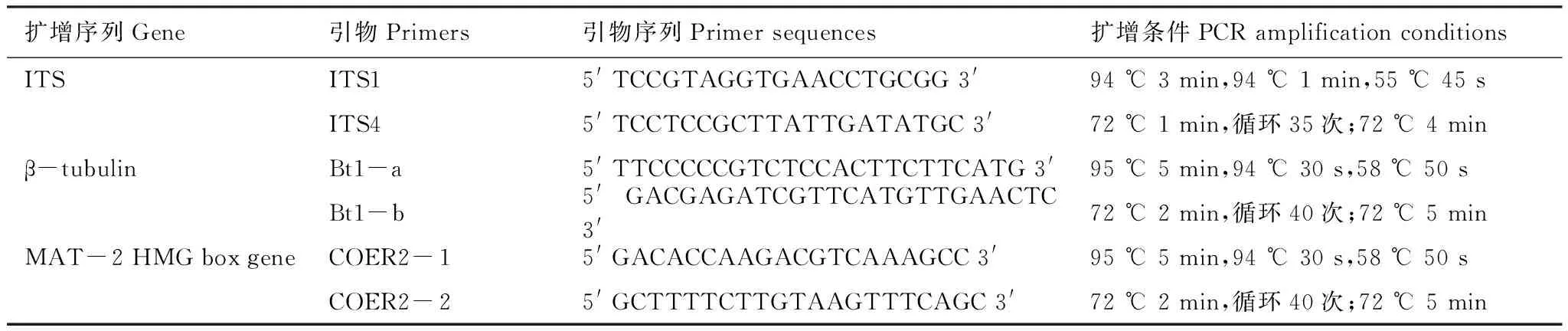
表1 基因扩增所需引物、引物序列及扩增程序统计表Table 1 The information about the Primers and the PCR conditions
1.7 系统发育分析
上述获得的基因序列首先在基因库(GenBank)内利用BLAST进行搜索比对,获得与已知序列初步的相关性,下载相关已发表序列,连同本实验获得的19株菌株的核苷酸序列利用ClustalX 2.0进行序列比对(Alignment)。经过比对完成的序列利用最大简约法(PAUP×version 4.0b10)以及贝叶斯方法(MrBayers3.1.2)进行系统发育分析,建立系统发育树。贝叶斯系统发育树构建时采用MCMC算法,运行5000000代,模型的选择采用MrModeltest2.3软件进行检测。采用PAUP软件对ITS,β-tubulin以及MAT- 2 HMG box三段基因进行同质性检验,判断三段基因是否可以用来构建基因联合树。选取Ceratocystispolonica作为外群[23]。实验所采用菌株及构建系统发育树所需参考菌株信息如表2所示。
表2 实验用Ceratocystis属菌株及构建系统发育树参考菌株信息表
Table 2 Fungal isolates obtained from different hostsIpssubelongatusinfested and isolates of known species included for reference purposes
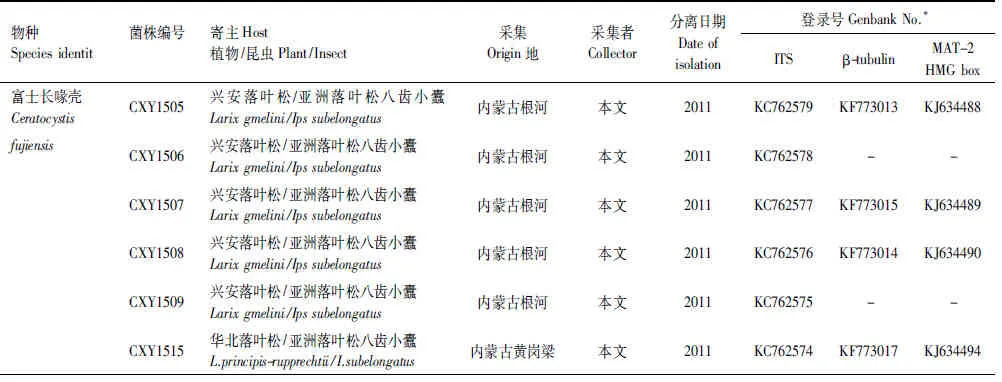
物种Speciesidentit菌株编号寄主Host植物/昆虫Plant/Insect采集Origin地采集者Collector分离日期Dateofisolation登录号GenbankNo.*ITSβ-tubulinMAT-2HMGbox富士长喙壳CeratocystisCXY1505兴安落叶松/亚洲落叶松八齿小蠹Larixgmelini/Ipssubelongatus内蒙古根河本文2011KC762579KF773013KJ634488fujiensisCXY1506兴安落叶松/亚洲落叶松八齿小蠹Larixgmelini/Ipssubelongatus内蒙古根河本文2011KC762578--CXY1507兴安落叶松/亚洲落叶松八齿小蠹Larixgmelini/Ipssubelongatus内蒙古根河本文2011KC762577KF773015KJ634489CXY1508兴安落叶松/亚洲落叶松八齿小蠹Larixgmelini/Ipssubelongatus内蒙古根河本文2011KC762576KF773014KJ634490CXY1509兴安落叶松/亚洲落叶松八齿小蠹Larixgmelini/Ipssubelongatus内蒙古根河本文2011KC762575--CXY1515华北落叶松/亚洲落叶松八齿小蠹L.principis-rupprechtii/I.subelon-gatus内蒙古黄岗梁本文2011KC762574KF773017KJ634494CXY1516华北落叶松/亚洲落叶松八齿小蠹L.principis-rupprechtii/I.subelon-gatus内蒙古黄岗梁本文2011KC762573KF773018KJ634495CXY1517华北落叶松/亚洲落叶松八齿小蠹L.principis-rupprechtii/I.subelon-gatus内蒙古黄岗梁本文2011KC762572KF773019KJ634496CXY1518华北落叶松/亚洲落叶松八齿小蠹L.principis-rupprechtii/I.subelon-gatus内蒙古黄岗梁本文2011KC762571--CXY1514华北落叶松/亚洲落叶松八齿小蠹L.principis-rupprechtii/I.subelon-gatus内蒙古黄岗梁本文2011KC762570-KJ634493CXY1511华北落叶松/亚洲落叶松八齿小蠹L.principis-rupprechtii/I.subelon-gatus内蒙古黄岗梁本文2011KC762569--CXY1512华北落叶松/亚洲落叶松八齿小蠹L.principis-rupprechtii/I.subelon-gatus内蒙古黄岗梁本文2011KC762568KF773020KJ634491CXY1513华北落叶松/亚洲落叶松八齿小蠹L.principis-rupprechtii/I.subelon-gatus内蒙古黄岗梁本文2011KC762567-KJ634492CXY1510华北落叶松/亚洲落叶松八齿小蠹L.principis-rupprechtii/I.subelon-gatus内蒙古黄岗梁本文2011KC762566KF773016-CXY1522长白落叶松/亚洲落叶松八齿小蠹L.olgensis/I.subelongatus黑龙江古城本文2012KC762584--CXY1519长白落叶松/亚洲落叶松八齿小蠹L.olgensis/I.subelongatus黑龙江古城本文2012KC762583KF773023KJ634497CXY1520长白落叶松/亚洲落叶松八齿小蠹L.olgensis/I.subelongatus黑龙江古城本文2012KC762582--CXY1521长白落叶松/亚洲落叶松八齿小蠹L.olgensis/I.subelongatus黑龙江古城本文2012KC762581KF773022KJ634498CXY1523长白落叶松/亚洲落叶松八齿小蠹L.olgensis/I.subelongatus黑龙江古城本文2012KC762580KF773021KJ634499C.polonicaCMW5026欧洲云杉/云杉八齿小蠹Piceaabies/Ipstypographus澳大利亚,T.Kirisits1997AY233907AY233932AY233959CMW8845樟子松/横坑切梢小蠹Pinussylves-tris/Tomicusminor澳大利亚T.Kirisits1998AY233890AY233926AY233956CMW2284日本鱼鳞松/亚洲落叶松八齿小蠹变种P.jezoensis/I.typographusjaponi-cus日本,北海道Y.Yamaoka1989AY233894AY233935AY233964CMW2210日本鱼鳞松/亚洲落叶松八齿小蠹变种P.jezoensis/I.typographusja-ponicus日本,北海道Y.Yamaoka1990AY233897AY233936AY233960CMW8830欧洲云杉/云杉八齿小蠹Piceaabies/Ipstypographus挪威T.KirisitsH.Solheim1992AY233889AY233929AY233955CMW8873欧洲云杉/云杉八齿小蠹Piceaabies/I.typographus挪威T.KirisitsH.Solheim1990AY233888AY233928AY233954CMW2272日本鱼鳞松/亚洲落叶松八齿小蠹变种P.jezoensis/I.typographusja-ponicus日本,北海道Y.Yamaoka1990AY233893AY233934-CMW7151欧洲云杉/云杉八齿小蠹Piceaabies/I.typographus澳大利亚R.GrubelnikT.Kirisits1997AY233896--
续表
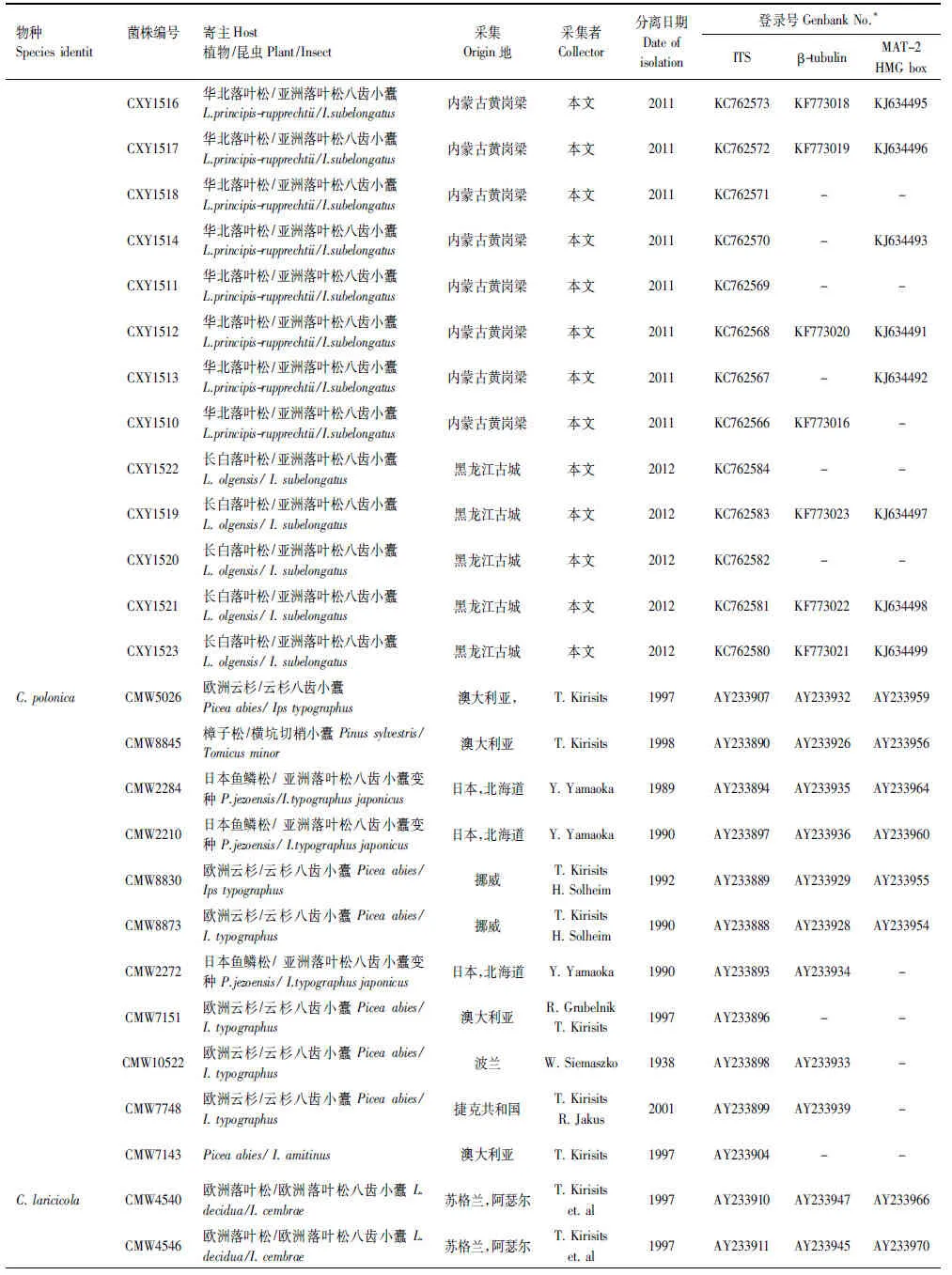
续表
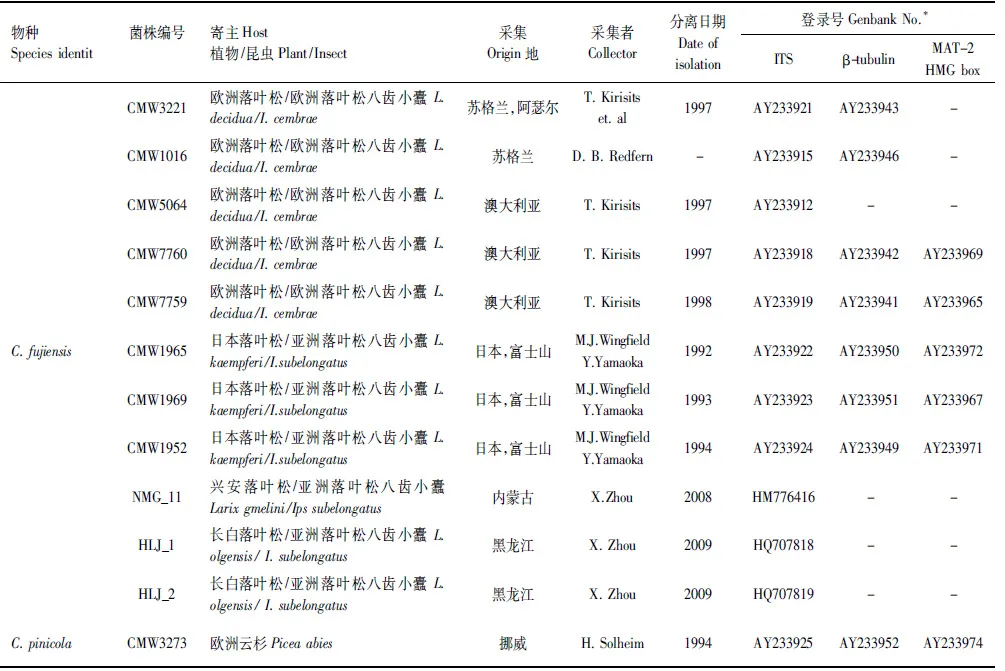
内蒙古根河实验林场,经纬度:121°37′12″E,50°50′15″N;内蒙古克什克腾旗黄岗梁实验林场,经纬度:117°31′14″E 43°35′08″N;黑龙江古城镇湖水林场,经纬度:130°13′06″E 45°23′34″N;-:该序列信息无
2 结果与分析
2.1 真菌分离和形态学鉴定
实验从103份标本上共分离得到长喙壳类真菌157株,其中包括Ceratocystis属真菌19株,这些菌株在生长速率、培养特征和形态学特征上表现出一致性,可知19株真菌为同一个种。19株Ceratocystis属真菌菌株分别在内蒙古根河、黄岗梁和黑龙江古城3个地区分离得到,分离率分别为40%、31%和22%。
通过对上述菌株进行生理学以及形态学观察分析结果显示,在25 ℃黑暗恒温,2%MEA培养基培养条件下,菌株在第4天到第5天生长速率最快,达到21 mm/d,在第7天时可长满直径为85 mm的一次性塑料培养基。在2%MEA培养基上新生菌丝灰白色,中央橄榄绿色,菌丝生长较快,菌落中央呈绒毡状,致密,较厚(图1-a,图1-b)。
试验分离纯化得到的菌株在形态上基本一致,选用菌株CXY1506和CXY1517进行详细的形态学观察。子囊壳褐色至黑色,基部球形,表生,子囊壳直径132—274 μm(图1-c,图1-d),着生大量褐色菌丝。菌丝长度250—626 μm(图1-g,图1-h)。颈暗褐色至黑色,直立或稍弯曲,长360—1201 μm,壁光滑,圆锥状,由颈基部向颈顶部逐渐变细,颈基部宽32—58 μm,顶部宽10—24 μm(图1-c,图1-d)。孔口缘丝透明,向外稍倾斜,孔口缘丝长25—57 μm(图1-e,图1-f)。子囊原囊壁渐消解,子囊孢子长3.5—6.1 μm,宽1.2—2.4 μm(图1-i),椭圆形,有胶质鞘,单细胞透明。分生孢子圆柱形,单细胞透明,长7.6—22.7 μm,宽3.5—7.8 μm(图1-j)。显微形态观察特征显示与Ceratocystisfujiensis[23]无明显区别。
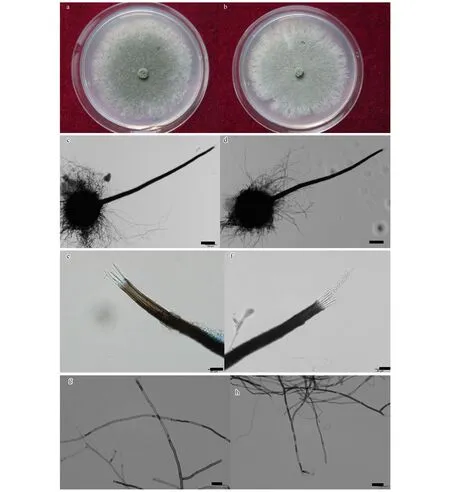
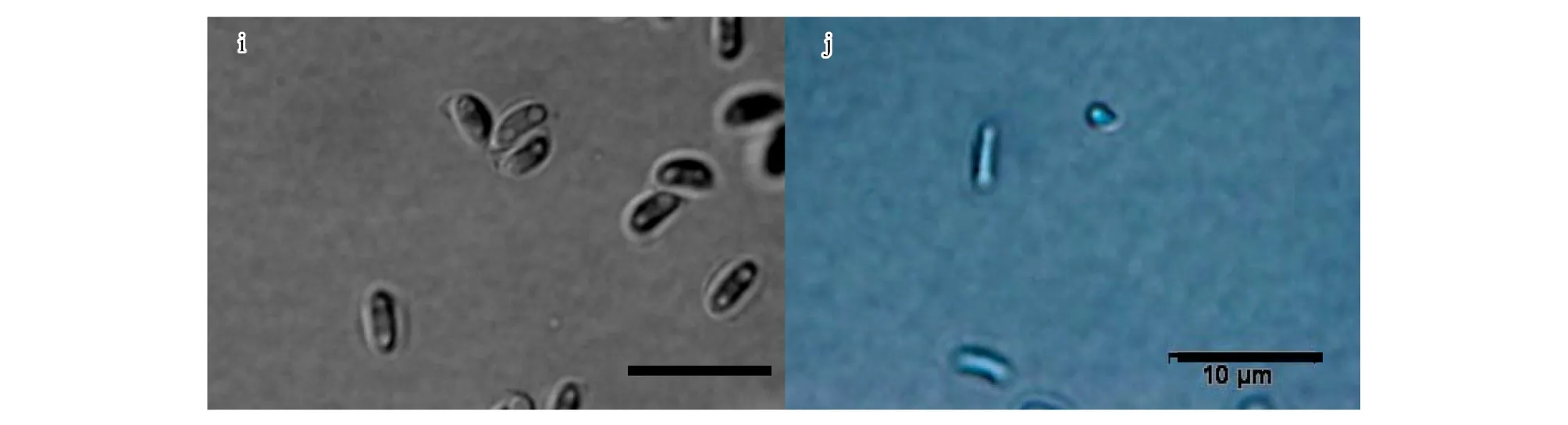
图1 Ceratocystis fujiensis 形态学特征图(CXY1506,CXY1517)Fig 1 Light micrographs of Ceratocystis fujiensis(CXY1506,CXY1517)a.菌株CXY1517在MEA培养基上25 ℃条件下培养5 d的菌落形态;b.菌株CXY1506在MEA培养基上25 ℃条件下培养5 d的菌落形态;c,d.子囊壳(100 μm);e,f.孔口缘丝(20 μm);g,h.营养菌丝(20 μm);I.子囊孢子(10 μm); j.分生孢子(10 μm)
2.2 系统发育分析
用ClustalX 2.0对44个ITS序列进行比对,利用PAUP* version 4.0b10最大简约法分析结果显示,比对的547个特征视为无序且权重相同,其中恒量特征492个,29个有简约信息的变量特征。利用最大简约法构建的联合树步长(Tree length)为71,一致性指数(Consistency index, CI)为0.7587,保留指数(Retention index, RI)为0.9548,趋同性指数(Homoplasy index, HI)为0.2143,可调一致性指数(Rescaled consistency index, RC)为0.8337。MP树表明43个内群分为3个主要分支,分别为Ceratocystispolonica,C.fujiensis,C.laricicola(图2)。本实验分离所得菌株与日本C.fujiensis3个菌株以及周秀华等[28]分离得到的C.fujiensis菌株聚集为1个分支,其中周秀华所分离的菌株构成1个亚分支,与其他C.fujiensis均有4个变化;CXY1510和CXY1512构成一个亚分支,与其他C.fujiensis均有3个变化;日本菌株CMW1952和CMW1969与中国菌株CXY1517,CXY1516,CXY1523均有1个变化;而CXY1518具有两个变化。基于ITS基因的MP树3个分支的节点支持率(BS)均高于或等于80%(图2)。采用贝叶斯方法进行贝叶斯树的构建,采用MCMC算法,共运行5000000代,构建的系统发育树与MP树拓扑结构完全一致,贝叶斯分析结果显示后验概率(PP)均高于或等于0.80。图2中最后显示节点支持率为BS/PP。
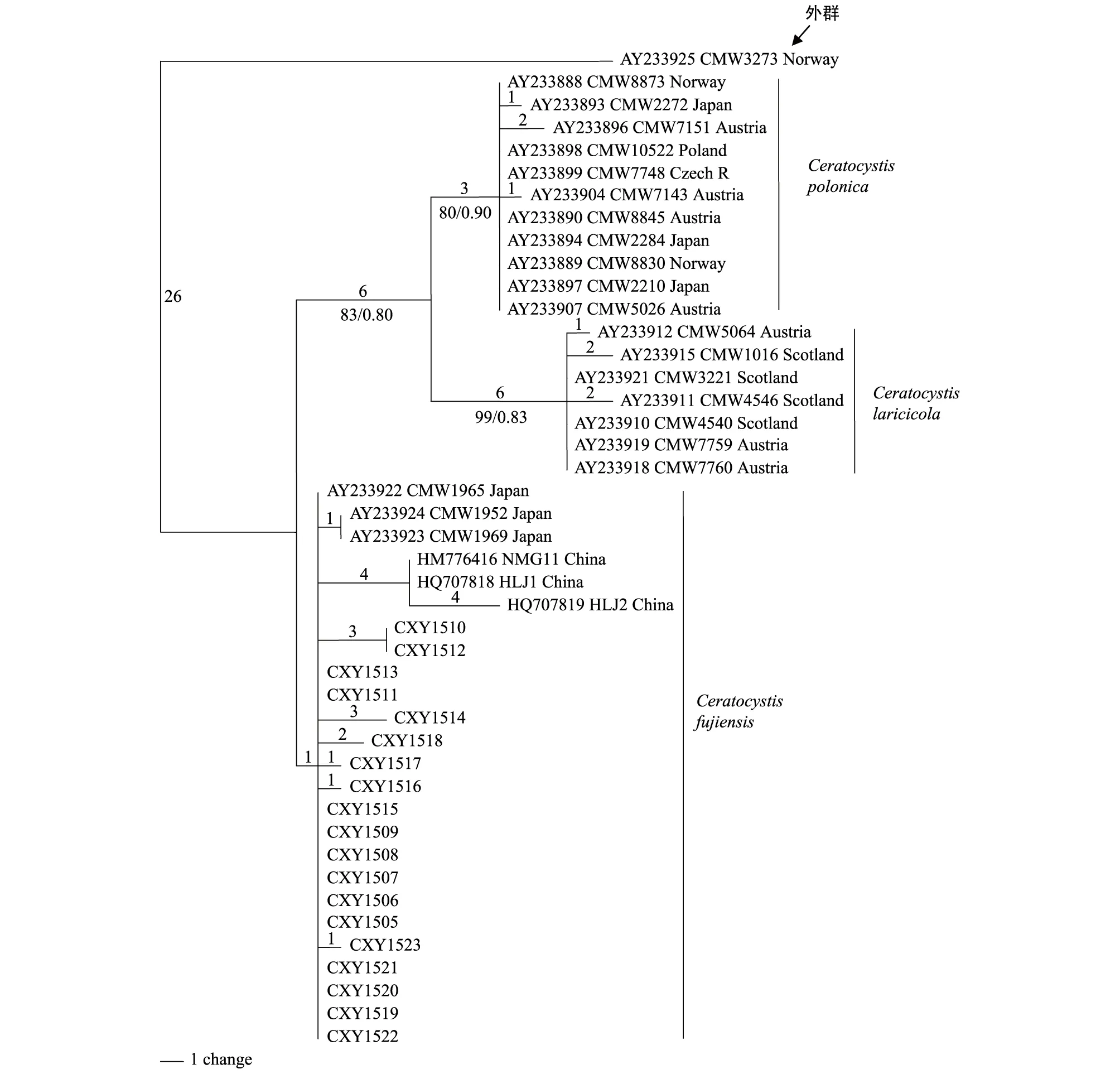
图2 基于ITS序列采用PAUP软件构建的最大简约树(MP树)Fig.2 Phylogram obtained from DNA sequence data of the ITS region with the maximum parsimony method
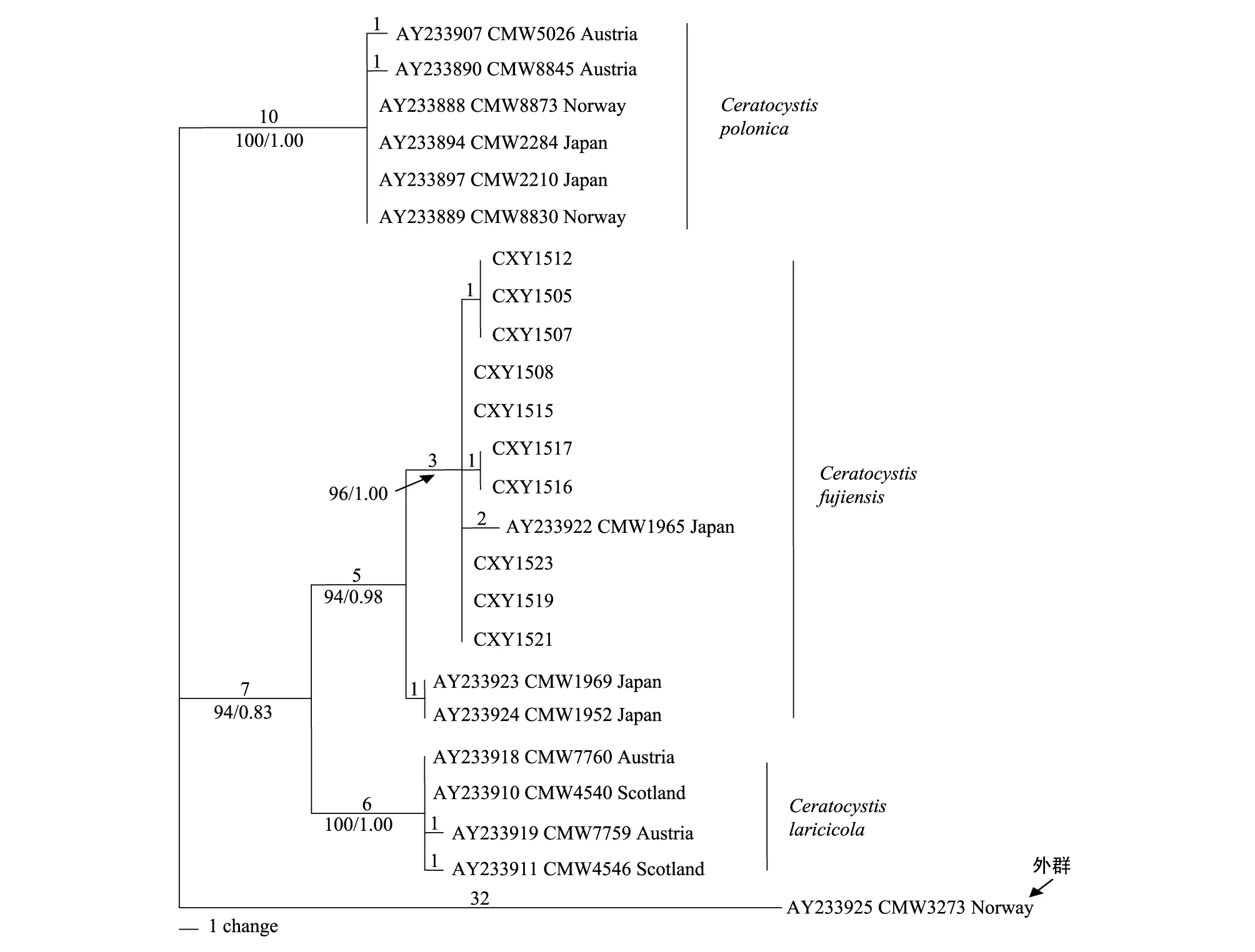
图3 基于ITS,β-tubulin以及MAT- 2 HMG box三段基因构建的MP联合树Fig.3 Phylogram obtained from MP analyses of the ITS, β-tubulin and MAT- 2 HMG box sequence data
对要进行系统发育分析的3个位点的DNA序列进行同质性检验(Pvalue=0.451),发现3个位点的DNA序列可以进行基因联合树的构建。利用ClustalX 2.0对ITS、β-tubulin以及MAT- 2 HMG box三段基因进行DNA序列比对。最大简约法分析比对的1269个特征视为无序且权重相同,结果显示,其中恒量特征为1204个,32个无简约信息的变量特征以及33个有简约信息的变量特征。利用最大简约法构建的联合树步长(Tree length)为72,一致性指数(CI)为0.8974,保留指数(RI)为0.9778,趋同性指数(HI)为0.1026,可调一致性指数(RC)为0.9325,得到各节点支持率为BS。MP树表明23个内群分为3个主要分支,分别对应种C.polonica,C.fujiensis,C.laricicola(图3)。本实验分离所得菌株与日本3个菌株聚为1支,最后节点支持率BS/PP=94/0.98。其中本实验分离到的菌株与日本菌株CMW1965聚集为1个亚分支,后验概率PP=1.00,节点支持率BS=96;其中菌株CXY1512,CXY1505,CXY1507构成1个亚分支,CXY1516和CXY1517构成1个亚分支,与其他C.fujiensis均有1个变化。CXY1508,CXY1515,CXY1523,CMW1519,CMW1521具有一致性,而日本菌株CMW1969和CMW1952构成1个单独的分支。该MP联合树3个分支的节点支持率(BS)均高于或等于94%(图3)。利用MrModeltese2.3进行模型检测,在AIC(Akaike Information Criterion)标准下,获得最佳模型HKY+I。贝叶斯系统发育树构建方法采用MCMC算法,共运行5000000代,构建的系统发育树拓扑结构与MP树完全一致,结果显示后验概率(PP)均高于或等于0.83,多数节点后验概率值为1.00。
3 结论与讨论
本研究对我国东北异域分布的3种落叶松林内的落叶松八齿小蠹危害的寄主坑道组织和虫体标本进行采集和系统分离长喙壳真菌,获得的Ceratocystis属菌株进行生理学特性、菌落特征、微观形态学的观察,以及基于ITS、β-tubulin、MAT- 2 HMG box多位点DNA序列的系统发育分析。研究结果表明,实验分离得到Ceratocystisfujiensis菌株19株。该种首先在日本发现[23],已与亚洲落叶松八齿小蠹形成稳定的伴生关系,是伴生菌区系中的先锋种和致病力最强的病原菌,人工接种条件下可以致死30年生的日本落叶松(Larixkaempferi)[21- 22]。我国学者曾在长白落叶松和兴安落叶松的小蠹虫坑道分离到3株该病原菌[28]。本研究首次从大兴安岭的兴安落叶松,长白山地区的长白落叶松和大兴安岭余脉不同地域分布的华北落叶松林内系统发现C.fujiensis,表明该病原性真菌在我国东北、华北落叶松林内广泛分布,与落叶松八齿小蠹形成稳定的伴生关系。
在欧洲分布的云杉八齿小蠹伴生菌C.polonica和落叶松八齿小蠹伴生菌C.laricicola具有明显的寄主分化特征,接种试验证明只能在各自的寄主(欧洲云杉Piceaabies和欧洲落叶松Larixdecidua)上造成显著的病斑,而无法成功侵染另一寄主,即形成了“Piceaabies-Ipstypographus-C.polonica”和“Larixdeciduas-Ipscembrae-C.laricicola”的协同进化关系[30]。日本也发现落叶松八齿小蠹伴生菌的分化特征,即“Larixkaempferi-Ipssubelongatus-C.fujiensis”的协同进化[23]。本项研究结果显示C.fujiensis在我国也与危害3种本土落叶松寄主的落叶松八齿小蠹形成稳定的伴生关系,支持了这种协同进化关系,即特定种的小蠹虫与特定种的真菌稳定伴生形成了种特异性伴生的进化趋势。尚需进一步研究C.fujiensis和C.laricicola在不同落叶松寄主(欧洲落叶松和亚洲落叶松)上的交叉接种,以及C.fujiensis和C.polonica在云杉(欧洲云杉、日本云杉等)和亚洲落叶松(包括日本落叶松、兴安落叶松、长白落叶松和华北落叶松等)上的交叉接种试验,以验证这种协同进化形成的伴生菌的寄主分化特征。
伴生菌适应寄主植物和小蠹虫的分化潜力已在不同地理(或寄主)种群中发现。日本的云杉八齿小蠹(I.typographusf.japonicus)被视为欧洲种的1个变种,两个种群间存在明显的遗传隔离[31- 32],危害不同的云杉寄主;尽管二者均与C.polonica形成稳定的伴生关系,但该伴生菌在两个地区存在显著的遗传差异,分化为明显的两个地理(或寄主)种群[33],即“Piceaabies-Ipstypographus-C.polonica欧洲种群”和“Piceajezoensis(日本云杉)-I.typographusf.japonicus-C.polonica日本种群”。
尽管我国落叶松八齿小蠹与日本落叶松八齿小蠹属为同一种,但其线粒体基因序列显示二者存在不同单倍体型的差异[18],而且我国落叶松八齿小蠹的长白落叶松种群和兴安落叶松种群间存在信息素响应的二型现象,可能二者为不同的地理(或寄主)种群[26]。亚洲落叶松八齿小蠹存在着丰富的种下分化现象。由基于ITS序列的MP树(图2)可见,C.fujiensis表现出丰富的种内分化。同时基于多DNA序列的联合系统发育分析(图3)可见,相比较地域分布更为广泛的C.polonica和C.laricicola,C.fujiensis却表现出更加丰富的种内分化,聚类出两个亚分支,一支为日本的两个菌株,另一分支为日本的1个菌株和中国的所有菌株聚在一起;尽管中国菌株并未表现出3种寄主的分化特征,但危害长白落叶松的落叶松八齿小蠹的伴生菌种群表现出更加一致的DNA序列(图3)。这种伴生菌丰富的种下分化显示出与其寄主和媒介昆虫丰富的遗传多样性的平行结构,值得从更大的样本量和更全面的分析,例如调查全基因组的遗传多样性,揭示C.fujiensis和小蠹虫种群下是否有隐存种或种群分化的存在,以验证是否也存在着特异性伴生的进化现象。
[1] 杨静莉, 林强, 陈国发. 落叶松八齿小蠹的危险性分析. 东北林业大学学报,2007, 35(3):60- 63.
[2] 胡新生, Ennos R A, 王笑山. 论我国兴安落叶松、长白落叶松及华北落叶松种间遗传进化关系. 林业科学,1999, 35(3): 84- 96.
[3] 萧刚柔. 中国森林昆虫. 北京:中国林业出版社, 1992.
[4] 殷惠芬, 黄复生. 中国经济昆虫志. 北京: 科学出版社, 1984, 54- 55.
[5] 国家林业局2013年第4号公告http://www.forestry.gov.cn/portal/main/govfile/13/govfile_1983.htm [2013- 3- 15]
[6] Kirisits T. Fungal associates of European bark beetles with special emphasis on the ophiostomatoid fungi// Lieutier F, Day K R, Battisti A, Grégoire J C, Evans H F, eds. Bark and Wood Boring Insects in Living Trees in Europe. The Netherlands: Kluwer Academic Publishers, 2004: 181- 236.
[7] Wingfield M J, Seifert K A, Webber J F.CeratocystisandOphiostoma: Taxonomy, Ecology and Pathogenicity. Minnesota, USA: American Phytopathological Society, 1993.
[8] 吕全.中国红脂大小蠹伴生菌的系统发育及其生物生态学习性[D]. 北京:中国林业科学研究院, 2007.
[9] Hartig T. Ambrosia des Bostrichus dispar. Allgemeine Forst-Und Jagdzeitung, 1844, 13: 73- 73.
[10] Cognato A I, Sun J H. DNA based cladograms augment the discovery of a newIpsspecies from China (Coleoptera: Curculionidae: Scolytinae). Cladistics, 2007, 23(6): 539- 551.
[11] Grégoire J C, Evans H. Damage and control of BAWBILT organisms an overview// Lieutier F, Day K R, Battisti A, Grégoire J C, Evans H F, eds. Bark and Wood Boring Insects in Living Trees in Europe. The Netherlands: Kluwer Academic Publishers, 2004: 19- 37.
[12] Christiansen E.Ceratocystspolonicainoculated in Norway spruce: Blue-staining in relation to inoculum density, resinosis and tree growth. European Journal of Forest Pathology, 1985, 15(3): 160- 167.
[13] Kirisits T. Fungi isolated fromPiceaabiesinfested by the bark beetleIpstypographusin the Biaowiea forest in north-eastern Poland. Forest Pathology, 2010, 40(2): 100- 110.
[14] Aghayeva D N, Wingfield M J, deBeer Z W, Kirisits T. Two newOphiostomaspecies withSporothrixanamorphs from Austria and Azerbaijan. Mycologia, 2004, 96(4): 866- 878.
[15] Jankowiak R, Rossa R, Mista K. Survey of fungal species vectored byIpscembraeto European larch trees in Raciborskie forests (Poland). Czech Mycology, 2007, 59(2): 227- 239.
[16] Redfern D B. The roles of the bark beetle Ips cembrae, the woodwasp Urocerus gigas and associated fungi in dieback and death of larches// Wilding N, Collins N M, Hammond P M, Webber J F, eds. Insect-Fungus Interactions. 14th Symposium of the Royal Entomological Society of London in collaboration with the British Mycological Society. London: Academic Press, 1989: 195- 204.
[17] Redfern D B, Stoakley J T, Steele H, Minter D W. Dieback and death of larch caused byCeratocystislaricicolasp. nov. following attack byIpscembrae. Plant Pathology, 1987, 36(4):467- 480.
[18] Stauffer C, Kirisits T, Nussbaumer C, Pavlin R, Wingfield M J. Phylogenetic relationships between the European and Asian eight spined larch bark beetle populations (Coleoptera, Scolytidae) inferred from DNA sequences and fungal associates. European Journal of Entomology 2001, 98(1): 99- 105.
[19] Aoshima K. Studies on Wood-staining Fungi of Japan(in Japanese with English Sunnary) [D]. Tokyo: University of Tokyo, 1965.
[20] Chung W H, Kim J J, Yamaoka Y. Uzunovic A, Masuya H, Breuil C.Ophiostomabreviusculumsp. nov.(Ophiostomatales, Ascomycota) is a new species in theOphiostomapiceaecomplex associated with bark beetles infesting larch in Japan. Mycologia, 2006, 98(5): 801- 814.
[21] Yamaoka Y C, Hizai M, Chung W H, Masuya H. Constant association of ophiostomatoid fungi with the bark beetleIpssubelongatusinvading Japanese larch logs. Mycoscience, 2009, 50(3):165- 172.
[22] Yamaoka Y, Wingfield M J, Ohsawa M, Kuroda Y. Ophiostomatoid fungi associated withIpscembraein Japan and their pathogenicity of Japanese larch. Mycoscience, 1998, 39(4):367- 378.
[23] Marin M, Preisig O, Wingfield B D, Kirisits T, Yamaoka Y, Wingfield M J. Phenotypic and DNA sequence data comparisons reveal three discrete species in theCeratocystispolonicaspecies complex. Mycological Research, 2005, 109(10): 1137- 1148.
[24] Francke-Grosmann H. Ectosymbiosis in wood-inhabiting insects// Henry S M, ed. Symbiosis. New York: Academic Press, 1967, 2: 141- 205.
[25] Paine T D, Raffa K F, Harrington T C. Interactions amongScolytidbark beetles, their associated fungi, and live host conifers. Annual Review of Entomology, 1997, 42(1): 179- 206.
[26] Song L W, Zhang Q H, Chen Y Q, Zuo T T, Ren B Z. Field responses of the Asian larch bark beetle,Ipssubelongatus, to potential aggregation pheromone components: disparity between two populations in northeastern China. Insect Science, 2011, 18(3): 311- 319.
[27] Paciura D, Zhou X D, DeBeer Z W, Jacobs K, Ye H, Wingfield M J. Characterisation of synnematous bark beetle-associated fungi from China, includingGraphiumcarbonariumsp nov. Fungal Diversity, 2010, 40(1): 75- 88.
[28] 周秀华, 宋瑞清, 曹翠, 崔磊, 梁晓东, 潘建中, 朱元金, 胡振宇. 落叶松八齿小蠹伴生真菌 3 个菌株的鉴定及生物学生理学特性. 林业科学,2011, 47(5):82- 86.
[29] 周秀华, 宋瑞清, 周旭东, 崔磊, 曹翠. 落叶松八齿小蠹体内外和坑道内真菌类群. 菌物学报, 2011, 30(3): 400- 407.
[30] Harrington T C, Pashenova N V, McNew D L, Steimel J, Konstantinov M Y. Species delimitation and host specialization ofCeratocystislaricicolaandC.polonicato larch and spruce. Plant Disease, 2002, 86(4): 418- 422.
[31] Sallé A, Arthofer W, Lieutier F, Stauffer C, Kerdelhué C. Phylogeography of a host-specific insect: genetic structure ofIpstypographusin Europe does not reflect past fragmentation of its host. Biological Journal of the Linnean Society, 2007, 90(2): 239- 246.
[32] Stauffer C, Lakatos F.Ipstypographusf.japonicusNiijima (Col., Scolytidae): a genetic analysis by allozymes and mitochondrial sequence data// Jandl R, Devall M, Khorchidi M, Schimpf E, Wolfrum G, Krishnapillay KB, eds. Pramaju Sdn. Bhd, Vol. 3, Poster Abstracts, Forests and Society: The Role of Research. XXI IUFRO World Congress. Kuala Lumpur, 2000: 397- 397.
[33] Marin M, Preisig O, Wingfield B D, Kirisits T, Wingfield M J. Single sequence repeat markers reflect diversity and geographic barriers in Eurasian populations of the conifer pathogenCeratocystispolonica. Forest Pathology, 2009, 39(4): 249- 265.
The species specific associations betweenIpssubelongatusand ophiostomatoid fungi
MENG Xianjing1, LÜ Quan1,*, LIU Xuewei1, JIAO Xiangjie2, LIANG Jun1, ZHANG Xingyao1
1KeyLaboratoryofForestryProtection,StateForestryAdministration;ResearchInstituteofForestEcology,EnvironmentandProtection,ChineseAcademyofForestry,Beijing100091,China2GuangxingForestryFarm,KeShiKeTengqi,ChifengCityinInnerMongolia,Chifeng025350,China
The bark-beetles and ophiostomatoid fungi formed a stable association relationship in nature. It is a universal ecology phenomenon occurring frequently in forest ecological systems. The association between the beetles and fungi are regarded to some extent as a symbiosis in a broad sense. They have been extensively and intensively documented and illustrated from all over the world since it was first realized. Some research showed thatIpsbeetles spread over Eurasia were extensively associated with a number of ophiostomatoid fungi species. Among which, some species are important pathogens of conifers. Although the morphology and ecology characteristics of threeIpsbeetles,I.typographus,I.cembrae, andI.subelongatuswere almost identical, these beetles were evidenced in a series studies as distinct species based on the phylogenetic analysis of DNA information and critical morphological comparison. In parallel, an ophiostomatoid fungus,Ceratocystispolonicapreviously recognized as a closely associated fungus with these beetles was also separated into three distinct entities resided in theCeratocystiscoerulescensspecies complex, and stably associated with three kinds of bark beetles, respectively, where a species specific association between bark beetles and ophiostomatoid fungi was established. The species specific association was understood as a result of co-evolution in forests where both partners lived together in a common habitat. The samples collected in this study from three allopatricLarixhosts whichIpssubelongatusattacked seriously. The ophiostomatoid strains were isolated from the body surface ofIpssubelongatus, blue-stain tissue or the galleries bark-beetles attacked. Observations of the colony, physiology and morphology characteristic, and comparisons of anamorph and teleomorph structures of allCeratocystisstrains, confirmed that the strains are indistinguishable fromCeratocystisfujiensisM.J.Wingf. The phylogenetic analysis based on sequences derived from the ITS regions of the rDNA operon, the partial β-tubulin gene and the MAT- 2 HMG box gene, further determined a total of nineteen fungal strains as speciesCeratocystisfujiensis. The study first determinedCeratocystisfujiensisextensively existed in three allopatric larch forests in northeast and north China, which formed a stable association relationship withIpssubelongatusunder such ecological conditions.Ceratocystisfujiensiswas proved as a dominant fungus associated withIpssubelongatusin Japan, and a pioneer species and the strongest pathogenic fungus in all the bark-beetles associated fungi. BecauseC.fujiensiswidely infestingLarixspp. plants in China, inevitably, this phenomenon should be paid high attention. The study provides scientific basis to make the policies and measures for the government to prevent and control the composite damages of diseases and pests effectively. The result in this paper provides support to the hypothesis of species specific association betweenIpsbeetles and ophiostomatoid fungi. Meanwhile, the multi-gene sequences characteristic indicates thatI.subelongatusandC.fujiensisexist significant genetic diversity in different geographic populations, which probably predict the possibility of the species specific association occurred under species levels. The associations betweenIpsbeetles and ophiostomatoid fungi exhibit an ideal insight into completely understanding the symbiotic relationship between the bark beetles and ophiostomatoid fungi, and species specific association as well.
Ipssubelongatus;Ceratocystisfujiensis; phylogeny;Larixspp.; pathogen
中央级公益性科研院所基本科研业务费专项资金(CAFRIFEEP201102); 国家自然科学基金(31070571)
2013- 04- 01;
日期:2014- 07- 03
10.5846/stxb201304010576
*通讯作者Corresponding author.E-mail: luquan@caf.ac.cn
孟贤静,吕全,刘学伟,焦相杰,梁军,张星耀.落叶松八齿小蠹与长喙壳真菌间的种特异性伴生关系.生态学报,2015,35(2):313- 323.
Meng X J, Lü Q, Liu X W, Jiao X J, Liang J, Zhang X Y.The species specific associations betweenIpssubelongatusand ophiostomatoid fungi.Acta Ecologica Sinica,2015,35(2):313- 323.
