5-氯-6-甲基吡嗪-2-羧酸甲酯的合成
2015-03-10张世界张玲玲程杰兵陈海南王晓钟
张世界,张玲玲,*,程杰兵,陈海南,王晓钟
(1 浙江新三和医药化工股份有限公司,浙江 上虞 312369;2.浙江大学化学工程与生物工程学院,浙江 杭州 310027)
引言
5-氯-6-甲基吡嗪-2-羧酸甲酯(1)作为重要的医药中间体,可以用于多个药物的合成。如:图1 中化合物Ⅰ是用于CXCR3 阻断剂中的一种药物,CXCR3 可能在一些疾病中起关键作用,包括动脉粥样硬化、多发性硬化、肺纤维化,I 型糖尿病,重症肌无力、急性心脏移植排斥[1];化合物Ⅱ是用于TRPV1 阻断剂中的一种药物,用于各种疼痛的治疗[2];化合物Ⅲ用于抗河豚毒素[3-4]。在这些药物的合成中,5-氯-6-甲基吡嗪-2-羧酸甲酯都是必不可少的关键中间体,所以开发、优化其适宜于工业化的路线有重要的应用价值。

图1
文献报道的合成5-氯-6-甲基吡嗪-2-羧酸甲酯路线不多,参考文献[5-7],本文选用以下的合成路线(Scheme 1),对目标化合物的合成工艺进行研究,并通过工艺优化得到适宜于工业化的工业技术。

图2 合成路线图
该路线以二氨基马来腈和丙酮酸为起始原料,经过环合、酸水解、酯化和氯化反应得到目标产物,该路线原料易得,操作简单,比较适宜于工业化,但是文献报道的路线存在最大的问题是三废污染严重,安全环保压力大,能耗大。针对以上问题,本文希望通过对合成工艺进行优化,降低成本,提高收率,并解决该路线在实际操作过程中存在的安全环保问题,使该路线更适应于目前国内化工发展的方向。
1 实验
1.1 仪器与试剂
熔点用Yanaco 显微熔点仪测定,温度未经校正;薄层层析色谱用GF254 硅胶板;核磁共振氢谱用Varian Unity INOVA400 核磁共振仪测定,以TMS 作内标;
原料中所有试剂和溶剂均为工业级,均未作特殊处理。
1.2 合成
1.2.1 5-羟基-6-甲基-2,3-二腈基吡嗪(2)的合成
2000 mL 烧瓶中投入二氨基马来腈(120 g,1.11 mol)、甲 醇(350 mL),水(350 mL)和盐酸(200 mL),保持温度20 ℃~30 ℃,搅拌下滴加丙酮酸(98 g,1.11 mol),滴加完毕保持温度20 ℃~30 ℃搅拌反应4 h,降温至-5 ℃~0 ℃,并保温搅拌1 h,大量白色固体析出,抽滤,得5-羟基-6-甲基-2,3-二腈基吡嗪(2)250 g,乳白色粉末,该湿品不经干燥和精制,直接用于下步反应。
1.2.2 5-羟基-6-甲基吡嗪-2-羧酸(3)
1000 mL 烧瓶中投入上步得到的化合物2(250 g),盐酸(质量分数为30%,500 mL,5.61 mol),升温回流反应8 h,冷却至10 ℃~15 ℃,抽滤,水洗,50 ℃真空烘干,得到5-羟基-6-甲基吡嗪-2-羧酸(3)125 g,砖红色固体,熔点>300℃,含量>97%,两步合计收率73.2%。
1.2.3 5-羟基-6-甲基吡嗪-2-羧酸甲酯(4)
2000 mL 烧瓶中投入化合物3(125 g,0.812 mol),甲醇(1250 mL),保持温度-5 ℃~0 ℃,剧烈搅拌下滴入氯化亚砜(116 g,0.97 mol),滴加完毕保保持温度-5 ℃~0 ℃搅拌反应0.5 h,升温回流4~6 h,TLC 检测原料转化完毕,冷却至10 ℃~15 ℃,搅拌0.5 h,抽滤,50 ℃真空烘干,得到5-羟基-6-甲基吡嗪-2-羧酸甲酯131 g(4),白色固体,熔点270 ℃~271 ℃(文献[6]:270 ℃~271 ℃),含量>98%,收率:96.1%。
1.2.4 5-氯-6-甲基吡嗪-2-羧酸甲酯(1)
1000 mL的烧瓶中投入化合物4(131 g,0.78 mol),三氯氧磷(300 mL,3.26 mol),搅拌加入DMF(2.8 g,0.04 mol),升温到90 ℃~95 ℃反应4 h,TLC 检测原料转化完毕,降温至50 ℃,减压回收过量的三氯氧磷,得黑色油状物。
加入甲苯(300 mL),控制温度低于20 ℃,搅拌滴加水(100 mL),分层,有机相水洗,硫酸镁干燥,10 g 硅胶搅拌,过滤。母液浓缩至50%,冷却至0 ℃~5℃,搅拌1 h,析出大量黄色固体,抽滤,用0 ℃~5 ℃的甲苯漂洗(20 mL×2),50 ℃真空烘干,得到5-氯-6-甲基吡嗪-2-羧酸甲酯(1)113 g,淡黄色固体,熔点42 ℃~43 ℃(文献[6]:40 ℃~43℃),收率78%。
1H NMR(CDCl3)δ:2.78(3H,S,CH3),4.05(3H,S,OCH3),8.97(H,S,3-H)
2 结果与讨论
2.1 5-羟基-6-甲基-2,3-二腈基吡嗪(2)的合成
文献报道[5]反应在乙醇、水与盐酸体系中进行反应,该体系在生产过程中产生大量含醇酸性废水,对环保中废水处理的要求非常高,同时也增加了生产成本。
本文采用水、甲醇和盐酸的三元体系进行反应,总的溶剂使用量减少了90%,该体系使用的最大优点是反应后处理后的母液可以进一步套用,减少了三废的产生。母液经过4 次套用后,5-羟基-6-甲基-2,3-二腈基吡嗪(2)的平均收率达到89.4%,高于文献[5]85%的收率。
通过该工艺得到的中间体含可以不经烘干和精制直接用于下步水解反应。
2.2 5-羟基-6-甲基吡嗪-2-羧酸(3)的合成
文献报道[6]的第二步酸水解反应中,使用浓盐酸是原料的10 倍(重量比),产品用DMF 重结晶,浓盐酸量使用过高,三废量增加,提高了三废处理的成本,并且产物的重结晶溶剂DMF 的使用回收对节能降耗和安全环保都有很大的压力。
通过实验对盐酸用量进行了优化:
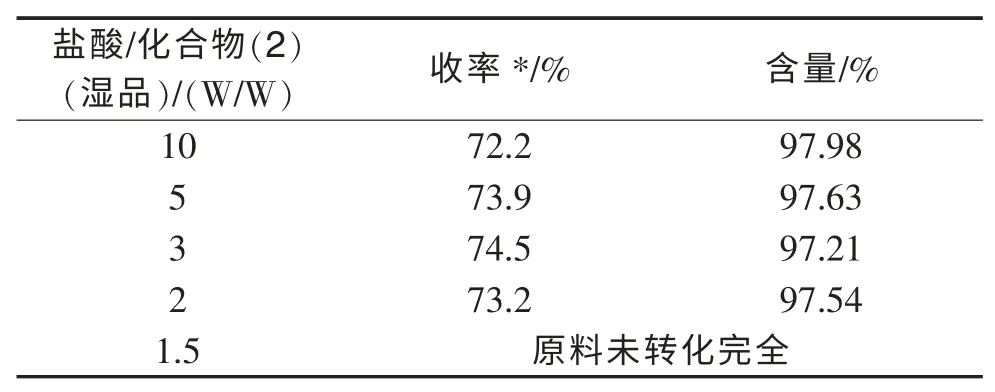
表1 盐酸(质量分数为30%)用量对水解反应的影响
从表1 中可以看出,盐酸/化合物(2)(湿品)(W/W)在2:1 的时候,反应就能完全转换完全,得到的产品收率比较理想。另外,从产品的含量看,均高于97%,所以得到的中间体不需要经过重结晶就可以直接用于下步反应。通过以上工艺优化,减少了盐酸的使用量,降低了大量酸性废水的产生,同时产品含量高,完全能满足下步反应的需要。
2.3 5-羟基-6-甲基吡嗪-2-羧酸甲酯(4)
文献报道[6]第三步酯化反应中,甲醇的用量为原料的60 倍(重量比),甲醇的用量明显太高,增加了原料成本,并且甲醇用量太大对产能也有很大的影响。
通过实验对甲醇的用量进行了优化:

表2 甲醇使用量对酯化反应的影响
从表2 中可以看出,盐酸/化合物(3)(W/W)在5:1~50:1 的区间,都能以较高的收率得到产品,但是当盐酸/化合物(3)(W/W)低于10:1 时,产品含量明显降低,应该是过少的甲醇用量,使少量的杂质在冷却过程中析出,导致产品含量降低,需要通过重结晶提纯中间体,否则对于后步反应有明显影响。所以盐酸/化合物(3)(W/W)选用10:1 是比较理想的选择,即保证了产品的收率和含量,又有效的控制了用量,降低了成本,提高了产能。
2.4 5-氯-6-甲基吡嗪-2-羧酸甲酯(1)
文献报道[6]第四步反应结束,使用大量的水分解过量的三氯氧磷,然后三氯甲烷萃取,硅胶脱色,石油醚重结晶,得到目标产物。但是在实际操作中用水分解过量的三氯氧磷,不仅产生了大量废水,而且浪费了原料,提高了生产成本,另外用三氯甲烷萃取,然后用石油醚进行重结晶,过程中使用了两个溶剂,对原料成本有较大的影响,同时溶剂回收也增加了难度,所以不是一个最好的选择,
通过大量实验的优化,本文最终选择了减压回收过量的三氯氧磷,回收得到的三氯氧磷可以直接用于氯化反应,降低了原料成本,减少了大量酸性废水的产生。对于后处理溶剂,选用甲苯作为萃取溶剂,脱色后回收部分溶剂后直接结晶就能得到理想的产品。甲苯的使用减少了操作步骤,降低了原料成本,同时在后处理过程中使用单一溶剂,使溶剂的回收操作也简单易行。
3 结论
以二氨基马来腈和丙酮酸为起始原料,经过环合、酸水解、酯化和氯化反应得到目标产物,总收率54.9%,该路线原料易得,操作简单。并且重点从降低成本、减少三废和节能降耗的角度对整个工艺进行了优化,使该路线在满足工业化条件的同时,能够适应现在日益严格的安全环保要求。
[1]Chen F X,Cutarelli T D,Fu X Y,et al.Process and intermediates for the synthesis of heterocyclic substituted piperazines with CXXR3 antagonist activity:WO,2009079490[P].2009-06-25.
[2]Kiyoshi K,Tatsuya Y,Yoshimasa A,et al.Pyrazolopyridinne derivatives as TTX-S blockers:WO,2014068988[P].2014-05-08.
[3]Tatsuya Y,Kiyoshi K,Mikio M.Amide derivatives as TTX-S blockers and their preparation:WO,2013161308[P].2013-10-31.
[4]Kiyoshi K,Mikio M,Tatsuya Y.Pyrrolopyridinone derivatives as TTX -S blockers and their preparation:WO,2013161312[P].2013-10-31.
[5]Jaung J Y,Matsuoka M,Fukunishi K.Syntheses and properties of new styryl dyes derived from 2,3-dicyano-5-methylpyrazines [J].Dyes and Pigments,1996,31(2):141-153.
[6]Mano M,Seo T,Imai K.Synthesis of 4,5-dihydro-5-oxo-2-pyrazinecarboxylic acid 1-oxides[J].Chemical &Pharmaceutical Bulletin,1980,28(10):3057-3063.
[7]Suto M J,Goldman M E,Gayo L M,et al.Pyrimidine carboxamides and related compounds and methods for treating inflammatory conditions:WO,9709315[P].1997-03-13.
[8]Murthy S N,Madhav B,Nageswar Y V D.Revisiting the hinsberg reaction:facile and expeditious synthesis of 3-substituted quinoxalin-2(1H)-ones under catalyst-free conditions in water[J].Helvetica Chimica Acta,2010,93:1216-1220.
