阿替普酶联合肝素治疗在中国急性缺血性卒中患者中的安全性和有效性
2015-03-10刘静华曹亦宾田月明
刘静华,佟 旭,2,曹亦宾,史 楠,田月明
阿替普酶是唯一获得循证医学支持并被美国食品药品监督管理局批准用于急性缺血性卒中溶栓治疗的药物[1]。目前公认在发病4.5 h 内应用阿替普酶静脉溶栓能实现早期血管再通,迅速恢复脑血流,挽救缺血半暗带,从而降低卒中患者致残率[2]。溶栓结束后,需要继续用抗血小板或抗凝药物以巩固溶栓疗效,否则可能再次形成血栓,造成开通的靶血管再闭塞[3,4]。为了权衡出血风险,美国、欧洲和中国卒中指南一致推荐抗栓治疗应推迟到溶栓24 h 后开始[5~7]。但是,在美国国立神经疾病与卒中研究所(National Institute of Neurological Disorders and Stroke,NINDS)的溶栓研究事后分析发现14%的患者在早期临床症状改善后再次恶化而并未发生颅内出血,这种情况可能提示血管早期再闭塞,并且高达70%的再闭塞发生在24 h 内,症状性血管再闭塞的发生率要远高于症状性颅内出血[8,9]。因此,在溶栓后尽早给予抗栓治疗以预防血管早期再闭塞,可能有助于提高溶栓疗效。
本研究是一项单中心、前瞻性登记的回顾性分析,旨在探讨阿替普酶联合肝素治疗中国急性缺血性卒中患者的安全性和有效性。
1 材料与方法
1.1 研究对象 2006 年1 月-2015 年5 月,我们在河北医科大学附属唐山工人医院神经内科前瞻性连续登记发病在4.5 h 内接受阿替普酶(商品名:爱通立,生产厂家:德国勃林格殷格翰,规格:50 mg/支)静脉溶栓的急性缺血性卒中患者225 例。所有患者在溶栓前完成美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分、实验室化验(包括:血常规、凝血系列、血糖、电解质、肾功能)以及头部影像[计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)]检查排除颅内出血,且无其他溶栓禁忌证。在溶栓后24 h 内复查头部CT,7 d 内复查头部CT 或MRI 并随访NIHSS 评分,溶栓后90 d 随访改良Rankin 量表(modified Rankin Scale,mRS)评分。我们排除了5 例90 d 失访和27 例溶栓后未给予抗栓治疗的患者(原因包括:在溶栓过程中或溶栓后首次复查头部CT 发现颅内出血10 例,消化道出血6 例,脑疝转外科手术5 例,死亡3 例,严重肉眼血尿1 例,皮下血肿1 例,放弃治疗自动出院1 例),最终纳入本研究的患者共计193 例。
根据溶栓后是否桥接肝素治疗将患者分为肝素抗凝组和标准抗栓组,其中肝素抗凝组119 例,标准抗栓组74 例。肝素抗凝组在溶栓结束后立即给予肝素钠持续静脉泵入,调整剂量(500~1000 U/h)使活化部分凝血活酶时间(activated partial thromboplastin time,APTT)为基线值的1.5~2.5 倍,3 d后改为阿司匹林和(或)氯吡格雷口服和(或)低分子肝素皮下注射;标准抗栓组患者在溶栓24 h 后给予阿司匹林和(或)氯吡格雷口服和(或)低分子肝素皮下注射。7 d 内复查头部CT 或MRI,一旦发现颅内出血立即停用所有抗凝和抗血小板药物。两组患者的其余治疗基本相同(包括:抗血小板聚集、他汀强化降脂、改善脑供血、营养脑细胞等)。
本研究的临床评估人员均经过NIHSS 和mRS 评分专业培训。本研究经河北医科大学附属唐山工人医院伦理委员会批准,且溶栓和抗凝前经本人或其家属签署知情同意书。
1.2 研究方法
1.2.1 人口统计学和基线资料采集 患者的年龄、性别、既往史(包括:高血压、糖尿病、缺血性心脏病、心房颤动、高脂血症、既往卒中史、病前mRS 评分、吸烟、饮酒)、发病到溶栓时间、NIHSS 评分、血压、实验室化验[包括:血糖、白细胞、血小板、国际标准化比值(international normalized ratio,INR)、纤维蛋白原]、阿替普酶溶栓剂量[分为标准剂量(0.9 mg/kg,最大量90 mg)和小剂量(0.5~0.8 mg/kg,最大量50 mg)]、责任梗死部位(分为前循环梗死和后循环梗死)[10]、缺血性卒中分型(包括:大动脉粥样硬化性卒中、小动脉闭塞性卒中、心源性脑栓塞、其他明确原因的卒中、病因不明性卒中)[11]。
1.2.2 安全性和有效性结局评价 安全性结局评价指标为溶栓后脑出血(intracranial hemorrhage,ICH)、症状性脑出血(symptomatic intracranial hemorrhage,SICH)及90 d 患者死亡情况。ICH 是指溶栓后7 d 内头部CT 或MRI 显示的任何类型的出血,无论是否引起NIHSS 评分增加。SICH 采用欧洲急性卒中协作研究Ⅱ(European Cooperative Acute Stroke Study Ⅱ,ECASS Ⅱ)的定义[12],是指溶栓后7 d 内头部影像提示脑出血,且伴有NIHSS 评分较基线NIHSS 评分或基线至溶栓后7 d 内的最低NIHSS 评分增加4 分或以上,或出血导致患者死亡。
有效性结局评价指标为早期神经功能改善(early neurological improvement,ENI)和90 d 的mRS 评分。ENI 定义为溶栓后24 h 内NIHSS 评分较基线值减少4 分或以上[1],它是反映溶栓后血管开通的一个临床替代指标[13]。90 d 预后良好定义为mRS ≤1 分;90 d 生活自理定义为mRS ≤2分[14]。
1.2.3 统计学分析 符合正态分布的计量资料比较采用两个独立样本的t 检验,不符合正态分布的计量资料比较采用两个独立样本的Mann-Whitney U 检验,计数资料比较采用Pearson 卡方检验。安全性和有效性结局比较的优势比(odds ratio,OR)及其95%可信区间(confidence interval,CI)和校正的OR 及其95%CI=采用单因素和多因素二分类Logistic 回归分析。年龄、NIHSS 评分、发病到溶栓时间以及基线分析中两组间比较P <0.1 的变量纳入到多因素模型中计算校正的OR。差异有显著性定义为双尾P <0.05,所有统计分析采用SPSS 19.0 统计软件。
2 结果
纳入本研究的发病4.5 h 内接受阿替普酶静脉溶栓的急性缺血性卒中患者共计193 例,男性136 例,女性57 例,年龄31~80 岁,前循环梗死126 例,后循环梗死67 例,NIHSS 评分2~38 分,发病到溶栓时间≤3 h 有63 例,>3 h 有130 例。其中,肝素抗凝组有119 例,标准抗栓组有74 例。
2.1 两组间的人口统计学和基线资料比较 肝素抗凝组中后循环梗死的比例高于标准抗栓组(43.7% vs 20.3%;P=0.001);而心源性脑栓塞的比例低于标准抗栓组(10.1%vs 21.6%;P=0.027)。其余各项变量两组间比较无统计学差异(P >0.05)(见表1)。
2.2 两组间的安全性结局比较 肝素抗凝组ICH 和SICH 发生率分别为24.4%(29 例)和5.9%(7 例),90 d 死亡率为8.4%(10 例);标准抗栓组ICH 和SICH 发生率分别为23.0%(17 例)和2.7%(2 例),90 d 死亡率为5.4%(4例)。单因素二分类Logistic 分析显示两组间ICH(OR=1.080,95%CI=0.545-2.142)、SICH(OR=2.250,95%CI=0.455-11.134)、90 d 死亡(OR=1.606,95% CI=0.485-5.319)的发生率均无显著性差异(P >0.05)。在校正了年龄、NIHSS 评分、发病到溶栓时间、责任梗死部位、缺血性卒中分型后,多因素二分类Logistic 分析显示两组间ICH(OR=1.188,95%CI=0.574-2.459)、SICH(OR=1.883,95%CI=0.343-10.332)、90 d 死亡(OR=0.911,95% CI=0.240-3.460)的发生率仍无显著性差异(P >0.05)(见表2)。
2.3 两组间的有效性结局比较 肝素抗凝组ENI 比例为53.8%(64 例),90 d 预后良好和生活自理比例分别为43.7%(52 例)和55.5%(66 例);标准抗栓组ENI 比例为31.1%(23 例),90 d 预后良好和生活自理比例分别为28.4%(21 例)和40.5%(30 例)。
单因素二分类Logistic 分析显示肝素抗凝组ENI(OR=2.580,95%CI=1.402-4.749)、90 d 预后良好(OR=1.959,95%CI=1.052-3.648)和生活自理(OR=1.826,95%CI=1.014-3.289)的比例显著高于标准抗栓组(P <0.05)。在校正了年龄、NIHSS 评分、发病到溶栓时间、责任梗死部位、缺血性卒中分型后,多因素二分类Logistic 分析显示肝素抗凝组ENI(OR=2.404,95%CI=1.265-4.568)、90 d 预后良好(OR=2.002,95% CI=1.025-3.910)和生活自理(OR=1.988,95%CI=1.046-3.779)的比例仍显著高于标准抗栓组(P <0.05)(见表2)。
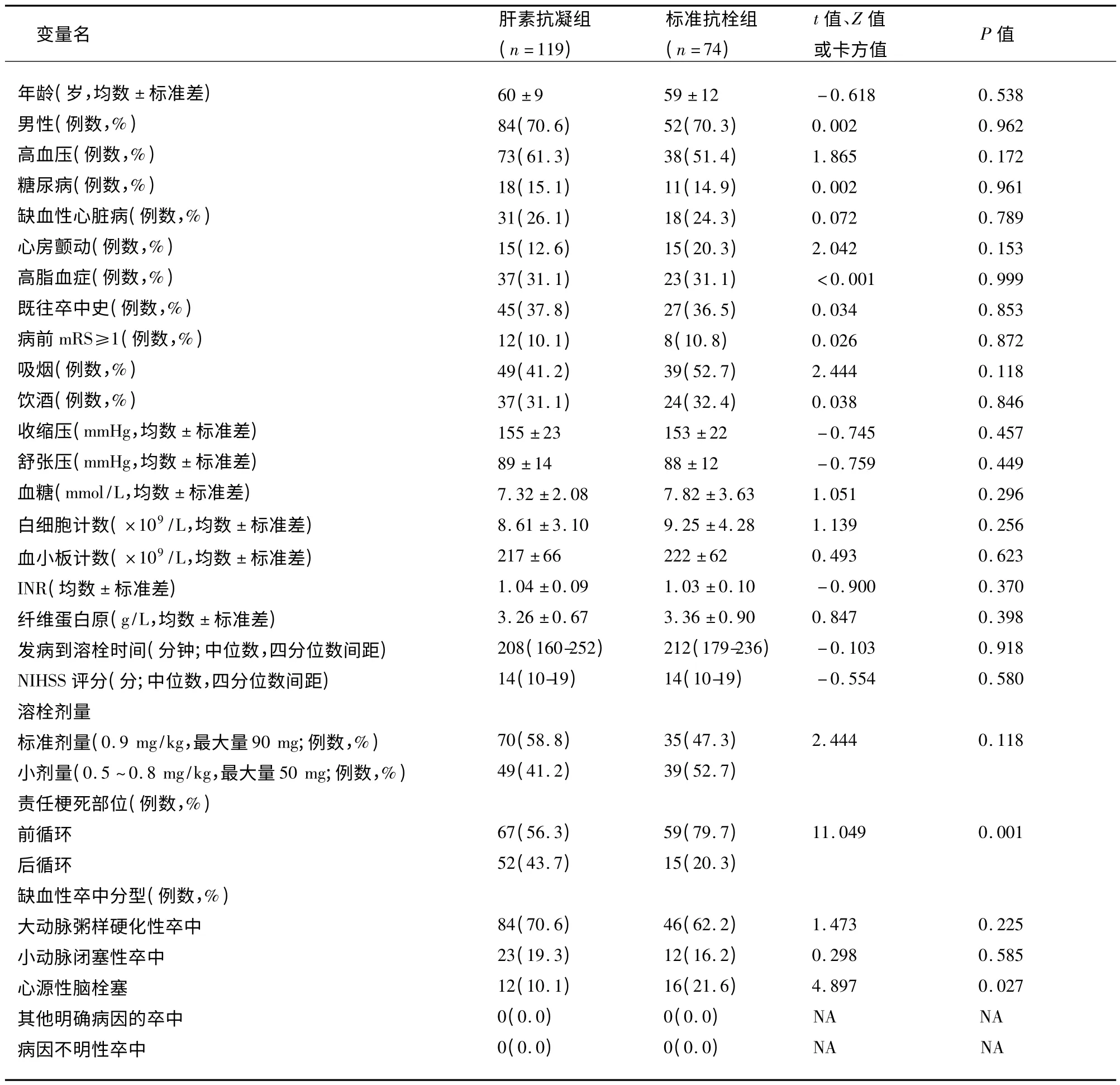
表1 肝素抗凝组与标准抗栓组人口统计学和基线资料

表2 肝素抗凝组与标准抗栓组安全性和有效性转归
3 讨论
靶血管早期再闭塞是静脉溶栓后导致临床症状恶化和预后不良的主要原因。Alexandrov 应用经颅多普勒超声检查发现静脉溶栓后约1/3 的患者发生血管再闭塞[3],考虑原因可能是阿替普酶的半衰期较短,有效时间短,溶栓后破碎栓子、斑块随血流移位栓塞远端的血管,血栓溶解后凝血系统被激活,凝血酶含量增高继发局部血栓再形成[15]。因此,溶栓后以快速起效的静脉给药方式及时应用抗血小板或抗凝药物来巩固溶栓效果,这很有必要。但是,目前国内外关于静脉溶栓桥接肝素抗凝的疗效和安全性研究数量很少,并且设计上存在诸多缺陷:样本量小[16~18],单臂研究未设对照组[16,17],对照研究未校正基线差异[19],基线资料不全或统计学方法不恰当[20]。所以,这些研究结果的可靠性大打折扣。
本研究是一项单中心、前瞻性登记的回顾性分析,旨在探讨静脉溶栓桥接肝素抗凝能否安全地增加阿替普酶治疗急性缺血性卒中的疗效。我们研究发现:与目前指南规定的溶栓24 h 后启动抗栓治疗相比,溶栓后立即启动肝素抗凝治疗中国急性缺血性卒中患者具有更好的有效性,并且不增加颅内出血和死亡风险。然而,本研究也存在一些局限性。首先,这是一个来自单中心的经验,还需要其他数据库资料的确认。其次,这是一项回顾性研究,尽管校正了一些混杂因素,但研究对象的选择偏移、回忆偏移均可能对研究结果产生影响,因此需要进行更深入的前瞻性、随机、对照研究可能更能阐明目前的问题。再次,本研究的样本量相对较少,在大规模人群研究中是否具有一致的结论,需要继续扩大样本量或者进行荟萃分析来证实。
总之,本研究提示阿替普酶联合肝素治疗中国急性缺血性卒中患者的疗效更优且安全,是一种优化的治疗方案。
[1]Tissue plasminogen activator for acute ischemic stroke.The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group[J].N Engl J Med,1995,333(24):1581-1587.
[2]Hacke W,Kaste M,Bluhmki E,et al.Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke[J].N Engl J Med,2008,359(13):1317-1329.
[3]Alexandrov AV,Grotta JC.Arterial reocclusion in stroke patients treated with intravenous tissue plasminogen activator[J].Neurology,2002,59(6):862-867.
[4]Heo JH,Lee KY,Kim SH,et al.Immediate reocclusion following a successful thrombolysis in acute stroke:a pilot study[J].Neurology,2003,60(10):1684-1687.
[5]Jauch EC,Saver JL,Adams HP,et al.Guidelines for the early management of patients with acute ischemic stroke:a guideline for healthcare professionals from the American Heart Association/AmericanStroke Association[J].Stroke,2013,44(3):870-947.
[6]Guidelines for management of ischaemic stroke and transient ischaemic attack 2008[J].Cerebrovasc Dis,2008,25(5):457-507.
[7]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[8]Tissue plasminogen activator for acute ischemic stroke.The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group[J].N Engl J Med,1995,333(24):1581-1587.
[9]Grotta JC,Welch KM,Fagan SC,et al.Clinical deterioration following improvement in the NINDS rt-PA stroke trial[J].Stroke,2001,32(3):661-668.
[10]Sarikaya H,Arnold M,Engelter ST,et al.Outcomes of intravenous thrombolysis in posterior versus anterior circulation stroke[J].Stroke,2011,42(9):2498-502.
[11]Adams HP,Bendixen BH,Kappelle LJ,et al.Classification of subtype of acute ischemic stroke.Definitions for use in a multicenter clinical trial.TOAST.Trial of Org 10172 in Acute Stroke Treatment[J].Stroke,1993,24(1):35-41.
[12]Hacke W,Kaste M,Fieschi C,et al.Randomised double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke(ECASS II).Second European-Australasian Acute Stroke Study Investigators[J].Lancet,1998,352(9136):1245-1251.
[13]Kharitonova T,Mikulik R,Roine RO,et al.Association of early National Institutes of Health Stroke Scale improvement with vessel recanalization and functional outcome after intravenous thrombolysis in ischemic stroke[J].Stroke,2011,42(6):1638-1643.
[14]Wahlgren N,Ahmed N,Davalos A,et al.Thrombolysis with alteplase 3-4.5 h after acute ischaemic stroke(SITS-ISTR):an observational study[J].Lancet,2008,372(9646):1303-1309.
[15]乔潜林,周 石,王学建,等.急性脑梗死动脉内溶栓治疗致靶血管早期再闭塞的若干问题探讨[J].中国介入影像与治疗学,2006,5:364-367.
[16]阚凤杰,曹亦宾.急性脑梗死超早期静脉溶栓后24h 内应用肝素抗凝治疗的临床研究[J].中国综合临床,2006,(2):122-123.
[17]von KR,Hacke W.Safety and efficacy of intravenous tissue plasminogen activator and heparin in acute middle cerebral artery stroke[J].Stroke,1992,23(5):646-652.
[18]Gill R,Donahey E,Ruland S.Early administration of therapeutic anticoagulation following intravenous thrombolysis for acute cardiogenic embolic stroke caused by left ventricular thrombus:case report and topic review[J].Front Neurol,2015,6:9.
[19]吕宪民,曹亦宾,李 欣,等.阿替普酶溶栓后抗凝治疗对急性脑梗死患者的疗效及安全性[J].中国全科医学,2011,8:834-836.
[20]周 鹏.阿替普酶溶栓后抗凝治疗对急性脑梗死患者的疗效及安全性研究[J].中国现代医生,2011,(31):42-44.
