Alpha B-crystallin蛋白Ser磷酸化在肝细胞肝癌中的意义
2015-03-10黄晓勇柯爱武施国明周俭
黄晓勇 柯爱武 施国明 周俭
(复旦大学附属中山医院肝外科, 上海 200032)
·论著·
Alpha B-crystallin蛋白Ser磷酸化在肝细胞肝癌中的意义
黄晓勇柯爱武施国明周俭
(复旦大学附属中山医院肝外科, 上海200032)
摘要目的:探讨alpha B-crystallin蛋白Ser59磷酸化在肝细胞肝癌(肝癌)组织中的意义。方法: 采用免疫组织化学染色法检测403例肝癌组织中磷酸化的alpha B-crystallin(Ser59)的表达水平,分析其与肝癌临床病理特征及预后的关系。结果: 磷酸化alpha B-crystallin的表达水平与肿瘤直径、肿瘤包膜、大血管侵犯及肿瘤组织分化有关(P<0.05、0.01),而与肝癌患者年龄、性别、乙肝表面抗原、肝硬化等无关(P>0.05)。多因素分析结果显示,磷酸化alpha B-crystallin的表达水平是肝癌的独立预后因素。结论: 磷酸化alpha B-crystallin(Ser59)的表达水平与肝癌的恶性表型及不良预后相关。
关键词磷酸化alpha B-crystallin;肝细胞肝癌;预后
Significance of Phosphorylated Alpha B-Crystallin (Ser59)in Hepatocellular Carcinoma TissuesHUANGXiaoyongKEAiwuSHIGuomingZHOUJianDepartmentofLiverSurgery,ZhongshanHospital,FudanUniversity,Shanghai200032,China
AbstractObjective: To investigate the expression of phosphorylated alpha B-crystallin in hepatocellular carcinoma(HCC) tissues and its significance. Methods: The expression level of phosphorylated alpha B-crystallin in HCC tissues from 403 cases was detected by immunohistochemical staining, and its correlation with HCC clinicopathologic features and prognosis was analyzed. Results: The expression level of phosphorylate alpha B-crystallin (Ser59) was correlated with tumor size, tumor encapsulation, vascular invasion and tissue differentiation(P<0.05 or 0.01). However, it was not correlated with age, gender, HBsAg, liver cirrhosis. Multivariate analysis showed that the expression level of phosphorylated alpha B-crystallin (Ser59) was an independent factor for prognosis. Conclusions: The expression level of phosphorylated alpha B-crystallin (Ser59) is correlated with the malignant phenotype and poor prognosis of HCC.
Key WordsPhosphorylated alpha B-crystallin;Hepatocellular carcinoma;Prognosis
肝细胞肝癌(简称肝癌)是国内常见的恶性肿瘤之一,肝癌侵袭转移与复发是患者病死的主要原因之一[1]。因此,探索肝癌侵袭转移与复发的发生机制,并寻求抗肝癌转移与复发的有效措施,对改善肝癌患者的预后具有重要意义。在人类中,10种不同的小热休克蛋白(small heat shock proteins,sHSPs)已被特征化,其中HSP27、HSP22和alpha B-crystallin等在细胞应对压力刺激时表达增加。在乳腺癌、卵巢癌、骨肉瘤、子宫内膜癌和白血病患者中,sHSPs表达水平升高[2]。alpha B-crystallin基因定位于人染色体11q22.3-23.11,长度为528 bp。alpha B-crystallin能够保护细胞,抑制凋亡,并且在多种肿瘤中高表达[3]。近年来,alpha B-crystallin的磷酸化受到重视,其可能参与不依赖Ras的Raf及下游信号激活。alpha B-crystallin可在丝氨酸19、45、59位点发生磷酸化,而起主要功效的磷酸化位点为丝氨酸59(Ser59)[4]。前期研究[5]结果表明,alpha B-crystallin能促进肝癌细胞侵袭及转移,但尚无研究探讨磷酸化alpha B-crystallin与肝癌的关系。本研究拟检测磷酸化alpha B-crystallin(Ser59)在肝癌组织中的水平,明确其与肝癌临床病理特征及预后的相关性。
1资料与方法
1.1一般资料选择2000年1月—2002年9月在复旦大学附属中山医院肝外科行肝癌切除术的403例肝癌患者的癌组织石蜡标本。将403例肝癌组织制成组织芯片(由上海芯超生物科技有限公司提供技术支持)。肝癌的诊断标准按照世界卫生组织标准,肿瘤的分化按照Edmondson分级标准;所有病例均有完整随访资料。随访截至2007年3月,患者无瘤生存期为从手术日期到复发转移或随访截止日期;总生存时间为从手术时间至随访截止时间。本研究经复旦大学附属中山医院伦理委员会批准,且均获得患者知情同意。
1.2试剂兔抗人磷酸化alpha B-crystallin(Ser59)多克隆抗体(美国Novus公司);SP试剂盒(上海长岛生物技术有限公司);二氨基联苯胺(3,3′-diaminobenzidine,DAB)试剂(上海长岛生物技术有限公司);二甲苯、3%过氧化氢、无水乙醇、1%盐酸乙醇(上海元象医疗器械有限公司);苏木精液、水溶性封片剂(丹麦Dako公司)。
1.3免疫组织化学染色制备组织芯片,切片在80 ℃烤箱放置2 h;组织芯片经二甲苯脱蜡,梯度乙醇水化,磷酸盐缓冲液(phosphate buffer saline,PBS)浸洗;将芯片置入pH 6.0的柠檬酸溶液中,放入高压锅中煮沸,待其沸腾后盖加压阀,开锅2 min后停止加热,冷却至室温,取出芯片,用PBS溶液浸洗;将芯片置入3%过氧化氢溶液中,室温孵育10 min,消除内源性过氧化物酶活性,取出后用PBS溶液浸洗;将芯片用牛血清白蛋白封闭,室温下放置30 min;甩去血清,向芯片滴加一抗[抗磷酸化alpha B-crystallin(1∶200)],4 ℃冰箱孵育过夜;PBS浸洗,向芯片滴加二抗,室温孵育30 min,PBS浸洗;向芯片滴加链霉素抗生物素-过氧化物酶溶液,室温下孵育10 min,PBS浸洗;滴加新鲜配制的DAB显色液,显微镜下控制显色时间,自来水浸洗中止显色,苏木精复染30 s,水洗返蓝20 min;梯度乙醇脱水,二甲苯透明,中性树胶封片。磷酸化alpha B-crystallin(Ser59)的判定以细胞质中出现棕黄色颗粒为阳性,采用Image-Pro Plus图像分析软件判断磷酸化alpha B-crystallin的表达水平。
1.4统计学处理采用SPSS 16.0统计软件进行分析,组间差异比较采用t检验或方差检验。绘制Kaplan-Meier累积复发曲线和总生存曲线,无瘤生存时间和总生存时间差异的检验采用Log-rank法,采用Cox回归模型进行多因素分析。以P<0.05为差异有统计学意义。
2结果
2.1磷酸化alpha B-crystallin表达水平与肝癌临床病理特征的关系磷酸化alpha B-crystallin阳性染色主要定位于肝癌细胞胞质,见图1。403例肝癌组织中,磷酸化alpha B-crystallin高表达241例,占59.8%。磷酸化alpha B-crystallin表达水平与肝癌患者肿瘤直径、肿瘤包膜、大血管侵犯、肿瘤组织分化有关(P<0.05、0.01);而与年龄、性别、乙肝表面抗原、肝硬化等无关(P>0.05)。见表1。
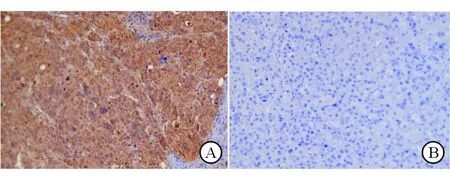
A:高表达;B:低表达
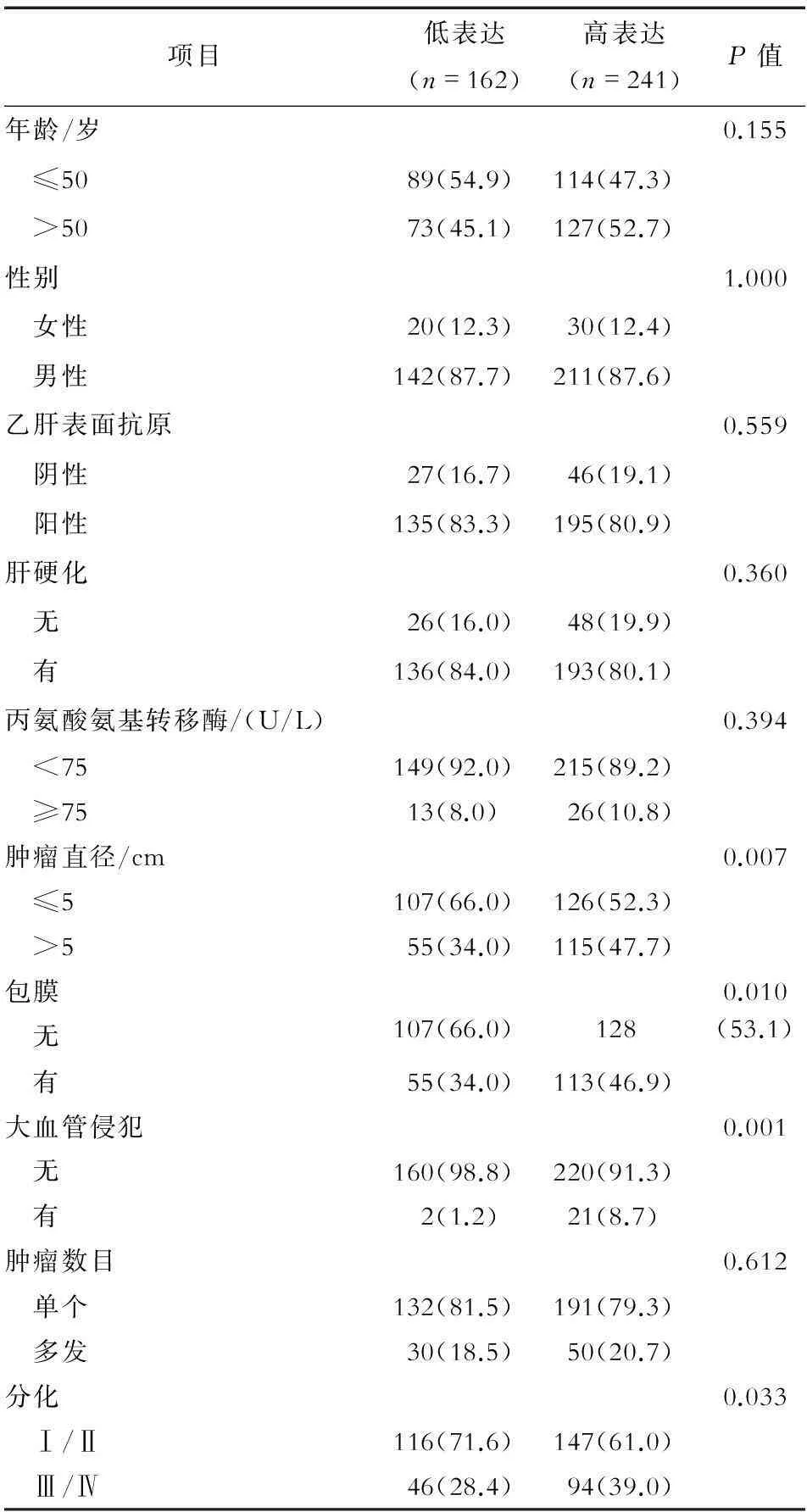
项目低表达(n=162)高表达(n=241)P值年龄/岁0.155 ≤5089(54.9)114(47.3) >5073(45.1)127(52.7)性别1.000 女性20(12.3)30(12.4) 男性142(87.7)211(87.6)乙肝表面抗原0.559 阴性27(16.7)46(19.1) 阳性135(83.3)195(80.9)肝硬化0.360 无26(16.0)48(19.9) 有136(84.0)193(80.1)丙氨酸氨基转移酶/(U/L)0.394 <75149(92.0)215(89.2) ≥7513(8.0)26(10.8)肿瘤直径/cm0.007 ≤5107(66.0)126(52.3) >555(34.0)115(47.7)包膜0.010 无107(66.0)128(53.1) 有55(34.0)113(46.9)大血管侵犯0.001 无160(98.8)220(91.3) 有2(1.2)21(8.7)肿瘤数目0.612 单个132(81.5)191(79.3) 多发30(18.5)50(20.7)分化0.033 Ⅰ/Ⅱ116(71.6)147(61.0) Ⅲ/Ⅳ46(28.4)94(39.0)
2.2磷酸化alpha B-crystallin表达水平与肝癌患者预后的关系403例肝癌患者术后1、3、5年无瘤生存率与总生存率分别为77%、51%、38%和89%、67%、50%。磷酸化alpha B-crystallin高表达组与低表达组术后1、3、5年总生存率分别为83.8%、54.8%、41.7%和95.7%、84.0%、68.3%;两组术后1、3、5年无瘤生存率分别为79.8%、52.9%、44.6%和90.0%、74.3%、50.5%,见图2。

图2 Kaplan-Meier曲线分析磷酸化alpha B-crystallin(Ser59)表达水平与肝癌患者预后的关系
注:P-Cryablow:磷酸化alpha B-crystallin低表达组;P-Cryabhigh:磷酸化alpha B-crystallin高表达组
单因素分析结果表明,影响肝癌患者总生存时间的因素有肝硬化、肿瘤包膜、肿瘤直径、肿瘤数目、大血管侵犯、磷酸化alpha B-crystallin表达水平;而影响无瘤生存期的因素有肝硬化、大血管侵犯、肿瘤数目、磷酸化alpha B-crystallin表达水平。见表2。
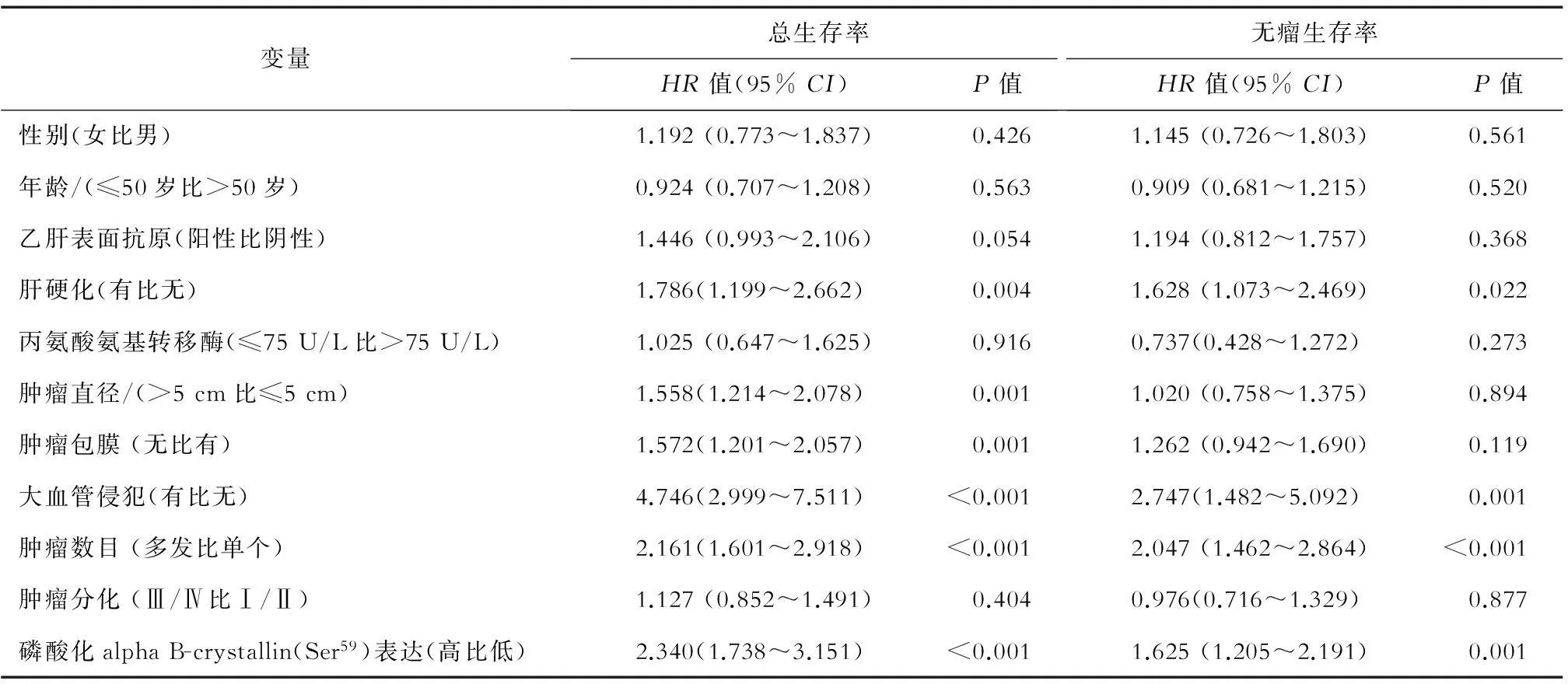
表2 肝癌患者总生存时间及无瘤生存期的单因素分析
注:HR:风险比;95%CI:95%可信区间
2.3Cox回归模型多因素分析根据单因素分析结果,将肝硬化、肿瘤包膜、肿瘤直径、肿瘤数目、大血管侵犯、磷酸化alpha B-crystallin表达水平引入Cox回归模型进行多因素分析,应用后退法逐步筛选因子,结果显示肝硬化、肿瘤直径>5 cm、多发性肝癌、大血管侵犯、磷酸化alpha B-crystallin高表达是影响总生存时间的独立预后因素;肝硬化、大血管侵犯、多发性肝癌、磷酸化alpha B-crystallin高表达是影响无瘤生存期的独立预后因素,见表3。
3讨论
alpha B-crystallin作为sHSPs家族的一员,与多种肿瘤的侵袭与转移相关。本研究对用403例肝癌标本制作的肝癌组织芯片中磷酸化alpha B-crystallin(Ser59)表达水平与肝癌预后的相关性进行研究。结果显示,高表达磷酸化alpha B-crystallin(Ser59)的肝癌患者预后比低表达组差。磷酸化alpha B-crystallin(Ser59)的表达水平与肿瘤直径、肿瘤无包膜、大血管侵犯、肿瘤组织分化相关,以上结果表明磷酸化alpha B-crystallin(Ser59)与肝癌侵袭与转移相关。

表3 影响肝癌患者总生存时间及无瘤生存期的多因素分析
注:HR:风险比;95%CI:95%可信区间
在多种恶性肿瘤中,sHSPs的表达与肿瘤的分期相关。alpha B-crystallin在神经胶质肿瘤(如星形细胞瘤、胶质母细胞瘤、少突神经胶质瘤)和乳腺癌中高表达[6]。sHSPs在肿瘤中高表达的机制还不清楚,可能与肿瘤细胞缺氧或营养压力造成的细胞不良环境有关,或者与致癌性突变通过引起更多的分子伴侣的激活来去除不正常聚集蛋白变异有关。此外,转录因子的突变引起更多sHSPs的激活和假低氧状态,这也可能导致sHSPs在肿瘤中的表达增加[7-8]。
不管机体处于应激状态还是正常生理状态,alpha B-crystallin均参与复杂和重要的生物学过程[2],如alpha B-crystallin可以作为分子伴侣阻止蛋白间不必要的相互作用、帮助变性蛋白重新折叠、诱导生物体耐热性、稳定细胞骨架、参与细胞的损伤与修复,在生物体的生长、发育、进化以及维持机体的生理状态和某些疾病的病理生理过程中均发挥重要作用。sHSPs通过与细胞内各组分(蛋白质、细胞核、细胞骨架元件、膜)相互作用来维持细胞的稳定。磷酸化alpha B-crystallin是alpha B-crystallin的活化结构。据报道,alpha B-crystallin可通过磷酸化的Ser59结合Bcl-2进而起到抗肿瘤细胞凋亡的作用[9]。本研究结果表明磷酸化alpha B-crystallin(Ser59)可作为肝癌的独立预后因素,提示alpha B-crystallin 磷酸化参与肝癌的侵袭及转移过程。
参考文献
[ 1 ]Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2): 87-108.
[ 2 ]Liberek K, Lewandowska A, Zietkiewicz S. Chaperones in control of protein disaggregation[J]. EMBO J, 2008, 27(2): 328-335.
[ 3 ]Launay N,Goudeau B,Kato K,et al.Cell signaling pathways to alphaB-crystallin following stresses of the cytoskeleton[J].Exp Cell Res, 2006,312(18):3570-3584.
[ 4 ]Morrison LE,Hoover HE,Thuerauf DJ,et al.Mimicking phosphorylation of alphaB-crystallin on serine-59 is necessary and sufficient to provide maximal protection of cardiac myocytes from apoptosis[J].Circ Res, 2003,92(2):203-211.
[ 5 ]Huang XY,Ke AW,Shi GM,et al.α B-crystallin complexes with 14-3-3ζ to induce epithelial-mesenchymal transition and resistance to sorafenib in hepatocellular carcinoma[J].Hepatology,2013,57(6):2235-2247.
[ 6 ]Moyano JV,Evans JR,Chen F,et al.Alpha B-crystallin is a novel oncoprotein that predicts poor clinical outcome in breast cancer[J].J Clin Invest, 2006,116(1):261-270.
[ 7 ]Arrigo AP,Simon S,Gibert B,et al.Hsp27(HspB1) and alpha B-crystallin (HspB5) as therapeutic targets[J].FEBS Lett,2007,581(19):3665-3674.
[ 8 ]Sadamitsu C,Nagano T,Fukumaki Y,et al.Heat shock factor 2 is involved in the upregulation of alphaB-crystallin by high extracellular potassium[J].J Biochem, 2001,129(5):813-820.
[ 9 ]Launay N,Tarze A,Vicart P,et al.Serine 59 phosphorylation of {alpha}B-crystallin down-regulates its anti-apoptotic function by binding and sequestering Bcl-2 in breast cancer cells[J].J Biol Chem, 2010,285(48):37324-37332.
中图分类号R735.7
文献标识码
基金项目:国家自然科学基金项目(编号:81272295)
