绿原酸对Fas/FasL 途径介导的非酒精性脂肪肝细胞凋亡的影响
2015-03-09刘云龙彭冰洁许诗豪
刘云龙,宋 卓,彭冰洁,许诗豪,朱 琪,王 征
(湖南农业大学生物科学技术学院,长沙 410128)
研究显示,肝细胞凋亡在非酒精性脂肪肝形成和发展中起着十分关键的作用[1,2]。Fas/FasL 途径是机体行使正常生理功能不可或缺的一部分,正常情况下FasL表达量很低,但当处于病理状态下时,FasL 表达量升高,通过Fas/FasL 途径调控细胞凋亡。Fas/FasL 途径在肝脏疾病发生、肿瘤的控制以及免疫系统的维持等方面均扮演着重要的角色[3,4]。绿原酸具有调节血糖浓度与脂代谢,治疗胰岛素抵抗以及清除过氧自由基等功能,但对于绿原酸是否具有抗细胞凋亡作用以及对肝细胞是否具有保护作用的研究报道较少[5,6]。本文通过给予大鼠长期饲喂高脂饲料的方法建立非酒精性脂肪肝的凋亡模型,经绿原酸干预,研究绿原酸对肝细胞凋亡的影响。
1 材料与方法
1.1 实验材料
体重210~230g SPF 级的雄性Sprague-Dawley (SD)大鼠40 只,湖南斯莱克景达实验动物有限公司;绿原酸,成都普瑞法科技开发有限公司;Trizol,美国Invirtrogen 公司;反转录试剂盒,天根生化科技有限公司;PCR mix,天根生化科技有限公司;TC 试剂盒,深圳迈瑞生物医疗电子股份有限公司;TG 试剂盒,深圳迈瑞生物医疗电子股份有限公司;HDL-C,深圳迈瑞生物医疗电子股份有限公司;LDL-C 测定试剂盒,深圳迈瑞生物医疗电子股份有限公司。饲料:普通饲料见表1,总能量为3 520kcal/kg;高脂饲料见表2,总能量为4 976.51kcal/kg,均由湖南斯莱克景达实验动物有限公司生产。
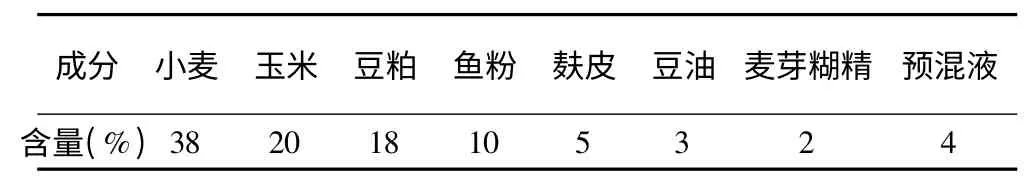
表1 普通饲料配方

表2 高脂饲料配方
1.2 实验方法
1.2.1 分组和建模 SD 大鼠7d 适应期喂养后,将其随机分成4 组:空白对照组(NC 组)、模型组(HFD组)、低剂量绿原酸防治组(HFD-LC 组)和高剂量绿原酸防治组(HFD-HC 组)。NC 组饲喂普通饲料,其余各组饲喂高脂饲料,自由饮水摄食。其中,依据个体的体重,HFD-LC 和HFD-HC 组分别按照绿原酸20、90mg/(kg·d)剂量进行灌胃;NC 组和HFD 组则每天灌胃等体积超纯水。每天09:30 定时测定大鼠体重,12w后处死,测量各项生理生化指标。
1.2.2 血清中TG、TC、LDL-C 和HDL-C 含量的测定采用眼球取血法,取血后将血液静置2 h,2 000 r/min,离心15 min,分离得到血清,按照试剂盒说明书依次检测各项数据。
1.2.3 RT-PCR 检测肝脏凋亡相关因子mRNA 表达量
TRIZOL 法提取肝脏组织RNA,用微量光度计检测纯度和含量;取1g RNA,按照试剂盒步骤反转成cDNA(体积20L);以cDNA 做为模板进行PCR 扩增。采用Primer Premier 5.0 设计引物,GAPDH 作为管家基因。PCR 反应体系:cDNA 1 μL,上下游引物各1 μL,Mix 12.5 μL,ddH2O 9.5 μL,总计25 μL。反应条件如下:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,扩增29 个循环;最后再在72 ℃保持5 min。PCR 扩增产物用1 % 琼脂糖凝胶电泳30~40 min,使用凝胶自动成像系统扫描拍照,并用Quantity One 进行相对表达率的半定量分析。
1.2.4 肝脏切片HE 染色 取大鼠肝组织,用10 %甲醛溶液固定24h,常规石蜡包埋,切成3~5 μm 的厚切片,脱蜡,先后用苏木精和伊红染色,脱水,透明,封片,电镜下观察肝脏细胞形态学变化。
1.2.5 数据分析 应用SPSS 17.0 软件进行统计学分析,组间差异比较采用单因素方差分析,所有数据均以±s表示,P<0.05 时,认为具有显著性差异;P<0.01 时,认为具有极显著性差异。
2 结果与分析
2.1 绿原酸对大鼠体重的影响
由表3 可知,饲喂12w 后,相比于HFD 组,HFD-HC组大鼠体重及体重增加量显著降低,其他均无显著差异。

表3 绿原酸对大鼠体重的影响 单位:g
2.2 绿原酸对大鼠肝湿重和肝指数的影响
由表4 可见,相比于NC 组,HFD 组大鼠肝湿重和肝指数极显著增加(P<0.01);相比于HFD 组,HFDLC 组和HFD-HC 组的肝湿重显著降低(P<0.05)。
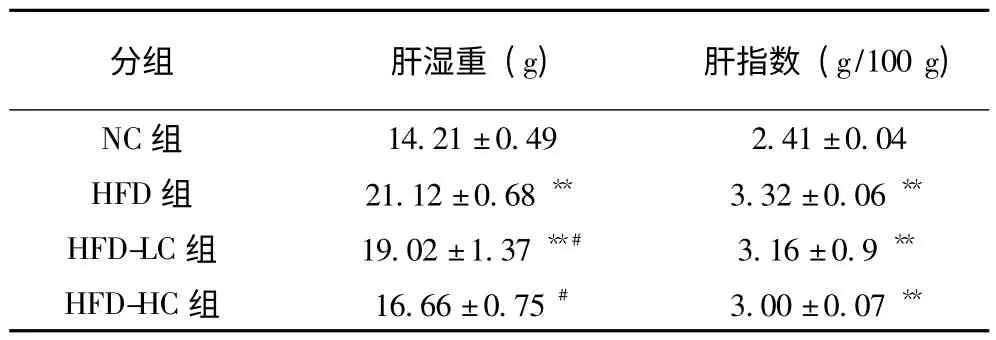
表4 绿原酸对大鼠肝湿量和肝指数的影响
2.3 绿原酸对大鼠血清中TC、TG 、HDL-C、LDL-C、HDL-C/LDL-C 的影响
由表5 可知,与NC 组相比,HFD 组HDL-C 和FFA含量显著增加,TC 和LDL-C 含量极显著增加。与HFD 组相比,HFD-LC 组的TC 和FFA 含量显著下降;HFD-HC组的HDL-C 和FFA 含量显著下降,TC 和LDL-C 含量极显著下降,HDL-C/LDL-C 的值显著升高。

表5 绿原酸干预对大鼠血清中TC、TG、HDL-C、LDL-C、HDL-C/LDL-C 的影响
2.4 绿原酸对肝细胞内Fas、FasL 以及Caspase-8 表达量的影响
由图1 可知,与NC 组相比,HFD 组肝脏组织中Fas 和Fasl 表达量极显著性升高,Caspase-8 表达量显著性升高;与HFD 组相比,HFD-LC 组肝脏组织中Fas、Fasl 和Caspase-8 表达量均有降低,但差异性不显著,HFD-HC 组肝脏组织中Fas 和Fasl 表达量显著性降低,Caspase-8 表达量有所降低,但差异性不显著。
2.5 绿原酸对大鼠肝组织病理形态学变化的影响
由图2 可知,NC 组细胞形态结构正常,各细胞大小一致且排列紧密,细胞之间空隙较少,细胞质分布均匀,无脂肪空泡,胞核清晰明显无破碎现象。与NC 组对比,HFD 组细胞膨胀变大呈圆形(图中箭头所示),细胞核染色加深并碎裂成多个小核,胞质中充满大量的脂肪性空泡等病理症状。与HFD 组相比,HFD-LC 组中空泡数量减少、胞质分布较均匀,细胞核破碎现象减少,病理症状有所改善;HFD-HC 组细胞形态则与NC组相似,胞质中几乎无大型脂肪空泡出现,细胞核结构也更加完整。
3 讨论
对脂肪肝模型的建立,科研人员也常常是通过给动物长期饲喂高脂饲料而实现的[7]。长期的高脂饮食将会导致体重与肝脏重量的增加,血液中TC、TG 以及HDLC/ LDL-C 值的减少。HFD 组中TG 与TC 值的升高说明机体出现高血糖和高血脂症状,HDL-C/ LDL-C 值的减少说明肝脏转运胆固醇能力下降。当摄入脂肪量超过肝脏对脂肪的分解与转运能力之后,将会导致脂肪在肝脏组织的堆积,进而引发脂肪肝。通过绿原酸干预后发现,绿原酸能够有效降低体重与肝重量,调节糖脂代谢,降低血糖与血脂含量,并且升高HDL-C/ LDL-C 的值,这与Meng S 等[8]所发现的绿原酸能够调节体内血糖血脂平衡,促进脂肪代谢等结论一致。
非酒精性脂肪肝的发病与肥胖、高脂血症、糖尿病等有关,其主要表现为肝脏细胞的脂肪变性,肝细胞内出现大量的空泡为主要特征的病理症状[9-10]。以往对非酒精性脂肪肝的研究主要集中在胰岛素抵抗、糖脂代谢紊乱、以及氧化应激等[11-12]。肝细胞凋亡是许多肝病的共同发病机制之一,Feldstein A E 等[13]研究发现,脂肪肝将导致机体肝细胞的凋亡,同时还有研究显示,肝细胞凋亡的程度随着脂肪肝的加剧细胞凋亡数目进一步增多[14]。Fas/FasL 途径介导的信号通路是细胞凋亡通路的主要的途径之一,在此途径中,细胞膜表面存在受体Fas,由于各种理化因素导致配体FasL 表达量上升,当配体FasL 与其相应受体Fas 相结合时将会诱导Fas 胞浆内部分与FADD 接头蛋白形成三聚体,当三聚体形成后,再将凋亡信号传递给Caspase-8 蛋白酶原,Caspase-8 蛋白酶原经过自我催化修饰转变为具有活性的Caspase-8,继而通过级联反应激活下游的其他效应蛋白酶而最终诱导肝细胞凋亡[15-16]。本实验发现,长期高脂饮食将会导致肝细胞FasL、Fas 以及Caspase-8 表达量的上升,继而引发肝细胞凋亡,经绿原酸干预后,FasL、Fas 以及Caspase-8 表达量明显下降,其原因可能为:长期的高脂将会加重肝细胞的氧化分解负担,肝细胞进行氧化分解反应的同时会产生大量的代谢中间产物,特别是一些活性氧和自由基,当这些活性氧与自由基含量超过肝细胞的消除能力时,将会引起肝细胞氧化应激现象,进而激活Fas/FasL 系统,最终导致肝细胞发生凋亡。
4 结论
一定剂量的绿原酸能够调节糖脂代谢,控制机体体重,有效缓解因长期高脂饮食所导致的非酒精性脂肪肝症状。绿原酸还能通过Fas/FasL 系统与Caspase-8 调控肝细胞的增殖与凋亡,表明绿原酸对肝细胞具有一定的调节作用,并且高剂量作用效果更加明显。
[1]范建高.非酒精性脂肪肝的病因和发病机制[J].胃肠病学,2003,8(6):363-365.
[2]Koska J,et al.Increased fat accumulation in liver may link insulin resistance with subcutaneous abdominal adipocyte enlargement,visceral adiposity,and hypoadiponectinemia in obese individuals [J].The American Journal of Clinical Nutrition,2008,87(2):295-302.
[3]Zhao Y,et al.Expressionof Fas/Fasl andthe apoptosis in rat ischemia/reperfusion-induced retinal injury and effectsof bfgf[J].International Journal of Ophthalmology,2008,1(3):226-229.
[4]Kaponis A,Skyrlas A,Zagorianakou N,et al.Coelomic cells show apoptosis via Fas/FasL system:a comparative study between healthy human pregnancies and missed miscarriages [J].Human Reproduction,2008,23(5):1159-1169.
[5]Cho A S,Jeon S M,Kim M J,et al.Chlorogenic acid exhibits anti-obesity property and improves lipid metabolism in high-fat diet-induced-obese mice [J].Food and Chemical Toxicology,2010,48(3):937-943.
[6]Sato Y,et al.In vitro and in vivo antioxidant properties of chlorogenic acid and caffeic acid [J].International Journal of Pharmaceutics,2011,403(1):136-138.
[7]Svegliati-Baroni G,et al.A model of insulin resistance and nonalcoholic steatohepatitis in rats:role of peroxisome proliferator-activated receptor-α and n-3 polyunsaturated fatty acid treatment on liver injury [J].The American Journal of Pathology,2006,169(3):846-860.
[8]Meng S,et al.Roles of chlorogenic acid on regulating glucose and lipids metabolism:a review [J].Evidence-Based Com-plementary and Alternative Medicine,2013.
[9]Marchesini G,et al.Nonalcoholic fatty liver,steatohepatitis,and the metabolic syndrome [J].Hepatology,2003,37(4):917-923.
[10]Diehl A M.Nonalcoholic steatohepatitis [C].Seminars in liver disease by Thieme Medical Publishers,Inc.,1999,19(2):221-229.
[11]Solga S F,Diehl A M.Non-alcoholic fatty liver disease:lumen-liver interactions and possible role for probiotics [J].Journal of Hepatology,2003,38(5):681-687.
[12]Martin HU,et al.Effects of long-term dietary intake of magnesium on oxidative stress,apoptosis and ageing in rat liver[J].Magnesium Research,2008,21(2):124-130.
[13]Feldstein A E,et al.Diet associated hepatic steatosis sensitizes to Fas mediated liver injury in mice [J].Journal of Hepatology,2003,39(6):978-983.
[14]范建高,钟岚.肥胖、高脂血症性脂肪性肝炎细胞凋亡的实验研究[J].中华消化杂志,2000,20(6):421-422.
[15]Zhang L,Kaizuka Y,Hanagata N.Imaging of Fas-FasL membrane microdomains during apoptosis in a reconstituted cell-cell junction [J].Biochemical and Biophysical Research Communications,2012,422(2):298-304.
[16]Li C P,Li J H,He S Y,et al.Roles of Fas/Fasl,Bcl-2/Bax,and Caspase-8 in rat nonalcoholic fatty liver disease pathogenesis [J].Genet Mol Res,2014,13:3991-3999.
