载透明质酸-甲基胶原-三元共聚物/多柔比星复合膜的钽支架的制备及处方优化
2015-03-09梁嘉碧郭新铭中山大学附属第五医院广东珠海519000
李 飞,梁嘉碧,祁 真,郭新铭(中山大学附属第五医院,广东珠海 519000)
植入式缓控释给药系统是缓控释制剂的一个重要组成部分,因其具有使药物生物活性增强及生物利用度提高等特点,应用范围也越来越广,例如用在肿瘤、心血管等方面的治疗[1]。多柔比星(Doxorubicin,Dox)是临床常用的抗肿瘤药物,但因其心脏、肾脏毒性大,限制了其临床应用。现急于寻找一种更有效的制剂,以最大限度提高肿瘤组织内Dox的浓度,最大限度降低心脏和肾脏内Dox的浓度[2]。鉴于上述需求,本研究将Dox做成植入式缓控释系统,在金属钽支架材料表面利用静电自组装反应制备出载透明质酸-甲基胶原-三元共聚物/Dox 复合膜的钽支架,并采用正交设计优化处方,为下一步该缓释系统用于临床植入治疗骨肿瘤奠定基础。
1 材料
1.1 仪器
紫外分光光度计(美国Thermo Scientific公司);JB-3定时恒温磁力搅拌器(上海电磁新径仪器公司);LGJ-25C冷冻干燥机(长沙湘仪仪器公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器公司);NOVA 系列NANNOSEM600 共聚焦扫描电镜(德国FEI 公司);SHC-C 水浴恒温振荡器(江苏环宇仪器公司)。
1.2 药品与试剂
Dox 原料药(深圳万乐药业公司,批号:1203A3,纯度:>98%);Ⅰ型胶原(华南理工大学材料学院提供);透明质酸(美国Lifecore 生物公司);多孔金属钽支架材料(美国Zimmer 公司);甲基丙烯酸羟乙酯、甲基丙烯酸甲酯和甲基丙烯酸单体(广州永屹化工有限公司,批号:1104B8、1204A4、1009A1,纯度:均>98%)。
1.3 其他
透析袋(北京鼎国科技公司)。
2 方法与结果
2.1 成膜材料的制备
2.1.1 甲基胶原的制备 称取适量Ⅰ型胶原加入到20 ml 的0.1 mol/L的盐酸溶液中,溶解制成透明胶原溶液,将胶原溶液加入到400 ml 丙酮中,搅拌,产生沉淀。静置一段时间,将产生的沉淀胶原置于200 ml 含0.1 mol/L 盐酸的甲醇溶液中,在4 ℃无菌条件下搅拌。然后将甲基化后的200 ml 混合溶液装入透析袋中,置于盛有蒸馏水的烧杯中,透析直到蒸馏水的pH为6.3。整个过程温度保持在4 ℃。移除透析袋里的溶液,对甲基胶原溶液冷冻干燥。
2.1.2 三元共聚物的制备 在78 ℃、双偶氮异丁腈的启动下,加入0.1 mol/L 甲基丙烯酸羟乙酯、甲基丙烯酸甲酯和甲基丙烯酸单体在异丙醇中,减压蒸馏,各单体的摩尔比为25 ∶25 ∶50,单体与溶剂比例为1 ∶6(m/V)。在油浴中磁性搅拌,合成甲基丙烯酸羟乙酯-甲基丙烯酸甲酯-甲基丙烯酸的三元共聚物。反应24 h后降至室温,加入过量的石油醚,聚合物即沉淀析出。过滤沉淀,加入少量乙醇溶解,置于蒸馏水中再次沉淀,回收沉淀物,即得三元共聚物。
2.2 载透明质酸-甲基胶原-三元共聚物/Dox复合膜的钽支架的制备
将金属钽支架材料放入透明质酸溶液中,放入真空干燥器中负压抽吸。将吸附有透明质酸的钽支架材料进行冷冻干燥。取适量甲基胶原溶液和Dox溶液,混合均匀,然后用加样枪定量吸取混合溶液滴加在钽材料上,真空干燥;再用加样枪吸取适量三元共聚物溶液滴加在钽材料上,充分反应1 h后真空干燥,制得载透明质酸-甲基胶原-三元共聚物/Dox复合膜的钽支架。用共聚焦扫描电镜观察所制备复合膜的钽支架材料内部,以空白钽支架材料内部为对照,可观察到所制复合膜内部有明显的膜(图1黑框处)形成,证明了透明质酸、甲基胶原、三元共聚物通过静电自组装反应形成了均匀分布的复合膜[3]。共聚焦扫描电镜图见图1。

图1 共聚焦扫描电镜图Fig 1 Confocal scanning electron microgram
2.3 Dox含量测定方法考察[4]
精密称取Dox原料药,加pH 7.2磷酸盐缓冲液(PBS)溶解并定量稀释制成0.05、0.1、0.2、0.5、1、2、5、10 μg/ml 的标准溶液,以pH 7.2 PBS为空白,采用紫外分光光度法测定234 nm波长处的吸光度。以吸光度(y)为纵坐标、质量浓度(x)为横坐标进行回归分析,得回归方程为y=0.001 2x+0.022 5(r=0.999 8);日内RSD小于1.83%(n=5),日间RSD小于2.01%(n=5)。
2.4 体外释放度方法考察[5]
将制备的载复合膜的钽支架材料置于装有2 ml PBS的深色离心管中,于37 ℃下水浴摇床中振摇(80 r/min),考察30 d内的体外累积释放度。样品溶液经滤过后用pH 7.2的PBS稀释,摇匀,作为供试品溶液,按照“2.3”项下方法测定吸光度,并代入回归方程计算含量,再计算累积释放度。
2.5 正交设计优化处方工艺及验证
根据预试验结果,以对影响累积释放度的3 个主要因素:透明质酸(A)、甲基胶原(B)、三元共聚物的质量浓度(C)。以A、B、C为因素,以1、30 d的累积释放度为指标,按正交表设计试验,优化处方[6]。因素与水平见表1,正交试验结果与极差分析见表2,方差分析结果见表3。
由表2可知,根据1 d累积释放度结果显示,因素对处方的影响程度为A>B>C;根据30 d累积释放度结果显示,因素对处方的影响程度为B>A>C。由表3可知,就1 d累积释放度而言,A对处方有显著影响(P<0.05),其余因素对处方无显著影响。综合考虑,最优处方为A1B3C3,即透明质酸1 mg/ml、甲基胶原4.5 mg/ml、三元共聚物100 mg/ml。
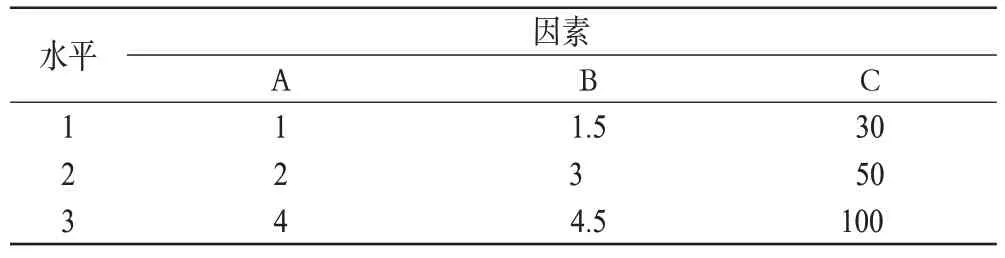
表1 因素与水平(mg/ml)Tab 1 Factors and levels(mg/ml)
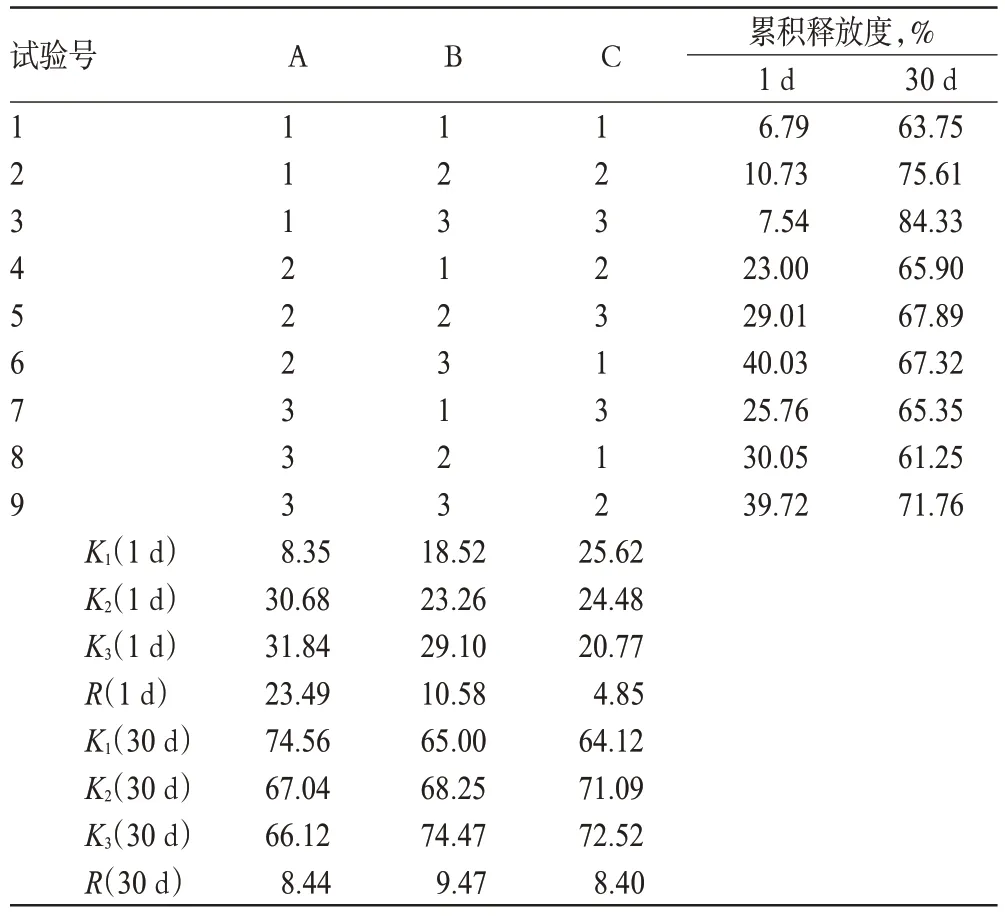
表2 正交试验结果与极差分析Tab 2 Result of orthogonal experiments and range analysis
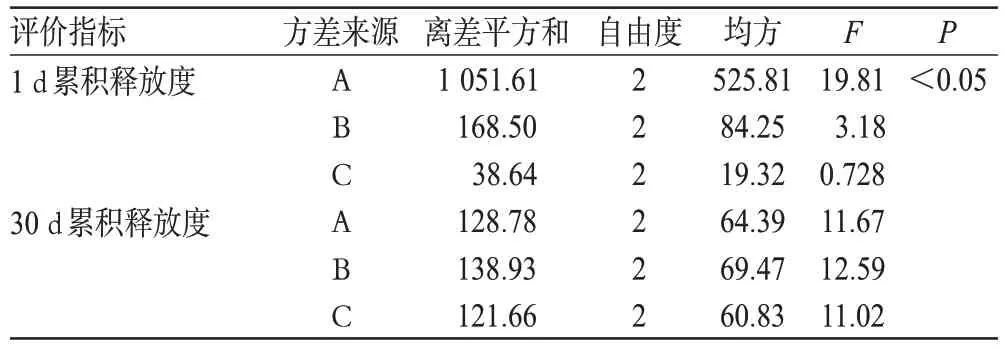
表3 方差分析结果Tab 3 Analysis of variance
按最优处方制备3 批样品,按“2.4”项下方法考察1、30 d的累积释放度,结果分别为(7.57±2.3)%、(84.14±2.1)%。
2.6 释放机制分析
在“2.5”项下验证试验过程中,分别于1、2、3、5、10、14、18、22、26、30 d取样,测定并计算累积释放度。以累积释放度对时间作图,绘制体外释放曲线,结果见图2。
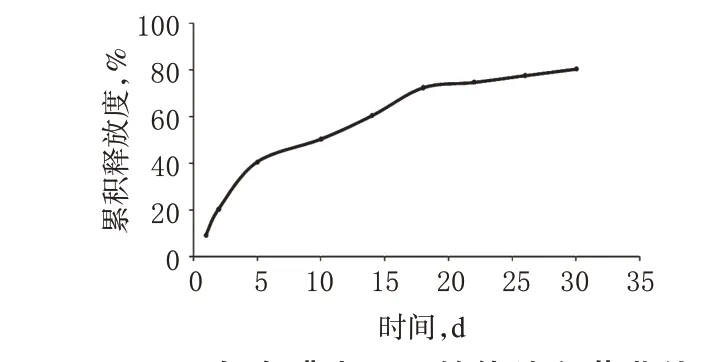
图2 复合膜中Dox的体外释药曲线Fig 2 Release curve of Dox in compound membranes in vitro
由图2可知,Dox在初始时快速释放,有释药冲击量;随着时间的延长,每日释放量减少;且在20 d 后,体系的每日释放量随着时间的增长而缓慢减小,溶出速率趋于稳定,近似为零级速率释药。由此可见,该缓释系统在体外模拟环境下可维持缓释时间达30 d。
3 讨论
本试验中所采用的植入材料为多孔金属钽支架材料,其生物相容性好、弹性模量接近松质骨,具有非降解特性,物理化学性能稳定。这种材料是通过化学蒸汽沉积法在均匀的网状碳骨架表面喷涂了一层惰性金属钽制作而成的,其平均孔径为430µm,孔隙率为75%~80%,孔隙间相互连通,是一个比较新颖的金属材料。
由验证试验结果可见,所制Dox 植入式缓控释系统30 d平均累积释放度为84.14%,低于缓控释制剂要求的药物完全累积释放度90%。究其原因,笔者认为是多孔金属钽支架材料的自身问题。
在本试验中,影响制备Dox 植入式缓控释系统的因素除了成膜材料的浓度外,笔者认为还包括自组装反应的时间与温度。本次研究中统一反应时间为1 h、反应温度为室温,后续试验中笔者将对其作进一步优化。
本试验研制的Dox植入式缓控释系统体外释放符合拟订的释药速度要求。由正交设计可见,透明质酸作为大分子黏弹性物质[7],其对释药速度影响最大。由释放度结果可见,制备的Dox缓控释系统具有缓释作用,释放度重现性良好,但该系统在动物体内释放、吸收等情况还有待进一步研究。
[1]王明,杨小平,苏宇雄,等.定量缓释基因重组碱性成纤维细胞生长因子/聚乳酸-聚羟基乙酸植入片的制备及体外释药研究[J].中华口腔医学研究杂志,2008,2(2):19.
[2]李勃,肖引,刘凯,等.阿霉素磁靶向药物制剂研究进展[J].中国药业,2014,23(10):96.
[3]屠锡德.药剂学[M].3 版.北京:人民卫生出版社,2002:949-951.
[4]樊秋平,梁嘉碧,杨海云,等.热疗用阿霉素温敏纳米粒的制备及工艺优化[J].中国药房,2011,22(17):1 580.
[5]祝侠丽,贾永艳,黄海英,等.正交设计法优化布洛芬缓释骨架片的处方工艺[J].中国药房,2014,25(9):830.
[6]鲍玉成,张文龙,王勇,等.长效缓释双药物人工骨的制备及释放特性[J].中国组织工程研究,2012,16(38):7 126.
[7]陈建澎,王婧茜,易喻,等.透明质酸及其衍生物研究进展[J].中国生物工程杂志,2015,35(2):111.
