条石鲷mPRα基因的cDNA克隆和表达模式分析*
2015-03-08柳学周陈圣毅徐永江李晓妮
史 宝 柳学周① 陈圣毅, 徐永江 臧 坤, 李晓妮
(1. 农业部海洋渔业可持续发展重点实验室 青岛市海水鱼类种子工程与生物技术重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071; 2. 上海海洋大学水产与生命学院 上海 201306)
孕激素参与调控生物体内的多种生理生化过程,包括生殖、 发育、 细胞增殖和脑部功能等(Tsai et al,1994)。孕激素、促黄体激素和成熟促进因子共同作用下硬骨鱼类卵母细胞成熟(Nagahama et al, 2008)。孕激素结合膜孕激素受体(Membrane progestin receptor, mPR), 进而激活成熟促进因子促使卵母细胞成熟(Thomas et al, 2004)。近年来, 在脊椎动物包括硬骨鱼类发现膜孕激素受体的三种亚型 mPRα、mPRβ、mPRγ(Zhu et al, 2003; Kazeto et al, 2005a)。在斑马鱼, 发现mPRα和mPRβ在卵母细胞发育的早期的转录水平较低, 在卵黄生成阶段转录水平逐渐增加(Kazeto et al, 2005b)。而且, 显微注射 mPRα和mPRβ的反义寡核苷酸探针能够有效地抑止斑马鱼、金鱼和蟾蜍卵母细胞对孕激素的应答(Ben-Yehoshua et al, 2007; Tokumoto et al, 2012)。这些研究说明膜孕激素受体参与调控孕激素诱导卵母细胞成熟。
条石鲷(Oplegnathidae fasciatus)在黄海、东海和台湾沿海等海域均有分布, 其肉质细嫩, 具有较高的营养价值(张春霖等, 1955)。条石鲷适合网箱、工厂化等多种养殖模式, 是一种理想的增养殖鱼种。近年来, 有关条石鲷的繁殖生物学和人工繁育、养殖技术研究已有一些报道(刘伟成等, 2008; 柳学周等, 2008;孙中之等, 2009; 张凤萍等, 2010; He et al, 2011; 彭志兰等, 2013), 促进了条石鲷养殖业的发展, 但是关于条石鲷繁殖内分泌学方面的研究报道并不多见,不利于建立稳定的生殖调控技术。本研究对条石鲷的mPRα基因进行了克隆, 并对其在雌体各组织及其卵巢发育不同阶段表达谱进行了分析, 初步探讨 mPRα在卵巢发育成熟中的作用以及与性类固醇激素的关系; 旨在查明mPRα在条石鲷卵母细胞成熟过程的作用机制提供理论依据, 并为条石鲷的繁殖调控提供科学参考。
1 材料与方法
1.1 实验材料
条石鲷取自青岛忠海水产有限公司(2012年4—12月), 共取16尾人工培育的 3龄以上性成熟的条石鲷雌鱼(全长 27.23—31.11 cm, 体重 478.2—671.7 kg)。条石鲷培育水温 15 —26 °C, 盐度 28—32,pH 8.0—8.2, 溶解氧6 mg/L以上, 日换水率300%—500%。在条石鲷亲鱼繁殖周期取样, 每次取样4尾。实验鱼用MS222(200 mg/L)麻醉后解剖, 取其脑、垂体、肝脏、心脏、卵巢、胃、幽门盲囊、肠、脾脏、肾脏、鳃、肌肉组织快速投入液氮中, 然后转入–80°C冰箱保存, 用于总 RNA的提取。同时, 用 Davidson固定液固定部分卵巢组织, 24h后转入70%的酒精保存, 用于组织学观察, 确定性腺发育时期。
1.2 卵巢的组织切片与观察
卵巢组织固定后切取小块组织, 通过梯度酒精(100%—70%)脱水、二甲苯透明、石蜡包埋, 利用LEICA RM 2235型切片机连续切片, 切成6 μm切片,采用苏木精-曙红(H.E)染色, 中性树胶封片, 在NIKON 90i显微镜下观察及显微摄影。卵巢各发育期的确定参考刘筠对鲤科鱼类性腺分期的标准进行(刘筠, 1993)。
1.3 RNA提取和cDNA 合成
利用RNAiso Plus (TaKaRa)从垂体、心脏、卵巢等12个组织中提取总RNA。利用超微量紫外检测仪(Nanodrop 2000D)检测总RNA的纯度和浓度, 1%琼脂糖凝胶电泳检测RNA的质量。以条石鲷卵巢中总RNA为模板, 根据PrimeScript®RT-PCR Kit反转录试剂盒(TaKaRa)中的操作说明反转录合成 cDNA并用于后续克隆。
1.4 条石鲷mPRα基因 cDNA序列克隆
使用F/R引物(表1)扩增mPRα保守序列, PCR扩增体系为 cDNA2 µL, PCR Buffer 2.5µL, dNTP 0.5µL,Taq酶 0.2µL, 补无菌水至 20µL。PCR反应条件为:94°C 5min, (94°C 30s, 57.7°C 30s, 72°C 50s)共 30 个循环, 最后72°C延伸10min。PCR产物用1%的琼脂糖电泳检测、切胶回收、纯化后连接到pEASY-T1载体(北京全式金生物技术有限公司)上并转移至Trans1-T1感受态细胞(北京全式金生物技术有限公司)中, 37 °C条件下振荡培养12h, 筛选阳性克隆菌株送至华大基因公司测序。将测序结果在NCBI上进行分析比对。
以垂体总RNA为模板, 根据Clontech SMARTerTMRACE cDNA Amplification Kit 反转录试剂盒(TaKaRa)中的操作说明分别合成5'-cDNA和3'-cDNA。然后分别以5'-cDNA和3'-cDNA为模板, 以GSP5和GSP3为引物(表1), 根据Smart RACE Advantage 2 PCR 试剂盒(Clontech)中的操作说明进行PCR扩增, PCR条件: 94 °C 30s; 68 °C 30s, 15 个循环, Tm每个循环降低 0.5 °C, 72 °C 延伸 2 min; 然后 94 °C 30s, 60 °C 30 s,72 °C 60s, 28个循环。 将第一次PCR产物稀释40倍后作为模板, 分别以NGSP5和NGSP3为引物进行巣式PCR, PCR条件同第一次PCR。用1%的琼脂糖电泳检测 PCR产物。然后切胶回收、连接转化、筛选阳性克隆并测序。

表1 实验中所用引物及其序列Tab.1 Sequences of the primers used for PCR analysis
1.5 序列分析
测序结果在NCBI数据库中利用BLAST(http://www.ncbi.nlm.nih.gov/)进行同源性比对。利用DNAstar软件进行序列拼接、预测蛋白分子量和等电点; 利用ExPASy中的Translate Tool进行氨基酸序列翻译; 利用 SignalP 4.0 Server(http://www.cbs.dtu.dk/services/signalP/)进行信号肽预测; 利用 Clustal X进行氨基酸同源性比较; 利用MEGA 5.0中的Neighborjoining法(自展值为 1000)做进化分析; 利用 SOPMA(http://npsa-devel.ibcp.fr/NPSA/npsa-sopma.html)进行蛋白质二级结构预测; 利用 I-TASSE(http://zhanglab.ccmb.med.umich.edu/I-TASSER/)进行蛋白质三级结构预测。参与序列比对和进化分析的mPRα序列均来自 GenBank(表 2)。

表2 mPRα同源性比较与进化树中所用的鱼种及其基因登录号Tab.2 GenBank accession number of mPRα used for homologue and phylogenesis analyses
1.6 条石鲷 mPRα mRNA的组织表达与繁殖周期表达
采用实时荧光定量 PCR法(Mastercycler®Eprealplex实时荧光定量PCR仪)检测mPRα mRNA在条石鲷不同组织中的相对表达量和卵巢发育不同时期中脑-垂体-卵巢组织中的表达水平变化。设计特异性引物Q-F1/R1, 以Q-β-actin-F/R为内参引物(表1), 用SYBR GreenⅡ荧光染料(TaKaRa)进行荧光定量检测, 用比较阈值法测定不同组织的相对表达量。每种组织取3尾鱼, 每尾鱼设定3个平行。以各组织RNA为模板,根据 PrimeScript®RT reagent Kit with gDNA Eraser反转录试剂盒(TaKaRa)中的操作说明合成 cDNA。Real-time PCR 程序: 95 °C 30s; 95 °C 5s; 63.5 °C 28s,共 40个循环, 反应结束后进行溶解曲线分析。根据Ct值计算引物的扩增效率和溶解曲线的分析, 以确定引物和扩增参数是否达到进行荧光定量检测组织相对表达量的要求(0.8<E<1.2, R2>0.98)。
1.7 性类固醇激素的测定
采用125I放射免疫测定方法(RIA)(FJ-2008PSγ放射免疫计数)对条石鲷卵巢不同发育阶段血清中雌激素(E2)的含量进行测定。试剂盒购于天津九鼎医学生物工程有限公司, 根据试剂盒中的操作说明先制作标准曲线, 待标准曲线制作好后(相关系数R> 0.9999)再上样, 每次上样时都选择双管平行上样, 每个样品重复3次。测定的精密度在批次内为7.7%, 批次间为8.9%。测定的灵敏度为2.1 pg/mL。
1.8 数据处理
基因表达实验所得数据用相对定量的 2–ΔΔCT方法(Livak et al, 2001)计算处理后, 再用SPSS 16.0进行数据处理和显著性检验分析(P<0.05)。相对表达量数据均表示为平均数±标准误(Mean±SE), 并制成柱状图。雌激素测定数据均表示为平均值±标准误(Mean±SE), 采用单因素方差分析并进行显著性检验分析(P<0.05)。
2 结果与分析
2.1 条石鲷卵巢组织学
对16尾条石鲷卵巢组织切片的H.E染色结果进行分析, 采用卵巢切面中平均面积超过 50%或居最高比例的卵母细胞的时相来确定性腺的发育时期。对实验样品进行分析, 将采集的卵巢组织样本分为4个期: Ⅲ期卵巢, Ⅳ期卵巢, Ⅴ期卵巢和Ⅵ期卵巢(图1);每个性腺发育期对应4尾雌鱼。组织切片观察, Ⅲ期卵巢以Ⅲ时相卵母细胞为主, 卵母细胞多为圆形, 细胞核嗜碱性, 核仁多靠核膜分布(图 1a)。进入Ⅳ期,条石鲷的卵母细胞随着营养物质的不断积累, 细胞体积继续增大, 胞质中储存着大量卵黄颗粒和油球,卵母细胞外有两层滤泡细胞(图1b)。卵巢发育进入Ⅴ期, 卵母细胞呈圆球形, 卵黄颗粒的大量积累和融合,核仁消失(图 1c)。进入Ⅵ期, 卵巢萎缩, 卵巢壁上的平滑肌纤维松弛, 卵黄颗粒颜色暗淡(图1d)。
2.2 条石鲷mPRα的序列分析和蛋白质结构预测
获得的条石鲷 mPRα 的 cDNA 序列全长为1222bp, ORF长1060bp, 编码了353个氨基酸, 其中第 1—16个氨基酸为信号肽, 在其序列含有 13个保守的半胱氨酸(Cys), 分别位于第35、189、192、193、221、234、239、262、263、274、291、330、331 氨基酸残基处(图2)。该蛋白的预测分子量为40.68 kDa,预测等电点为7.08。
通过SOPMA软件对mPRα的蛋白质二级结构进行预测, 结果表明mPRα蛋白质的二级结构中, 图中蓝色代表的 α-螺旋占 55.97%, 绿色代表的 β-转角占1.99%, 紫色代表的无规则卷曲占 28.98%, 红色代表的延伸链占13.07%(图3)。通过I-TASSER软件预测了条石鲷 mPRα蛋白质的三级结构, 结果表明在其蛋白质三级结构结果中存在着多个蛋白结合位点(图4)。
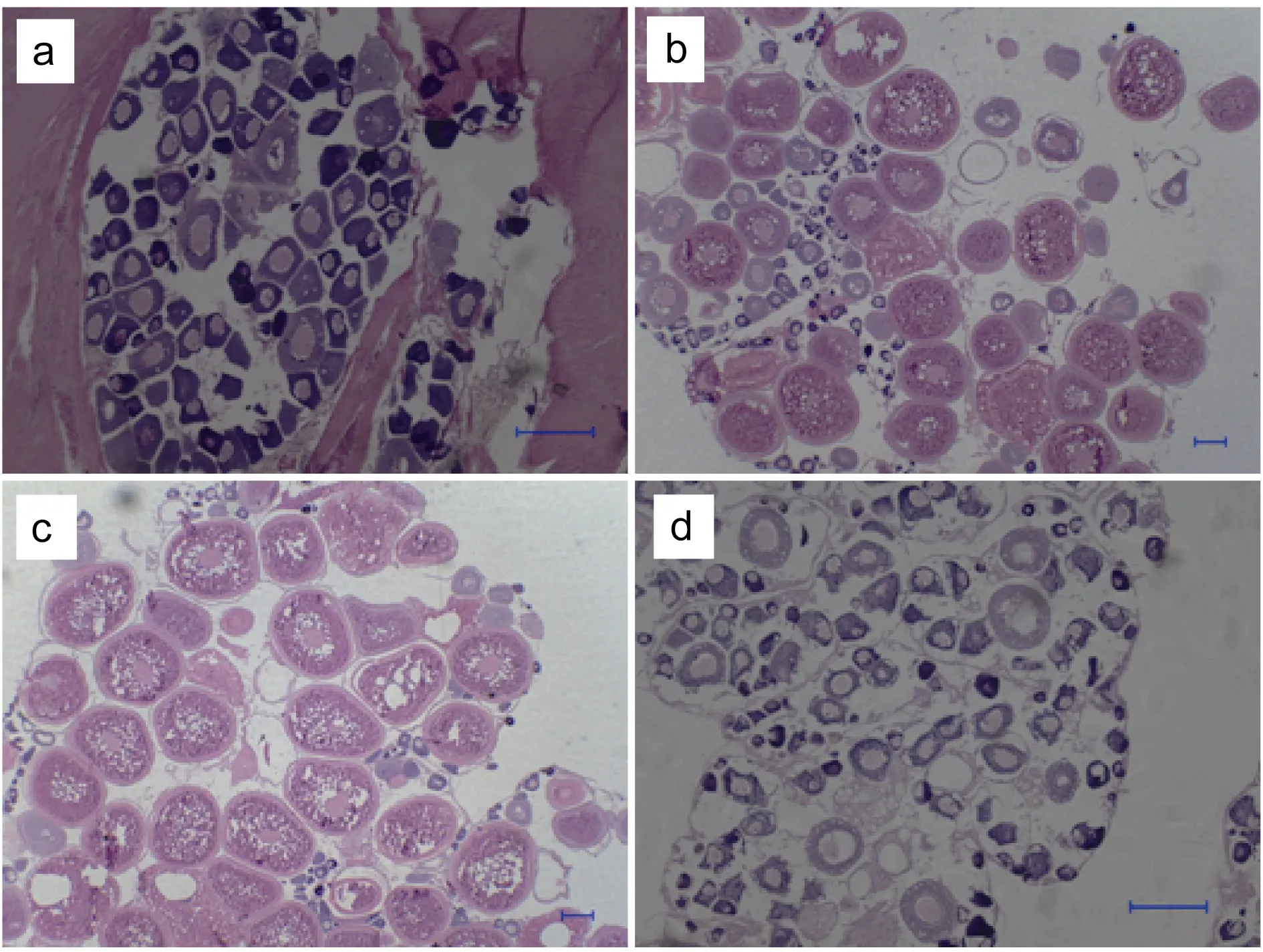
图1 条石鲷卵巢发育不同时期的形态特征Fig.1 The morphological characteristicsin ovarian development stages of O. fasciatus

图2 条石鲷mPRα cDNA全长以及推断的氨基酸序列Fig.2 The cDNA sequence and its deduced amino acid sequence of mPRα from O. fasciatus
2.3 条石鲷 mPRα氨基酸的同源性比较及系统进化分析
将条石鲷mPRα的氨基酸序列与其它物种mPRα的氨基酸序列进行同源性分析, 结果表明: 其与云纹犬牙石首鱼(Cynoscion nebulosus)同源性为 98%; 与大西洋绒须石首鱼(Micropogonias undulatus)的同源性为97%; 与罗非鱼(Oreochromis niloticus)的同源性为 95%; 与半滑舌鳎(Cynoglossus semilaevis)的同源性为94%; 与漠斑牙鲆(Paralichthys lethostigma)的同源性为93%; 与青鳉(Oryzias latipes)的同源性为91%;与金鱼(Carassius auratus)的同源性为 81%; 与斑马鱼(Danio rerio)的同源性为 80%; 与猪(Sus scrofa)的同源性为54%; 与牛(Bos taurus)的同源性为54%; 与家鼠(Mus musculus)的同源性为 53%; 与人(Homo sapiens)的同源性为 54%。同源性比较还发现, 在条石鲷的mPRα 中存在着7个保守的跨膜区域(图5)。通过MEGA5.0软件中的Neighbor-joining法(置信度检验 1000次)构建了条石鲷 mPRα氨基酸序列的 NJ系统进化树。结果表明: 条石鲷mPRα与硬骨鱼类构成一个大分支; 与鲈形目鱼类的亲缘关系较近, 与云纹犬牙石首鱼和大西洋绒须石首鱼聚为一个小分支(图 6)。
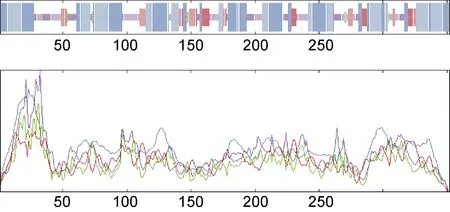
图3 条石鲷mPRα蛋白二级结构的分析Fig.3 Secondary structure of O. fasciatus mPRα protein
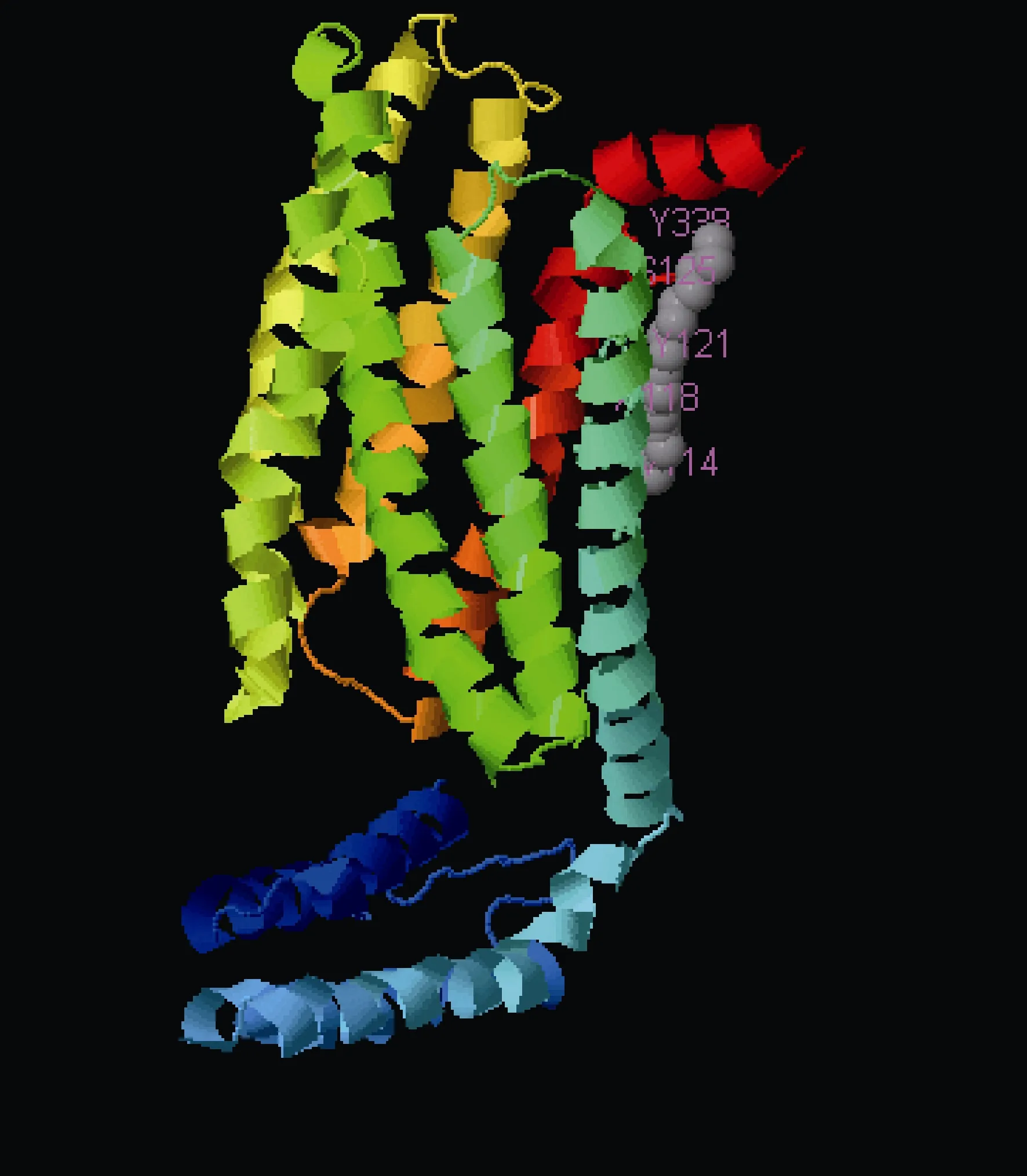
图4 条石鲷mPRα蛋白三级结构的分析Fig.4 Tertiary structure of O. fasciatus mPRα protein
2.4 mPRα mRNA在不同组织中的表达分布
利用实时荧光定量PCR法, 以β-actin基因为参照, 检测条石鲷mPRα mRNA在条石鲷不同组织中的表达分布。结果表明: mPRα 在被检测的13个组织中均有表达, 其中在脑中的表达量最高, 其次是性腺和垂体。统计分析表明: mPRα mRNA在脑和性腺中的表达量与其它组织差异极显著(P<0.01); 而在垂体、脾脏、头肾、鳃、胃、肝脏、幽门盲囊、肠、心、肾和肌肉中的表达量差异不显著 (P>0.05) (图7)。
2.5 mPRα mRNA在卵巢不同发育时期的表达
利用实时荧光定量PCR法检测了mPRα mRNA在条石鲷卵巢不同发育时期的脑-垂体-卵巢中的相对表达水平。与垂体和卵巢相比, 脑中的mPRα mRNA在卵巢发育各个时期都有较高的表达水平。由SPSS16.0软件显著性检验分析得出, mPRα mRNA在各繁殖周期脑、垂体、卵巢组织的表达水平差异显著(P<0.05)。
在繁殖周期脑组织中, mPRα mRNA的表达量在卵巢发育的Ⅲ—Ⅳ期逐渐上升, 到Ⅳ期时达到最大值(P<0.05), 在Ⅴ期又急剧降低, 达到最小值, 然后在Ⅵ期时开始回升(图 8a)。在繁殖周期垂体组织中,mPRα mRNA的表达量在卵巢发育的Ⅲ—Ⅳ期逐渐上升, 到Ⅳ期时达到峰值(P<0.05), 在Ⅴ期又急剧降低, 达到最低值, 然后在Ⅵ期时开始回升(图 8b)。在繁殖周期卵巢组织中, mPRα mRNA的表达量在卵巢发育的Ⅲ—Ⅴ期急剧上升, 到Ⅴ期时达到最大值(P<0.05), 在Ⅵ期又急剧下降(图8c)。
2.6 雌二醇在条石鲷卵巢发育不同时期的含量变化
利用放射免疫测定方法(RIA)检测了血清中雌二醇(E2)在条石鲷卵巢发育不同时期的含量变化。结果表明: 条石鲷血清中 E2的含量在卵巢发育的各个时期差异显著(P<0.05)(图9)。E2在卵巢发育的Ⅲ—Ⅳ期急剧上升, 并在Ⅳ期达到最大值(P<0.05), 之后其含量开始下降, 并在Ⅵ期达到最小值。表明条石鲷血清雌二醇的浓度变化与卵巢的发育相关。
3 讨论
本研究利用 RACE等方法首次从条石鲷卵巢中获得mPRα 的cDNA全长序列, 推导的mPRα蛋白序列含353个氨基酸。通过氨基酸序列分析, 在其成熟肽序列中存在 13个保守的半胱氨酸, 在其二级结构中有7个跨膜区域; 在结构上与其它脊椎动物mPRα具有很高的保守性。同源性比较表明, 条石鲷的mPRα与硬骨鱼类的mPRα同源性比较高(80%—98%),与哺乳动物 mPRα的同源性较低(53%—54%)。系统进化分析表明, 条石鲷与同为鲈形目的云纹犬牙石首鱼和大西洋绒须石首鱼聚为一个小分支, 与其它硬骨鱼类聚为一个大分支, 说明在长期进化的过程中它们的亲缘关系比较接近。

图5 条石鲷mPRα氨基酸序列与其它物种mPRα氨基酸序列的比较Fig.5 Amino acid sequence alignment of mPRα from O. fasciatus with other fishes
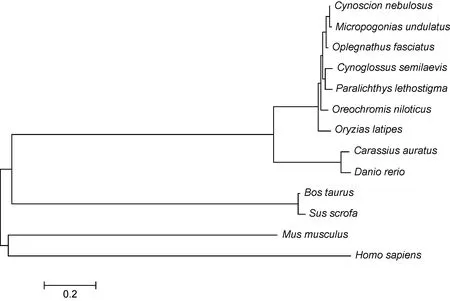
图6 条石鲷mPRα氨基酸序列与其它脊椎动物mPRα的系统进化树Fig.6 Phylogenetic tree of mPRα from O. fasciatus and other known vertebrates

图7 条石鲷mPRα mRNA在不同组织中的相对表达水平Fig.7 The relative expression level of mPRα mRNA in various tissues of O. fasciatus
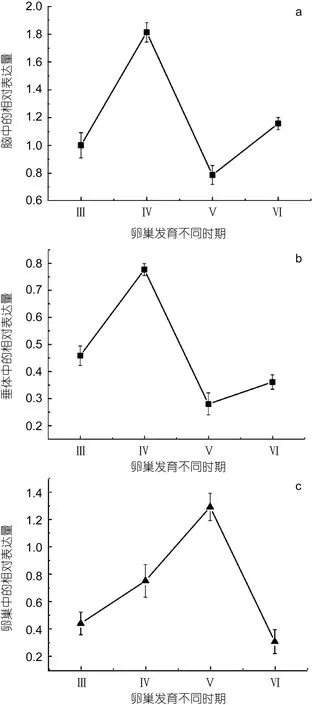
图8 mPRα mRNA在条石鲷卵巢不同发育时期的相对表达量Fig.8 The relative expression of mPRα mRNA in ovarian development stage of O. fasciatus
采用实时荧光定量PCR法检测了mPRα mRNA在条石鲷的组织表达特征, 结果表明mPRα mRNA在脑组织的表达量最高, 其次是在卵巢组织, 而垂体组织中mPRα mRNA相对表达水平低于前二者; 这与斑点叉尾(Ictalurus punctatus) mPRα mRNA组织表达特征相似之处, 但是斑点叉尾垂体组织的 mPRα mRNA相对表达水平要高于卵巢组织(Kazeto et al,2005a)。Hanna等(2009)通过免疫组化技术对模式生物斑马鱼的垂体和卵巢中 mPRα的细胞表达定位进行检测, 发现mPRα主要分布于卵母细胞的细胞膜和滤泡细胞, 垂体内mPRα在多种细胞内分布。本研究首次在石鲷科鱼类发现 mPRα mRNA表达也具有广泛性, 在被检测的 13个组织中均有表达。Tubbs等(2010)在大西洋绒须石首鱼发现mPRα mRNA组织表达具有广泛性, 在脑、卵巢、精巢、心脏、肝脏、肠、肌肉、鳃、嗅上皮等组织中都有表达。在本研究中条石鲷mPRα mRNA广泛表达模式与之相似。这些研究结果表明 mPRα在硬骨鱼类多种组织介导孕激素的生理功能。关于mPRα在其它组织中具体的作用机制和生理作用需要深入研究, 这将有助于更加全面了解mPRα的调控机制。
用实时荧光定量PCR法检测了mPRα mRNA在条石鲷卵巢发育不同阶段的表达水平变化。结果发现在条石鲷繁殖周期, mPRα mRNA在脑组织中的表达水平始终高于卵巢和垂体; 而且在卵巢发育Ⅳ期时脑组织中mPRα mRNA达到最大值。在条石鲷繁殖周期, 垂体中的mPRα mRNA在Ⅳ期达到最大值, 而在Ⅴ急剧降低。条石鲷脑和垂体组织mPRα mRNA的繁殖周期表达模式相似, 说明孕激素在脑-垂体神经内分泌系统, 可以通过 mPRα的介导进而调节繁殖活动。在另一种重要海水养殖经济鱼类半滑舌鳎, 研究发现其脑和垂体组织的 mPRα mRNA的表达水平从卵巢发育的Ⅱ—Ⅳ期显著升高(P<0.05)并且在Ⅳ期时达到最高峰(李晓晓等, 2013)。在鱼类神经内分泌系统发现mPRα mRNA在繁殖周期各个阶段均有表达,一方面预示着mPRα生理功能重要性; 另一方面其作用机制并不清楚, 也体现出复杂性。在条石鲷繁殖周期, 卵巢组织中的mPRα mRNA在Ⅲ—Ⅴ期急剧上升,并在Ⅴ期达到最大值; 表明mPRα在卵巢发育、成熟的生理过程均发挥作用, 并在介导孕激素诱导卵母细胞的成熟过程起着重要的调控作用。Kazeto 等(2005b)采用实时荧光定量 PCR方法检测斑点叉尾繁殖周期的mPRα mRNA在卵巢组织的表达变化, 发现 mPRα mRNA在卵母细胞发育阶段表达量开始升高, 在卵母细胞成熟阶段表达量达到峰值。本研究结果与斑点叉尾mPRα基因周期表达模式相似。条石鲷血清中雌二醇含量在卵巢发育的Ⅲ—Ⅳ期急剧上升, 并在Ⅳ期达到最大值(P<0.05), 之后其含量开始下降。Karteris等(2006)研究发现在人类子宫肌层, 雌二醇可以上调mPRα mRNA和蛋白水平。在本研究中卵巢从Ⅲ期发育到Ⅳ期过程中, 血清中雌二醇水平升高, 繁殖周期脑-垂体-卵巢中mPRα mRNA表达量也升高; 并且雌激素含量变化与繁殖周期脑-垂体中mPRα 基因表达变化相似; 但是在条石鲷卵巢成熟期, 血清中雌二醇水平降低而卵巢中mPRα mRNA达到周期中最高值, 推测此阶段主要由mPRα介导孕酮激素诱导卵母细胞成熟。真鲷(Pagrus major)血清中孕激素通过 ELISA测定发现在卵巢发育成熟期达到峰值(Otha et al, 2002), 该研究支持本实验的推测。在今后的研究中, 将进一步分析条石鲷繁殖周期血清中孕酮激素与mPRα mRNA和蛋白水平变化关系, 揭示mPRα的作用机制。
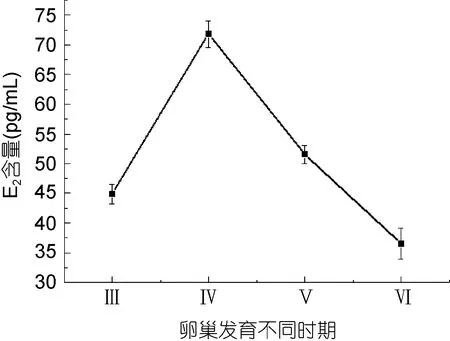
图9 雌二醇激素在条石鲷卵巢不同发育时期的含量变化Fig.9 The level of plasma estrogen in ovarian development stage of O. fasciatus
刘 筠, 1993. 中国养殖鱼类繁殖生理学. 北京: 农业出版社,42—46
刘伟成, 单乐州, 谢起浪等, 2008. 温度对条石鲷摄食率、产卵量和受精率的影响. 宁波大学学报(理工版), 21(3): 314—317
孙中之, 柳学周, 徐永江等, 2009. 条石鲷人工育苗及养殖技术. 齐鲁渔业, 26(1): 28—31
李晓晓, 2013. 膜孕激素受体在鲆鲽类繁殖周期中的生理功能研究. 上海: 上海海洋大学硕士学位论文
张凤萍, 柳敏海, 彭志兰等, 2010. 条石鲷卵巢发育的组织学研究. 大连水产学院学报, 25(2): 102—106
张春霖, 成庆泰, 郑葆珊等, 1955. 黄渤海鱼类调查报告. 北京: 科学出版社, 153—155
柳学周, 徐永江, 王妍妍等, 2008. 条石鲷的早期生长发育特征. 动物学报, 54(2): 332—341
彭志兰, 柳敏海, 傅荣兵等, 2013. 野生条石鲷精巢的年周期发育. 海洋通报, 32(6): 700—703
Ben-Yehoshua L J, Lewellyn A L, Thomas P et al, 2007. The role of Xenopus membrane progesterone receptor β in mediating the effect of progesterone on oocyte maturation. Molecular Endocrinology, 21(3): 664—673
Hanna R N, Zhu Y, 2009. Expression of membrane progestin receptors in zebrafish (Danio rerio) oocytes, testis and pituitary. General and Comparative Endocrinology, 161(1):153—157
He T, Xiao Z Z, Liu Q H et al, 2011. Stages of rock bream Oplegnathus fasciatus (Temminck et Schlegel 1844):embryonic development. Aquaculture Research, 42(12):1764—1777
Karteris E, Zervou S, Pang Y F et al, 2006. Progesterone signaling in human myometrium through two novel membrane G protein-coupled receptors: potential role in functional progesterone withdrawal at term. Molecular Endocrinology, 20(7): 1519—1534
Kazeto Y, Goro-Kazeto R, Trant J M, 2005b. Membrane-bound progestin receptors in channel catfish and zebrafish ovary:Changes in gene expression associated with the reproductive cycles and hormonal reagents. General and Comparative Endocrinology, 142(1—2): 204—211
Kazeto Y, Goto-Kazeto R, Thomas P et al, 2005a. Molecular characterization of three forms of putative membrane-bound progestin receptors and their tissue-distribution in channel catfish, Ictalurus punctatus. Journal of Molecular Endocrinology, 34(3): 781—791
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2–△△CTmethod. Methods, 25(4): 402—408
Nagahama Y, Yamashita M, 2008. Regulation of oocyte maturation in fish. Development, Growth & Differentiation,50(S1): S195—S219
Otha K, Yamaguchi S, Yamaguchi A et al, 2002. Biosynthesis of steroids in ovarian follicles of red seabream, Pagrus major(Sparidae, Teleostei) during final oocyte maturation and the relative effectiveness of steroid metabolites for germinal vesicle breakdown in vitro. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology,133(1): 45—54
Thomas P, Pang Y F, Zhu Y et al, 2004. Multiple rapid progestin actions and progestin membrane receptor subtypes in fish.Steroids, 69(8—9): 567—573
Tokumoto T, Tokumoto M, Oshima T et al, 2012. Characterization of multiple membrane progestin receptor (mPR) subtypes from the goldfish ovary and their roles in the induction of oocyte maturation. General and Comparative Endocrinology,177(1): 168—176
Tsai M J, O’Malley B W, 1994. Molecular mechanisms of action of steroid/thyroid receptor superfamily members. Annual review of biochemistry, 63(1): 451—486
Tubbs C, Pace M, Thomas P, 2010. Expression and gonadotropin regulation of membrane progestin receptor alpha in Atlantic croaker (Micropogonias undulatus) gonads: Role in gamete maturation. General and Comparative Endocrinology, 165(1):144—154
Zhu Y, Rice C D, Pang Y F et al, 2003. Cloning, expression, and characterization of a membrane progestin receptor and evidence it is an intermediary in meiotic maturation of fish oocytes. Proceedings of the National Academy of Sciences of USA, 100(5): 2231—2236
