NO对UV-B辐射下南方红豆杉幼苗生理特性的影响1)
2015-03-08李德文刘英李美兰唐中华于景华祖元刚
李德文 刘英 李美兰 唐中华 于景华 祖元刚
(森林植物生态学教育部重点实验室(东北林业大学),哈尔滨,150040)
责任编辑:王广建。
随着大气平流层臭氧层变薄,到达地表的中波紫外线(UV-B,280~320 nm)量日渐增强,对地球生物产生严重影响[1]。国内外学者关于UV-B 辐射增强对植物生长发育和生理代谢影响等方面已作了大量的研究,但较多集中在农作物、蔬果方面,对多年生的木本植物、药用树木研究的较少[2]。
一氧化氮(NO)是一种在动植物的多种生理活动中发挥作用的易扩散生物活性分子[3],广泛参与植物体内多种生理代谢活动。低浓度的NO 可有效保护植物,高浓度NO 具有生理毒性,对植物具有一定的伤害[4]。NO 被认为是转换UV-B 辐射信号的“积极分子”,因为在类似于一氧化氮合酶(NOS)的酶的作用下,NO 可以诱导查耳酮合酶(CHS)表达[5]。大量研究表明,添加外源NO 供体硝普钠(SNP)可增强植物的抵抗能力与植物内源NO 作用相同[6]。关于NO 对植物的抗性生理作用的研究处于初级阶段,NO 对植物的氧化胁迫的调控机制,仍需进一步深入研究。
南方红豆杉(Taxux chinensis var.mairei)为我国重要的抗癌植物,枝、叶、茎、皮、根、种子、果肉中均含有紫杉醇及其类似物,具有巨大的药用开发利用价值[7]。杨逢建等[8]研究表明适当增加环境UV-B辐射强度,可显著提高南方红豆杉体内的紫杉醇质量分数。本试验选择5年生人工种植的南方红豆杉幼苗为材料,在增强UV-B 辐射强度下,研究外源NO 供体硝普钠(SNP)对南方红豆杉幼苗针叶光合色素、H2O2及紫杉醇等化合物质量分数的影响,探讨NO 对南方红豆杉的生理代谢过程的影响机制。
1 材料与方法
1.1 试验设计
试验于2012年6月3日—8月13日,在东北林业大学森林植物生态学重点试验室温室内进行。将5年生南方红豆杉幼苗随机分为4 组,每组60 株。试验设置为对照(CK)处理、外源NO 供体硝普钠(SNP)处理(0.1 mmol·L-1SNP)、UV-B 胁迫处理(4.22 kJ·m-2·d-1UV-B)、UV-B(4.22 kJ·m-2·d-1UV-B)+SNP(0.1 mmol·L-1SNP)处理。CK 为温室内自然光照处理,UV-B 处理为在温室内自然光照基础上,人工添加4.22 kJ·m-2·d-1UV-B 辐射强度。人工增加UV-B 辐射是由UV-B 灯管(40 W,北京电光源研究所)产生,用0.08 mm 醋酸纤维膜过滤以消除UV-C(波长200~280 nm)的影响。每天UV-B 辐射处理周期为12 h(6:00—18:00)。UV-B 辐射强度用光谱仪AvaSpec 2048-2(Avantes BV,Netherlands)测定。SNP 购自上海国药集团公司。处理9 d 后,选取已完全展开的、生长状况、叶龄及叶位一致的南方红豆杉针叶,测定各项生理指标,每个处理均随机取样,9 次重复。
1.2 指标测定方法
光合色素质量分数测定参照高俊凤[9]的方法;过氧化氢(H2O2)质量分数参照魏晓雪等[2]的方法测定;称取1 g 南方红豆杉针叶,采用DMSO 分子探针法测定其羟基自由基(·OH)质量分数[10];黄酮和单宁质量分数测定参照李兰芳等[11]的方法;总酚测定参照程春龙[12]的方法;紫杉醇质量分数测定参照祖元刚等[13]的方法,取0.5 g 南方红豆杉针叶烘干粉末于10 mL 离心管中,加入甲醇10 mL,震荡混匀后,超声20 min,8 000 r·min-1离心20 min,提取上清液,重复2 次,合并上清液,浓缩至干,然后,用1 mL 色谱级甲醇复溶,用高效液相色谱法(HPLC)检测;流动相为V(乙腈)∶V(水)=37 ∶63;Curosil-PFP 色谱柱(位置异构体分析专用液相色谱柱;5 μm,4.6 mm×250 mm);以1 mL·min-1流速,进样量10 μL,在234 nm 波长下检测,柱温为35 ℃。
1.3 数据分析
每个生理指标重复9 次,取平均值并求标准误。采用SPSS16.0 软件对各指标不同处理间的差异显著性进行分析。
2 结果与分析
2.1 光合色素质量分数变化
处理9 天后,分别测定不同处理下南方红豆杉幼苗针叶光合色素质量分数(见表1)。由表1可知,与CK 相比,SNP 处理显著增加了南方红豆杉幼苗针叶叶绿素a、叶绿素b 和总叶绿素的质量分数;而UV-B 处理显著降低了南方红豆杉幼苗针叶叶绿素a、总叶绿素的质量分数及叶绿素a/b 的比值。与CK 相比,SNP、UV-B、UV-B+SNP 处理均显著增加了南方红豆杉幼苗针叶类胡萝卜素质量分数(p<0.05)。与UV-B 处理相比,UV-B+SNP 处理显著增加了叶绿素a、总叶绿素、类胡萝卜素质量分数及叶绿素a/b 的比值(p<0.05)。

表1 外源NO 对UV-B 胁迫下南方红豆杉幼苗针叶光合色素质量分数的影响 mg·g-1
2.2 H2O2 质量分数及·OH 水平的变化
如表2所示,不同处理对南方红豆杉幼苗针叶中的H2O2质量分数和·OH 水平的影响不同,与CK 相比,UV-B 处理显著增加南方红豆杉幼苗针叶H2O2质量分数及·OH 水平(p <0.05),分别提高11.3%(H2O2)和100%(·OH)。施加NO 供体对针叶内·OH 水平无显著影响(p>0.05)。与CK 相比,SNP 处理显著降低了南方红豆杉幼苗针叶H2O2质量分数(p<0.05)。在UV-B 胁迫下,喷施0.1 mmol·L-1SNP 显著降低了针叶的H2O2质量分数和·OH的水平(p<0.05)。

表2 外源NO 对UV-B 胁迫下南方红豆杉幼苗针叶H2O2质量分数和·OH 的影响
2.3 UV-B 吸收化合物及紫杉醇质量分数变化
由表3可知,增强环境UV-B 辐射强度及喷施SNP 溶液均显著提高南方红豆杉幼苗针叶紫杉醇质量分数(p<0.05),但二者复合作用与SNP 单独处理下针叶紫杉醇质量分数差异不明显(p>0.05)。不同处理下南方红豆杉针叶紫杉醇质量分数由小到大的顺序为:CK、UV-B、SNP、UV-B+SNP。与CK 相比,SNP、UV-B、UV-B+SNP 处理均显著增加了南方红豆杉幼苗针叶类黄酮质量分数(p<0.05),黄酮质量分数由小到大的顺序为:CK、SNP、UV-B、UV-B+SNP。UV-B、UV-B+SNP 处理下针叶内总酚质量分数显著高于CK 及SNP 处理,可见UV-B 辐射对总酚质量分数的影响大于SNP。与CK 相比,SNP、UVB、UV-B+SNP 处理均显著增加了南方红豆杉幼苗针叶单宁质量分数(p<0.05)。在UV-B 胁迫下,添加SNP 可有效增加黄酮、单宁及紫杉醇质量分数(p<0.05),增强植物对UV-B 胁迫的抵抗能力。
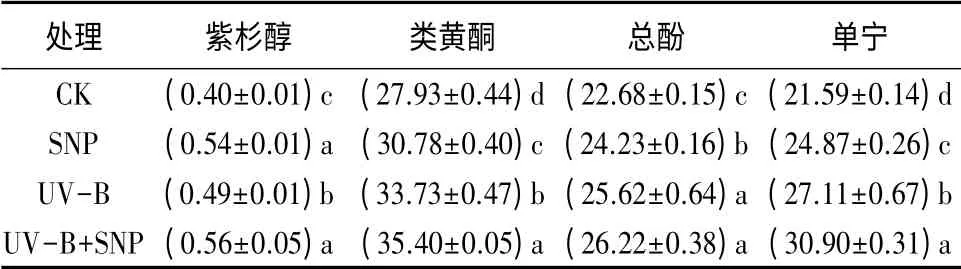
表3 外源NO 对UV-B 胁迫下南方红豆杉幼苗针叶紫杉醇和UV-B 吸收化合物质量分数的影响 mg·g-1
3 结论与讨论
光合色素质量分数的变化直接影响植物对光能的吸收、传递和转化,叶绿素a/b 可反映类囊体的垛叠程度,类囊体的垛叠程度越高,植株抵御逆境胁迫的能力就越强[14]。UV-B 处理降低了南方红豆杉幼苗光合色素的质量分数,这可能是因为在UV-B胁迫下,叶绿体膜结构被破坏,叶绿体基粒受到损伤,导致叶绿素加速分解或增加了叶绿素合成阻力,此外,由于叶绿素多以与蛋白质复合体的形式存在,UV-B 辐射增强可诱导蛋白变性,最终降低叶绿素质量分数。试验证实了叶绿素a 对UV-B 辐射更敏感这一理论。添加外源SNP 可显著增加UV-B 辐射下南方红豆杉针叶叶绿素a、叶绿素b 和总叶绿素的质量分数。与此类似,刘建新等[15]研究表明在PEG6000 渗透胁迫下,施用SNP 显著提高了黑麦草幼苗叶片光合色素质量分数和类囊体的垛叠程度,而添加血红蛋白后,SNP 的作用被消除,究其原因可能与NO 能够促进植物叶绿体的发育有关。类胡萝卜素是光系统的重要组成部分,是非常重要的结合于生物膜上的抗氧化剂[16],可吸收过多的光能,避免叶绿素被氧化分解,降低UV-B 辐射对植物造成的氧化损伤[17]。研究发现提高环境UV-B 辐射强度及喷施低浓度SNP 均显著提高针叶类胡萝卜素质量分数,进一步证实植物可以通过提高类胡萝卜素等抗氧化剂质量分数以应对非生物环境胁迫。
活性氧(ROS)水平提高可诱发脂质过氧化链式反应,导致细胞膜的完整性遭到破坏[18]。试验中,UV-B 辐射增强,诱导了南方红豆杉幼苗针叶中H2O2和·OH 的大量产生,喷施0.1 mmol·L-1SNP可显著降低UV-B 胁迫下红豆杉幼苗针叶中活性氧自由基(O2-·)质量分数,降低膜质过氧化程度。与此类似,在NaCl 胁迫下,外源NO 可显著降低番茄幼苗叶片MDA(丙二醛)质量分数和O2-·产生速率,能够缓和膜相变化和膜透性的增大,阻止离子渗漏,具有良好的修复和保护细胞膜,维持细胞膜完整性的作用[18]。由于外源NO 供体可显著提高南方红豆杉针叶中H2O2清除剂(过氧化氢酶和过氧化物酶)的活性[19],因此,SNP 导致活性氧自由基及MDA 质量分数降低的一个可能机制是NO 可以促进植物体内一系列抗氧化酶类基因的表达。
UV-B 辐射增强可诱导南方红豆杉幼苗针叶紫杉醇质量分数的升高,其原因可能是UV-B 辐射调控了代谢过程中某些参与合成紫杉醇的酶的活性,加速了紫杉醇的合成效率,从而增加了紫杉醇质量分数,使紫杉醇质量分数达到一种新的平衡以应对UV-B 胁迫[20]。徐茂军等[21]研究发现,添加外源SNP 处理可诱发红豆杉等植物细胞合成次生代谢产物,推测NO 是增加植物细胞次生代谢产物合成的充分条件。试验结果表明添加外源SNP 显著增加了南方红豆杉幼苗针叶的紫杉醇质量分数,此外,在UV-B 胁迫下,添加外源0.1 mmol·L-1SNP 可显著增加南方红豆杉幼苗针叶的紫杉醇质量分数。因此,NO 作为信号分子参与了紫杉醇合成的调控作用,该作用可能与NO 活化植物细胞防御反应的功能有关[22-23],但关于施加外源NO 供体诱导紫杉醇质量分数增加的机制问题还需在分子水平上进一步的研究。
在植物体内,黄酮作为清除UV-B 辐射诱发的活性氧的“淬灭剂”和滤除UV-B 辐射的“过滤剂”,其质量分数的增加,被认为是植物响应环境UV-B辐射增强的普遍特征之一[24]。总酚能有效吸收UV-B辐射,提高植物对UV-B 辐射的抵抗能力。单宁被认为是植物体内普遍存在的次生代谢物质和防御物质[25]。与祖元刚等[13]的研究结果一致。研究证实UV-B 辐射增强,可诱导黄酮、总酚、单宁等质量分数显著增加,从而增强南方红豆杉幼苗对UV-B 胁迫的抵抗能力。此外,研究发现,在提高环境UV-B辐射下,喷施SNP 可以显著增加南方红豆杉针叶黄酮、单宁、总酚及紫杉醇质量分数(p<0.05)。徐茂军等[22]试验结果表明,添加0.5 mmol NO 淬灭剂(cPTIO)预处理可以完全抑制UV-B 对桦树叶中NO水平的促进作用,并且抑制UV-B 处理下桦树叶中黄酮的合成积累,并认为cPTIO 本身对桦树幼叶中黄酮合成积累无抑制作用。外源NO 供体对植物细胞次生代谢产物质量分数的影响呈明显的剂量效应[26],例如,施用高剂量的外源NO 供体SNP 可刺激苦参细胞中苦参碱的合成积累,而低剂量的外源NO 体SNP却对次生代谢产物的合成积累无影响[27]。
综上所述,提高环境UV-B 辐射强度可显著增加南方红豆杉针叶内紫杉醇等重要次生代谢产物的质量分数,但UV-B 辐射胁迫处理会降低针叶光合色素质量分数,影响植物生长,从而无法达到提高紫杉醇产量的目的。在UV-B 胁迫处理下,喷施低浓度外源NO 供体SNP 可提高南方红豆杉次生代谢产物质量分数,并明显降低针叶内H2O2质量分数和·OH 的水平,提高光合色素质量分数,缓解UV-B 胁迫所导致的氧化损伤,进而提高紫杉醇产量。因此,通过合理提高环境UV-B 辐射强度并喷施外源NO供体以调节植物生长,促进紫杉醇等次生代谢产物合成,对于有效提高南方红豆杉的经济价值具重要实践意义。
[1] 周秀骥,罗超,李维亮,等.中国地区臭氧总量变化与青藏高原低值中心[J].科学通报,1995,40(15):1396-1398.
[2] 魏晓雪,于景华,李德文,等.UV-B 辐射增强对红松幼苗针叶脂质过氧化及抗氧化系统的影响[J].林业科学,2011,47(5):54-59.
[3] Durner J,Klessig D F.Nitric oxide as a signal in plants[J].Current Opinion in Plant Biology,1999,2(5):369-374.
[4] Siddiqui M H,Whaibi M H A,Basalah M O.Role of nitric oxide in tolerance of plants to abiotic stress[J].Protoplasma,2011,248(3):447-455.
[5] Mackerness S A H,John C F,Jordan B,et al.Early signaling components in ultraviolet-B responses:distinct roles for different reactive oxygen species and nitric oxide[J].FEBS Lett,2001,489(2/3):237-242.
[6] 袁芳,杨剑超,陈敏,等.NaCl 胁迫下外源NO 供体硝普钠(SNP)对盐地碱蓬种子萌发的影响[J].植物生理学通讯,2010,46(1):24-28.
[7] 张蕊,周志春,金国庆,等.南方红豆杉种源遗传多样性和遗传分化[J].林业科学,2009,45(1):50-56.
[8] 杨逢建,庞海河,张学科,等.光胁迫对南方红豆杉叶片中叶绿体色素和紫杉醇质量分数的影响[J].植物研究,2007,27(5):556-558.
[9] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[10] Bhaduri P N,Ghosh M.Excised embryo culturing:the study of inheritance of root types in rice[J].Botanical Magazine,1965,78:348-352.
[11] 李兰芳,张魁,吴树勋,等.不同生长期白羊草中总黄酮的质量分数测定[J].中国野生植物资源,1996,23(4):37-39.
[12] 程春龙.额济纳绿洲胡杨体内酚类物质分布及其对环境变化的响应研究[D].北京:北京林业大学,2007.
[13] Zu Y G,Pang H H,Yu J H,et al.Responses in the morphology,physiology and biochemistry of Taxus chinensis var.mairei grown under supplementary UV-B radiation[J].Journal of Photochemistry and Photobiology B:Biology,2010,98(2):152-158.
[14] 敬岩,孙宝腾,符建荣.一氧化氮改善铁胁迫玉米光合组织结构及其活性[J].植物营养与肥料学报,2007,13(5):809-815.
[15] 刘建新,王金成,王瑞娟,等.外源一氧化氮对渗透胁迫下黑麦草幼苗光合和生物发光特性的影响[J].草业学报,2013,22(1):210-216.
[16] Tracewell C A,Vrettos J S,Bautista J A.Carotenoid photooxidation in photosystemⅡ[J].Archives of Biochemistry and Biophysics,2001,385(1):61-69.
[17] Quaite F E,Sutherland B M,Sutherland J C.Action spectrum for DNA damage in alfalfa lowers predicted impact of ozone depletion[J].Nature,1992,358:576-578.
[18] 吴雪霞,朱月林,朱为民,等.外源一氧化氮对NaCl 胁迫下番茄幼苗生理影响[J].中国农业科学,2006,39(3):575-581.
[19] 李德文,李美兰,于景华,等.外源NO 对UV-B 胁迫下红豆杉抗氧化系统的影响[J].生态学杂志,2012,31(9):2203-2208.
[20] 庞海河.增强UV-B 辐射下南方红豆杉形态、结构及代谢的研究[D].哈尔滨:东北林业大学,2010.
[21] Xu M J,Jin H H,Dong J F,et al.Abscisic acid plays critical role in ozone-induced taxol production of Taxus chinensis suspension cell cultures[J].Biotechnology Progress,2011,27(5):1415-1420.
[22] 徐茂军,董菊芳,朱睦元.NO 可以通过水杨酸(SA)或者茉莉酸(JA)信号途径介导真菌诱导子对粉葛悬浮细胞中葛根素生物合成的促进作用[J].中国科学:C 辑:生命科学,2006,36(1):66 -75.
[23] 郝鹤,叶和春,王红.一氧化氮对新疆紫草愈伤组织中紫草素及其衍生物合成的影响[J].中国科学院大学学报,2014,31(1):46-53.
[24] Appel H M.Phenolics in ecological interactions:The importance of oxidation[J].Journal of Chemical Ecology,1993,19(7):1521-1552.
[25] Lavola A.Accumulation of flavonoids and related compounds in birch induced by UV-B irradiance[J].Tree Physiology,1998,18(1):53-58.
[26] 李美兰,李德文,于景华,等.外源NO 对南方红豆杉幼苗光合色素及抗氧化酶的影响[J].植物研究,2013,33(1):39-44.
[27] Xu M J,Dong J E.Synergistic action between jasmonic acid and nitric oxide in inducing matrine accumulation of Sophora flavescens suspension cells[J].Journal of Integrative Plant Biology,2008,50(1):92-101.
