TK基因缺失对鸭肠炎病毒在鸡胚成纤维细胞中复制影响的评价
2015-03-08王玉龙李慧昕胡永浩刘胜旺
王玉龙,李慧昕,李 冰,胡永浩,刘胜旺,*
(1.甘肃农业大学 动物医学学院,甘肃 兰州 730070;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽传染病研究室,黑龙江 哈尔滨 150001)
鸭病毒性肠炎(Duck viral enteritis,DVE)是由鸭肠炎病毒(Duck enteritis virus,DEV)引起的鸭、鹅及多种雁型目禽类的一种急性、热性、败血性传染病。1923 年,在荷兰首次报道该病[1],随后多个国家均有该病的发生,美国多个州暴发DVE 疫情[2]。我国于1957 年首次报道该病[3],在我国各养鸭地区均有发生和流行。该病可以导致商品水禽的产蛋量下降和死亡,对野生水禽有不同的致死率[4],给养鸭业造成严重的经济损失。由于病毒呈长期潜伏感染状态,水禽可带毒长达4 年之久,给疫病的防控带来困难[5]。
DEV 为疱疹病毒科成员[6],基因组为双股线性DNA,大小约为158 kb[7],基因组庞大。其基因组中的部分基因为病毒复制非必需基因,如UL44[8]、UL41、US7-8[9]和US2[10]。疱疹病毒科所有成员的TK 基因均编码胸苷激酶,蛋白具有保守的ATP 结合基序[11]。其他疱疹病毒如单纯疱疹病毒(HSV-1)中已经报道TK 基因为病毒复制非必需基因[12],而DEV 中TK 基因是否是病毒复制非必需基因尚未见报道,因此本实验研究在DEV 中TK 基因是否是病毒复制非必需基因,TK 基因的缺失是否影响病毒的复制能力。TK 缺失重组DEV 的构建也将为以DEV 为载体的活载体疫苗的研制奠定基础。
1 材料和方法
1.1 病毒株、细胞及载体 DEV Clone-03 株由本研究室保存;E.coli 感受态细胞TG1、鸡胚成纤维细胞(CEF)由本研究室制备;pCS2+载体由清华大学庞海教授馈赠;pMD18-T 载体购自TaKaRa 公司。
1.2 主要试剂 T4 DNA 连接酶、Ex Taq DNA 聚合酶及各种限制性内切酶均购自TaKaRa 公司;基因组DNA 提取试剂盒、质粒提取试剂盒及胶回收试剂盒均购自Axygen 公司;转染试剂Fermentas Turbo-Fect 购自MBI 公司;兔抗GFP 抗体、羊抗兔IgGHRP 购自Sigma 公司。
1.3 引物设计 根据GenBank 中登录的DEV Clone-03 基因序列UL24(DQ227739)、TK(AY963569)和gH(DQ227740)序列设计引物,用于构建同源臂片段,序列如下:T1:5'-GACGTGTTGGCATCGGTT C-3';T2:5'-AAACAAATAGGGAGTAGCGAAGG-3';T4:5'-CCATGTGCAGCATTACGATGTC-3',引物由北京华大基因工程有限公司合成。
1.4 目的基因的扩增及转移载体的构建 以DEV Clone-03 基因组DNA 为模板,采用引物T1/T4 扩增含有TK 基因及其侧翼序列的片段,克隆至pMD18-T 载体中构建重组质粒pTK,并进行测序鉴定。将来自载体pCS2+的含有CMV 启动子的增强型绿色蛋白(EGFP)表达盒插入至重组质粒pTK 的HpaⅠ位点,构建转移载体pTK-EGFP。
1.5 重组病毒的构建
1.5.1 重组病毒的筛选 将转移载体pTK-EGFP 与DEV 基因组共转染CEF,待出现细胞病变(CPE)时收获培养物,经蚀斑纯化对重组病毒进行筛选和纯化,绿色荧光为重组病毒筛选标记。
1.5.2 重组病毒的PCR 鉴定 采用引物T1/T2 对蚀斑筛选的表达EGFP 的重组病毒进行PCR 鉴定,利用基因组DNA 提取试剂盒提取重组病毒基因组,同时以亲本病毒为对照,进行PCR 扩增,并对获得的片段进行测序验证。
1.5.3 重组病毒的western blot 鉴定 重组病毒以0.001 MOI 接种CEF 单层,在感染后48 h 收集细胞,同时以亲本病毒DEV Clone-03 和CEF 作为对照,以兔抗GFP 抗体为一抗(1∶5 000),以羊抗兔IgG-HRP(1∶5 000)为二抗,DAB 显色后进行western blot 鉴定。
1.6 重组病毒复制动力学 重组病毒以0.001 MOI接种于铺有CEF 单层的12 孔细胞培养板中,37 ℃孵育2 h,弃掉病毒液,加入DMEM 细胞维持液(含2 % FBS),于37 ℃5 % CO2箱中培养。分别于接种后12 h、24 h、48 h、72 h 及96 h 后收获含有病毒的细胞和上清液,每个时间点做3 个平行重复,反复冻融3 次,-20 ℃贮存备用。
将不同时间点收获的病毒液做10-1~10-6倍稀释后接种CEF,每个稀释度做8 个重复,测定各时间点收获样品的TCID50。每个时间点样品做3 次平行测定。观察CPE,连续观察7 d 后判定结果。按照Reed Muench 法计算病毒的TCID50,绘制生长曲线。同时对亲本病毒DEV Clone-03 的生长曲线进行平行测定。
1.7 重组病毒感染能力荧光强度检测 将重组病毒以0.001 MOI 接种CEF 单层,分别于感染后12 h、24 h、48 h 及72 h 采集样品,细胞经胰酶消化后,以4 %多聚甲醛固定,利用流式细胞仪检测荧光表达强度,每个时间点样品采集3 份,平行检测。同时以亲本病毒感染细胞做对照,检测表达EGFP 的细胞比率。
1.8 重组病毒遗传稳定性 将重组病毒接种于CEF细胞连续传代,荧光显微镜下观察EGFP 的表达情况,当CPE 达到80 %~90 %时收获病毒。连续传代至20 代,每5 代进行PCR 检测并在荧光显微镜下检测EGFP 的表达。
1.9 统计学分析 采用t 检验对重组病毒和亲本病毒感染后的荧光表达信号差异进行分析,使用Graphpad prism 5 软件进行分析。
2 结果
2.1 重组病毒的蚀斑筛选 将转移载体和DEV 基因组共转染CEF,转染后的重组病毒在CEF 中进行蚀斑纯化,荧光显微镜下观察,选取表达EGFP 的蚀斑进行3 轮蚀斑纯化,结果如图1 所示,经3 轮蚀斑纯化后获得纯化的表达EGFP 的重组DEV,命名为rDEVTK-EGPF。

图1 rDEVTK-EGFP 的蚀斑形态Fig.1 Morphology of the plaque of rDEVTK-EGFP
2.2 重组病毒的鉴定
2.2.1 重组病毒PCR 鉴定 采用引物T1/T2 对重组病毒进行PCR 鉴定,结果显示,亲本病毒DEV Clone-03 扩增出约1 000 bp 的片段,重组病毒可以扩增出约3 300 bp 的片段,对扩增的片段进行测序,结果表明EGFP 基因已正确插入DEV clone-03的TK 基因内部(图2)。
2.2.2 重组病毒western blot 鉴定 以兔抗GFP 抗体为一抗对重组病毒进行western blot 鉴定,结果显示在约35 ku 处能够检测到特异性条带,其大小与预期一致。而亲本病毒DEV Clone-03 和CEF 中未检测到EGFP 的表达,这一结果与荧光显微镜下绿色荧光蛋白的表达结果一致,表明EGFP 插入到DEV 基因组中后得到了正确表达(图3)。

图2 重组病毒PCR 鉴定Fig.2 Identification of recombinant virus by PCR

图3 Western blot 检测重组病毒中EGFP 的表达Fig.3 Identification of the expression of EGFP in the infected CEF of rDEVTK-EGFP by western blot
2.3 重组病毒复制动力学 将rDEVTK-EGFP 和DEV Clone-03 分别以0.001 MOI 接种于CEF 细胞,分别于不同时间收获病毒测定TCID50,并绘制生长曲线,结果显示,与亲本病毒相比,在感染后12 h~24 h,亲本病毒和重组病毒的滴度无明显差异,在感染后48 h~72 h,亲本病毒滴度和重组病毒滴度差异显著。感染后96 h,亲本病毒和重组病毒的滴度开始下降,表明二者的复制高峰在72 h(图4)。重组病毒复制动力学结果表明,重组病毒在缺失TK 基因后能够在CEF 中复制,但TK 基因缺失使其复制滴度下降。
2.4 重组病毒感染能力及荧光表达分析 采用流式细胞术对病毒感染后荧光蛋白表达的时相进行检测,结果显示,将病毒感染CEF 后各时间点的峰进行叠加,可明显观察到重组病毒感染组在感染后24 h有痕量的荧光信号,感染后48 h 荧光信号明显增加,感染后72 h 继续增加,而亲本病毒感染组无荧光信号。对病毒感染CEF 后各时间点荧光强度平均值进行检测,结果显示,感染后48 h~72 h,重组病毒感染组和亲本病毒感染组荧光强度差异极显著(p<0.01),重组病毒感染细胞比率,在感染后12 h为0.37 %,感染后24 h 为2.6 %,感染后48 h 为96.6 %,感染后72 h 为99.8 %(图5),表明在感染后24 h 病毒开始具有感染能力,48 h 病毒开始大量增殖,此时的细胞感染数量达到高峰,感染后72 h感染细胞比率仍然在增加,该结果与复制动力学结果一致。
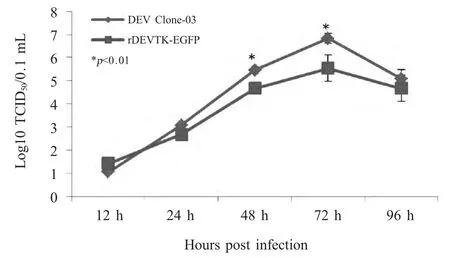
图4 rDEVTK-EGFP 一步生长曲线Fig.4 One step growth curve of rDEVTK-EGFP

图5 重组病毒荧光表达分析Fig.5 Analysis on the fluorescence of the recombinant virus
2.5 重组病毒遗传稳定性 将重组病毒在CEF 中连续传代,采用引物T1/T2 对重组病毒F5、F10、F15 及F20 代进行PCR 检测,结果显示,各代次重组病毒均能够扩增到目的片段(3 358 bp),未扩增到亲本病毒特异性片段(1 100 bp),表明EGFP 基因在重组病毒复制过程中稳定遗传,并且不存在回复突变。同时对重组病毒每5 代进行荧光检测,在荧光显微镜下观察蚀斑形态和蚀斑的荧光表达情况,结果表明,外源基因EGFP 随病毒在CEF 中的复制稳定遗传并稳定表达。
3 讨论
DEV TK基因编码胸苷激酶,是疱疹病毒的主要毒力基因。研究表明疱疹病毒TK 基因内部插入外源基因不会影响病毒的体外复制[12]。因此,本研究以DEV 为载体,以TK 基因3'端为外源基因插入位点,插入报告基因EGFP,在插入的同时造成TK基因的功能缺失,构建表达EGFP 的TK 缺失DEV。重组病毒的复制动力学研究表明,与亲本病毒相比,TK 基因缺失重组病毒的滴度下降约10 倍,其在CEF 中复制时病毒滴度的高峰和下降的时间趋势与亲本病毒一致。Wang 等构建了一系列UL44(gC)基因缺失重组DEV,与其亲本病毒相比,UL44 缺失重组DEV 滴度下降50~500 倍[8]。因此认为,尽管DEV 具有疱疹病毒共有特性,即基因组中部分基因是病毒复制非必需基因,但基因缺失还是对病毒的复制能力造成不同程度的影响。
对重组病毒表达荧光的时相和荧光强度进行检测,结果显示,感染后24 h 即检测到痕量的具有荧光信号的细胞,在感染后48 h~72 h 荧光信号明显增加,从比率上看,在感染后72 h,重组病毒感染组中具有荧光信号的细胞达99.8 %,表明重组病毒对CEF 的感染能力较好。而此时在重组病毒对CEF具有高感染能力的情况下,其病毒复制滴度与亲本病毒相比仍然下降10 倍(p<0.01),其原因尚有待于进一步研究。同时也需要检测亲本病毒和重组病毒对CEF 细胞感染能力差异,这部分工作内容将在后续工作中继续研究。本研究中将重组病毒于CEF 中连续传代至20 代,从基因水平和蛋白水平上检测其遗传稳定性,每5 代进行PCR 检测和荧光表达确认,结果表明TK 基因可以作为外源基因插入位点,携带外源基因稳定遗传,并且外源基因能够稳定表达。
DEV 的宿主谱较窄,作为活载体疫苗具有很大优势,一方面可以作为水禽疫病疫苗载体,另一方面也可用于非感染宿主如鸡,因此近年来以DEV 为疫苗载体的研究比较活跃。Liu 等以DEV 为载体构建表达禽流感病毒HA 基因重组DEV,将其免疫肉鸡,能够刺激机体产生快速免疫保护,在免疫后3 d既可抵抗H5N1 亚型高致病性禽流感病毒致死剂量的攻击,并且在免疫后采集脑、十二指肠、肝脏、法氏囊和血液等样品,检测DEV 在各组织中的复制,结果未在上述任何组织中检测到DEV 的复制[13],表明DEV 在鸡体内不进行复制。因此,从更广泛的范围来说,DEV 可作为禽用疫苗的载体,在水禽其可以同时预防两种以上水禽传染病,在非易感宿主如鸡等,其可作为非复制型疫苗载体,研制鸡用新型活载体疫苗。
[1]Baudet A E.Mortality in ducks in the Netherlands caused by afiltrable virus fowl plague[J].Tijdschr Diergeneeskd,1923,50:455-459.
[2]Campagnolo E R,Banerjee M,Panigrahy B,et al.An outbreak of duck viral enteritis(duck plague)in domestic Muscovy ducks(Cairina moschata domesticus)in Illinois[J].Avian Dis,2001,45:522-528.
[3]黄引贤.拟鸭瘟的研究[J].华南农学院学报,1959,1:1-12.
[4]Converse K A,Kidd G A.Duck plague epizootics in the United States,1967-1995[J].J Wildl Dis,2001,37:347-357.
[5]Shawky S,Schat K A.Latency sites and reactivation of duck enteritis virus[J].Avian Dis,2002,46(2):308-313.
[6]Fauquet C M,Mayo M A,Maniloff J,et al.Virus taxonomy:Eighth report of the international committee on taxonomy of viruses[M].California:Elsevier academic press,2005.
[7]Li Yu-feng,Huang Bing,Ma Xiu-li,et al.Molecular characteri-zation of the genome of duck enteritis virus[J].Virology,2009,391:151-161.
[8]Wang Ji-chun,Osterrieder N.Generation of an infectious clone of duck enteritis virus(DEV)and of a vectored DEV expressing hemagglutinin of H5N1 avian influenza virus[J].Virus Res,2011,159:23-31.
[9]Liu Jin-xiong,Chen Pu-cheng,Jiang Yong-ping,et al.A duck enteritis virus-vectored bivalent live vaccine provides fast and complete protection against H5N1 avian influenza virus infection in ducks[J].J Virol,2011,85:10989-10998.
[10]Liu Xiao-mei,Wei Shuang-wei,Liu Yan,et al.Recombinant duck enteritis virus expressing the HA gene from goose H5 subtype avian influenza virus[J].Vaccine,2013,31:5953-5959.
[11]Robertson G R,Whalley J M.Evolution of the herpes thymidine kinase:identification and comparison of the equine herpesvirus 1 thymidine kinase gene reveals similarity to a cell-encoded thymidylate kinase[J].Nucleic Acids Res,1988,16:11303-11317.
[12]Petherbridge L,Xu Hong-tao,Zhao Yu-gang,et al.Cloning of Gallid herpesvirus 3(Marek's disease virus serotype-2)genome as infectious bacterial artificial chromosomes for analysis of viral gene functions[J].J Virol Methods,2009,158:11-17.
[13]Liu Jin-xiong,Chen Pu-cheng,Jiang Yong-ping,et al.Recombinant duck enteritis virus works as a single-dose vaccine in broilers providing rapid protection against H5N1 influenza infection[J].Antiviral Res,2013,97:329-333.
