层层组装法制备仿生exosomes的研究
2015-03-08常莎莎李可欣李文攀陈大为
常莎莎, 李可欣, 罗 月, 李文攀, 陈大为
(沈阳药科大学 药学院,辽宁 沈阳 110016)
层层组装法制备仿生exosomes的研究
常莎莎, 李可欣, 罗 月, 李文攀, 陈大为*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的优化包载异硫氰酸荧光素标记的牛血清白蛋白(BSA-FITC)仿生exosomes 的处方工艺及制备。方法采用BSA-FITC作为模型蛋白,以包封率为考察指标,借助三因素三水平星点设计-效应面法对外层DOPE与内层PC质量比、组装温度、外层DOPE与DC-Chol质量比进行优化,筛选最佳处方,确定层层组装法制备对蛋白质多肽类药物具有较高包封率的仿生exosomes,并对其制剂学性质进行考察。结果优化处方为:外层DOPE与内层PC质量比为2.20∶1,内外层混合后旋转蒸发温度为58 ℃,外层DOPE与DC-Chol质量比为4.28∶1,所制得仿生exosomes的平均粒径(62.7±6.33) nm,多分散系数(P.I.)为0.286,包封率为(91.02±0.17)%。结论星点设计-效应面法所建立的模型预测性良好,成功实现了对仿生exosomes的处方优化,层层组装法成功制备了对蛋白质多肽类药物具有较高包封率且粒径较小的仿生exosomes。
药剂学;仿生exosomes;层层组装法;异硫氰酸荧光素-牛血清白蛋白;星点设计
Exosomes起源于内吞体系统,并被排出细胞外,是一类直径为40~100 nm的由脂质双层膜包裹的球体结构[1-2],含有许多与来源细胞功能相关的蛋白质或肽类[3]。由于其结构与脂质体类似,提示可以用药剂学的理论和手段人工组建具有exosomes结构性及功能性的纳米仿生exosomes作为细胞间传递信息的新型载体[4]。
蛋白质多肽类药物因其具有良好的水溶性,通常采用逆向蒸发法制备,但在完成有机溶剂蒸发的过程中,容易造成药物的泄露,使包封率降低。本实验中,作者借助层层组装的理念,选择异硫氰酸荧光素标记的牛血清白蛋白(BSA-FITC)为模型蛋白,采用层层组装法制备纳米仿生exosomes,通过灵敏度较高的荧光检测法测定包封率,并依靠三因素三水平的星点设计获得了最优处方,这为仿生exosomes的体外构建奠定了基础。
1 仪器与材料
SHZ-D循环水式真空泵、DF-101S集热式恒温加热磁力搅拌器(巩义市英峪华仪器厂),旋转蒸发仪( 上海亚荣生化仪器厂) ,JY92-2D超声波细胞粉碎机( 宁波新芝科器研究所) , WX80A涡旋混合器(上海精科实业有限公司),FA1104电子天平(上海民桥精密科学仪器有限公司),Nicomp-380激光粒度测定仪(美国Particle Sizing Systems公司), TECAN SPECTRA酶标仪(德国Wetzlar公司)。
注射用大豆磷脂(药用,PC的质量分数含量>95%,上海泰伟药业有限公司),二油酰磷脂酰乙醇胺(DOPE,上海艾韦特医药科技有限公司),O-[(N,N-二甲基氨基乙基)-氨基甲酰基]胆固醇盐酸盐(DC-Chol,爱必信生物科技有限公司) ,异硫氰酸荧光素-牛血清白蛋白(BSA-FITC,美国Sigma公司),蓖麻油聚氧乙烯35醚(Cremophor EL,德国BASF公司),琼脂糖凝胶 4B(Sepharose 4B,北京鼎国昌盛生物技术有限责任公司),其他试剂(分析纯,市售)。
2 方法与结果
2.1 层层组装法制备仿生exosomes
仿生exosomes与纳米脂质体结构相似,但粒径只有40~100 nm,因此,为了获得小粒径的制剂,本实验将微乳理念引入到仿生exosomes的制备中,分别制备了内层及外层脂质层,并最终制得了仿生exosomes。
2.1.1 内层脂质层的制备
采用伪三元相图优化油相、水相及乳化剂的比例。以Cremophor EL和PC为混合乳化剂,按照Km(mCremophorEL∶mPC)为 9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9混合均匀,乙醚为油相,在磁力搅拌下逐滴加入 BSA-FITC,观察体系由浊至清现象,记录临界点时的各组分质量分数。由图1(A)可见,在Km=3∶7和4∶6附近可得微乳区。再分别以Km为3∶7和4∶6为1个顶点,乙醚和BSA-FITC为另外2个顶点,得到乳化剂-油相-水相的三元相图(图1B、C),优选Km为3∶7。结果表明,磷脂-蓖麻油聚氧乙烯35醚-乙醚-水所制成的油包水型微乳的最佳处方质量比为4.2∶1.8∶6∶1。精密称取PC 10.0 mg和Cremophor EL 4.28 mg,加入乙醚20.0 mL使之溶解,25 ℃于磁力搅拌下滴加BSA-FITC 2.3 mL,制备W/O型内层。

Fig. 1 The pseudo-ternary phase diagram of Cremophor EL/PC/water phase (A), mCremophorEL∶mPC=4∶6(B) and mCremophorEL∶mPC=3∶7(C)图1 EL-PC-水相(A)、mCremophorEL∶mPC=4∶6(B)和mCremophorEL∶mPC=3∶7 (C)的伪三元相图
2.1.2 仿生exosomes的制备
精密称取一定比例的DOPE与DC-Chol至50 mL圆底烧瓶中,加入乙醚5.0 mL使之溶解,5 ℃减压成膜后,加入蒸馏水和乙醇体积比为2∶1的混合溶剂1.5 mL,于60 ℃水浴下水化,冰浴下200 W探头超声3 min,作为外层脂质层[5-6]。将外层加入“2.1.1”条下内层乙醚中,涡旋混合5 min后,一定温度下减压旋转蒸发除去有机溶剂,冰浴下200 W探头超声3 min,制得包载BSA-FITC的仿生exosomes,4 ℃密封保存。
2.2 仿生exosomes包封率的测定
2.2.1 标准曲线的绘制
取适量BSA-FITC用pH值7.4的磷酸盐缓冲液(PBS)溶解,并分别稀释成质量浓度分别为5、10、50、125和250 mg·L-1的系列溶液。分别取上述溶液200 μL加至黑色96孔荧光板中,用酶标仪在激发波长491 nm、发射波长520 nm条件下测定荧光强度值,以荧光强度(AFI)对BSA-FITC溶液的质量浓度(ρ)作图并进行线性回归,回归方程为AFI=0.300 3ρ-3.64×10-2(r=0.999 5),结果BSA-FITC质量浓度在5~250 mg·L-1内线性关系良好。
2.2.2 方法学考察
空白仿生exosomes回收率:精密量取空白仿生Exosomes 500 μL上样于Sepharose 4B凝胶柱的顶端,收集洗脱液。分别取上述洗脱液200 μL加至黑色96孔荧光板中,用酶标仪在激发波长491 nm、发射波长520 nm条件下分别测定荧光强度值(Am);精密量取空白仿生exosomes 500 μL,取空白仿生exosomes 200 μL加至黑色96孔荧光板中,采用相同方法测定荧光强度值(An),计算回收率(R)。结果显示,该测定方法的回收率为98.89%~99.57%,相对标准偏差(RSD)<2%,符合方法学要求。回收率计算方程如下:R=(Am/An)×100%。
2.2.3 包封率的测定
采用凝胶过滤法[7-8]测定包载 BSA-FITC仿生 exosomes的包封率。由洗脱曲线图 2可见,仿生exosomes与BSA-FITC可完全分离。经方法学考察,精密度及回收率均符合要求。精密量取“2.1”条下仿生exosomes 500 μL,上样于Sepharose 4B (20 cm× 2.5 cm)凝胶柱的顶端,以pH值7.4的磷酸盐缓冲液为洗脱液,收集流出液。代入上述标准曲线分别计算游离 BSA-FITC的质量(mf)和仿生exosomes包载BSA-FITC的质量(me),计算包封率。w(EE)=[me/(mf+ me)]×10。
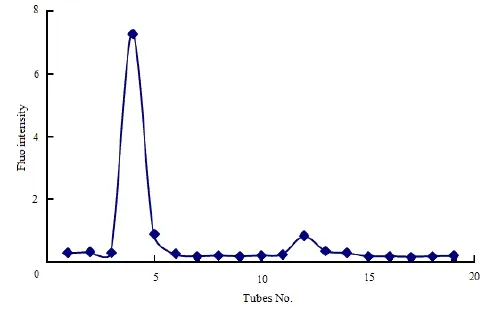
Fig. 2 The elution curves of exosomes biomimetic and free BSA-FITC through Sepharose 4B图 2 仿生exosomes和游离BSA-FITC通过Sepharose 4B分离的洗脱曲线
2.3 星点设计-效应面法优化处方
2.3.1 试验设计
在单因素考察的基础上,选取对BSA-FITC仿生exosomes包封率影响较为显著的3个因素,即:外层DOPE与内层PC的质量比(X1)、内外层混合后的旋转蒸发温度(X2),外层DOPE与DC-Chol的质量比(X3),以包封率(Y1)为考察指标进行星点设计。各因素及水平见表1,试验安排及结果见表2。

Table 1 Levels and factors used in Box-Behnken design表1 星点设计的因素和水平
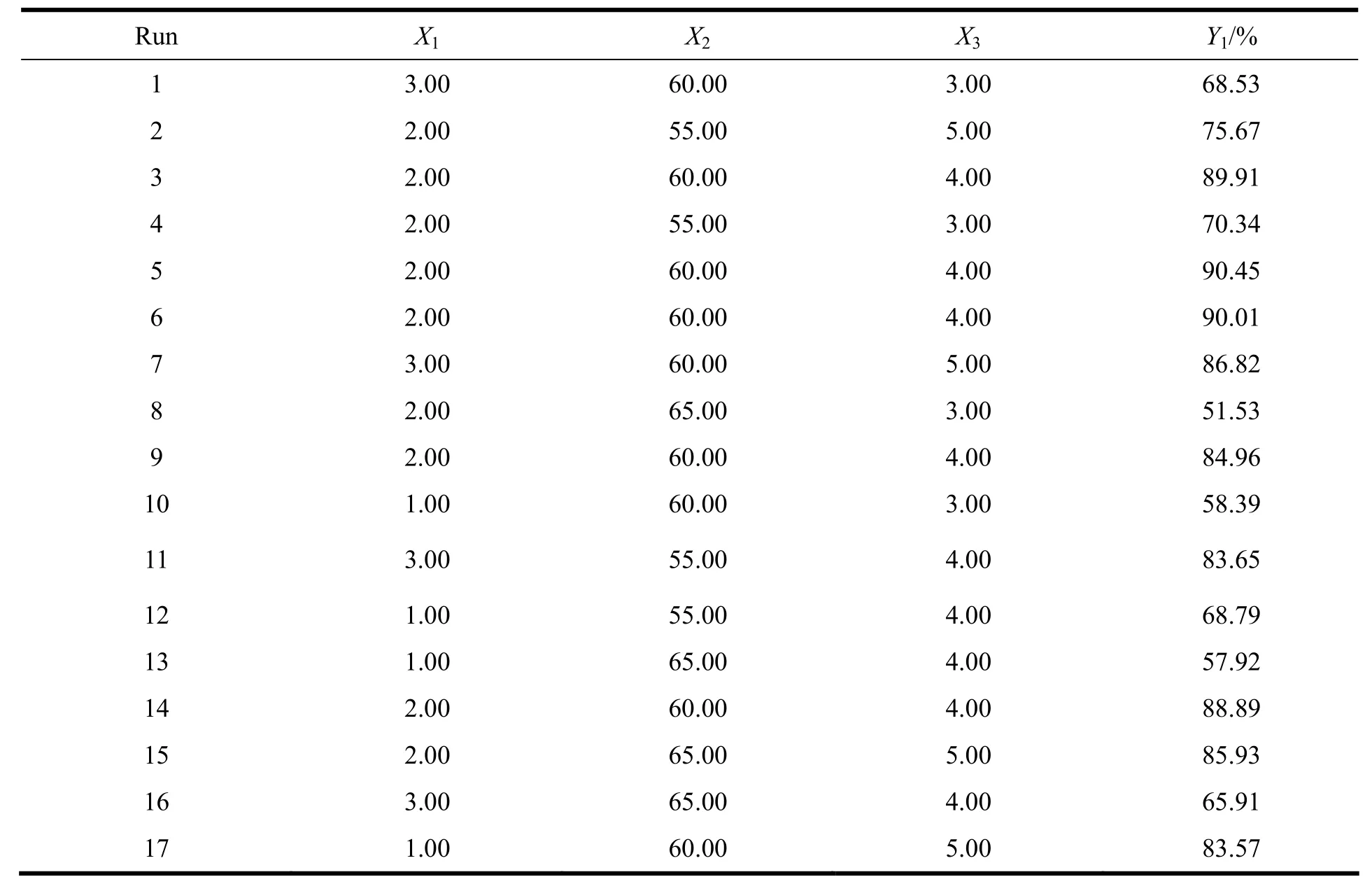
Table 2 Experimental runs and results of responses for Box-Behnken design表2 星点设计-效应面法的实验设计和结果
2.3.2 模型拟合及分析
用Design Expert8.0.6.1软件对试验结果进行模型拟合,结果表明用二次多项式拟合效果最佳,回归方程如下:
Y1%=-1 419.629+64.663X1+49.711 6X2-22.499X3-0.343 5X1X2-1.722 5X1X3+1.453 5X2X3-8.158 25X12-0.464 73X22- 6.358 25X32(P=0.000 4, r=0.984 1)。
拟合方程的相关系数说明设计模型拟合程度良好,可以用此模型对BSA-FITC的处方进行分析和预测。从表3回归系数的显著性检验可知,模型中X3(P<0.000 1)、X22(P=0.000 2)极显著,X1(P=0.007 5)、X2(P=0.006 7)、X2X3(P=0.004 0)、X12(P=0.001 9)、X32(P=0.006 9)显著,其他项不显著。
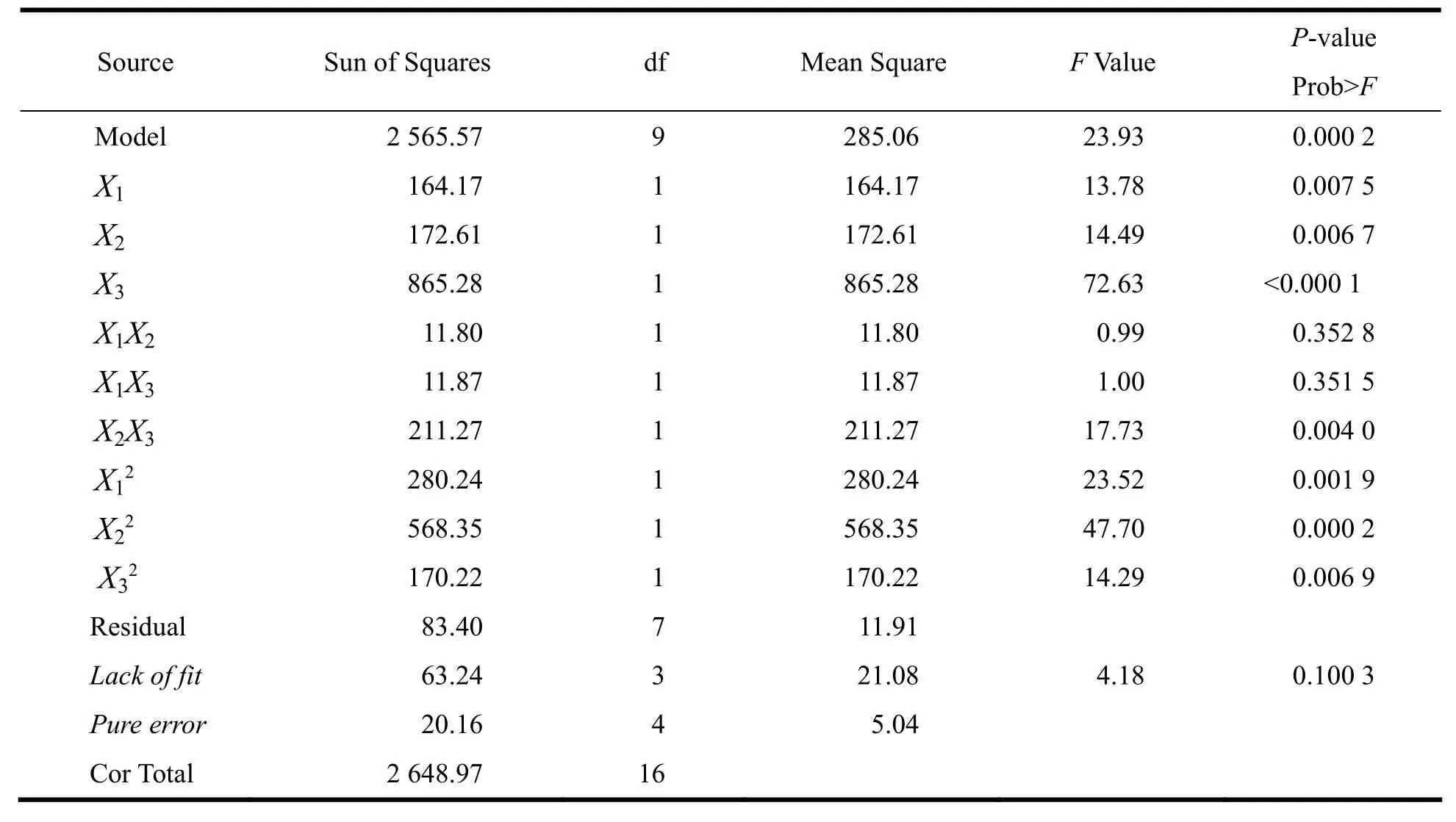
Table 3 Analysis of variance table表3 方差分析表
2.3.3 效应面分析
应用Design Expert8.0.6.1软件绘制不同影响因素对于各指标的三维曲面图,结果见图3。根据软件拟合BSA-FITC 仿生exosomes的最优处方工艺为:外层DOPE与内层PC的质量比为 2.20∶1,内外层混合后的旋转蒸发温度为58.12 ℃,外层DOPE与DC-Chol的质量比为4.28∶1,软件模型拟合计算出的包封率为91.20%。
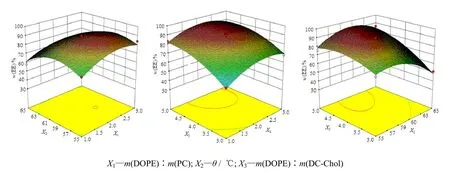
Fig. 3 3D surface response diagrams for encapsulation efficiency among representative factors图 3 各因素交互作用对包封率的3D效应面图
2.4 优化处方的验证及性质考察
2.4.1 优化处方的验证
按优化处方制备3批仿生exosomes。精密称取PC 10.0 mg和Cremophor EL 4.28 mg,加入乙醚20.0 mL使之溶解,于25 ℃磁力搅拌下滴加3 g·L-1BSA-FITC作为W/O型内层。精密称取DOPE 22.0 mg和DC-Chol 5.1 mg至50 mL圆底烧瓶中,加入乙醚5.0 mL使之溶解,25 ℃减压旋转蒸发成膜后,加入蒸馏水-乙醇(体积比2∶1)的混合溶剂1.5 mL,于60 ℃水浴下水化,冰浴下探头超声3 min(200 W),作为外层。将外层加入内层中,涡旋混合5 min,58 ℃旋转蒸发除有机溶剂,冰浴下200 W探头超声3 min,制得包载BSA-FITC的纳米仿生exosomes,平均包封率为(91.02±0.17)%,可见星点设计-效应面法预测性良好。
2.4.2 仿生exosomes的形态
取仿生exosomes适量,加水稀释后滴加在覆盖碳膜的铜网表面,以质量分数2.0%的磷钨酸负染,自然干燥后于透射电子显微镜下观察仿生exosomes形态和大小。由图 4可见,仿生exosomes具有明显的脂质双层结构,并且大小均一、形态圆整。

Fig. 4 Transmission electron micrographs (TEM) of biomimetic exosomes图 4 仿生exosomes透射电镜图
2.4.3 仿生exosomes的粒径
采用 Nicomp-380激光粒度测定仪测定仿生 exosomes 粒径大小及粒径分布(图 5)。结果BSA-FITC仿生 exosomes平均粒径为(62.70±6.33) nm,多分散系数(P.I.)为 0.286,可见制备的仿生exosomes粒径较小且分布均匀。
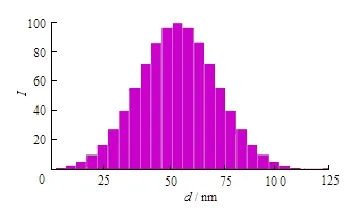
Fig. 5 Particle size distribution of biomimetic exosomes图 5 仿生exosomes 的粒度分布图
3 讨论
a. Exosomes是一类直径为40~100 nm的脂质双层球形囊泡,携带很多与来源细胞某些功能相关的蛋白质。其中,来源于肿瘤细胞的exosomes含有丰富的肿瘤抗原,在肿瘤模型中可发挥有效的免疫刺激作用,因此,成为肿瘤免疫治疗的新热点。作者根据exosomes的结构特点,采用层层组装法制备仿生exosomes,不仅获得了相似的大小,药物的包封率也达到90%以上。首先,借助伪三元相图,制得W/O型微乳作为内层脂质层,平均粒径仅为(31.30±2.3) nm,药物被包裹于微乳之中;然后,通过乙醇-水混合溶剂溶解DOPE脂质膜形成外层脂质层,DOPE分子呈锥状,头部体积较小,易于形成单层囊泡结构[13],在60 ℃水浴水化下,DOPE的脂质流动性增强,DOPE分子为了降低体系的能量将相互聚集形成亲水基向外、亲油基向内的单层囊泡,同时混合溶剂中乙醇的存在也可以阻止囊泡间的聚集,探头超声后,囊泡粒径变小,外观具有明显的淡蓝色乳光。当内、外层混合后,由于微乳中油相乙醚体积较大,因此,微乳的结构不会改变,被包裹的药物仍然存在于微乳的乳滴内,但对外层脂质囊泡来说,溶剂性质已经发生改变,其结构将发生第一次翻转,形成亲水基向内、亲油基向外的结构,随着溶剂乙醚的逐渐蒸发,体系的亲水性增强,由于DOPE与PC相比,亲水基的头部体积更小,相变温度更低,所以在58 ℃的旋转蒸发温度下,DOPE脂质膜的流动性迅速增强,随即发生第二次翻转,即DOPE的亲油基将指向W/O型微乳的疏水端,而亲水基指向外,形成具有脂质双层结构的仿生exosomes,微乳中的蛋白药物由于经过层层包封,从而提高了药物包封率。
b. Exosomes与脂质体的结构相比,粒径更小,达到了40~100 nm之间,具有很强的在各细胞间携带及传递信息的能力,其次,功能性更强,本文中选择的脂质材料DOPE为exosomes中的主要脂质成分,阳离子脂质DC-Chol的加入也提高了其与免疫细胞的结合能力,此外,其较高的蛋白包封率本身就确保了高效的抗原递送能力,这为后期肿瘤抗原的递呈及免疫细胞的高效摄取提供了有力的保障。
c. 在仿生 exosomes的包封率测定方法中,尝试过超速离心法、透析法和超滤法。但由于仿生exosomes平均粒径低于100 nm,采用超速离心法,并不能将仿生exosomes和游离药物完全分开;透析法依靠膜内外浓度差分离,在浓度梯度下会导致药物出现泄露,包封率偏低;超滤法因蛋白质多肽类药物特殊的空间结构易被超滤膜吸附和沉积,所测包封率偏高。作者采用凝胶过滤法,分离仿生exosomes和游离药物,通过测定荧光强度值测定包封率,该法不仅操作简便、快捷,而且灵敏度高、分离效果好。
[1] SUSAN M D, PIETER V, SAMIRA L. Microvesicles and exosomes: Opportunities for cell-derived membrane vesicles in drug delivery[J]. Journal of Controlled Release, 2012, 161(2), 635-644.
[2] CLAUDIA B, THOMAS T. Exosomes: New players in cell-cell communication[J]. The International Journal of Biochemistry & Cell Biology, 2012, 44, 2060-2064.
[3] ANNA-KRISTIN L, BERND G. Exosomes: Small vesicles participating in intercellular communication[J]. TheInternational Journal of Biochemistry & Cell Biology, 2012, 44, 11-15.
[4] JIN-WOOK Y, DARRELL J I, DENNIS E D. Bio-inspired, bioengineered and biomimetic drug delivery carriers[J]. Nat Rev Drug Discov, 2011, 10 (7), 521-535.
[5] FRANCIS SZOKA J R. Demetrios Papahadjopoulos. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation[J]. Biochemistry, 1978, 75(9): 4194-4198.
[6] MOKHTARIEH A A, CHEONG S, KIM S, et al. Asymmetric liposome particles with highly efficient encapsulation of siRNA and without nonspecific cell penetration suitable for target-specific delivery[J]. Biochimica et biophysicaacta, 2012, 1818: 1633-1641.
[7] MAYER L D, ONGE G S. Determination of free and liposome-associated doxorubicin and vincristine levels in plasma under equilibrium conditions employing ultrafiltration techniques[J]. Analytical Biochemistry, 1995, 232(2): 149-157.
[8] 张磊, 平其能. 口服胰岛素纳米脂质体的制备及其降血糖作用[J]. 中国药科大学学报, 2001, 32(1), 25-29.
[9] ĆURIĆ A, REUL R, MÖSCHWITZER J, et al. Formulation optimization of itraconazole loaded PEGylated liposomes for parenteral administration by using design of experiments[J]. International Journal of Pharmaceutics, 2013, 448(1): 189-197.
[10] YANG Shuo-ye, CHEN Jia-yin, ZHAO Di, et al. Comparative study on preparative methods of DC-Chol/ DOPE liposomes and formulation optimization by determining encapsulation efficiency[J]. International Journal of Pharmaceutics, 2012, 434(1): 155-160.
[11] NUTAN M T H, SOLIMAN M S, TAHA E I, et al. Optimization and characterization of controlled release multi-particulate beads coated with starch acetate[J]. International Journal of Pharmaceutics, 2005, 294(1): 89-101.
[12] PRAKASHMARAN J, MANIKANDAN S, THIRUGNANASAMBANDHAM K, et al. Box-Behnken design based statistical modeling for ultrasound-assisted extraction of corn silk polysaccharide[J]. Carbohydrate Polymers, 2013, 92(1): 604-611.
[13] RAMSTEDT B, SLOTTE J P. Membrane properties of sphingomyelins[J]. FEBS Letters, 2002, 531: 33-37.
Study on biomimetic exosomes prepared by layer-by-layer assemble methods
CHANG Sha-sha,LI Ke-xin,LUO Yue,LI Wen-pan,CHEN Da-wei*
(School of pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo optimize the formulation of BSA-FITC biomimetic exosomes. Methods Fluorescein isothiocyanate labeled bovine serum albumin was chosen as a model protein, then three factors which have major effect on encapsulation efficiency were selected to investigate, such as the ratio of outer-phase DOPE to the inner-phase PC, evaporation temperature of the mixer, and ratio of the outer-phase DOPE to DC-Chol. Box-Behnken design was applied to optimize the lipid formulation.Layer-by-layer assemble method was selected to prepare biomimetic exosomes of protein and peptide. Results The optimized experimental conditions were as follows: the mass ratio of outer-phase DOPE to the inner-phase PC was 2.20∶1; evaporation temperature of the mixer was 58 ℃ and the mass ratio of outer-phase DOPE-DC-Chol was 4.28∶1. Optimized biomimetic exosomes formulation displayed the mean particle size of (62.7±6.33) nm, the poly-dispersion index of 0.286, and encapsulation efficiency of (91.02±3.10)%. Conclusions Box-Behnken design was successfully used in the formulation optimization, and layer-by-layer assemble methods was suitable for prepare biomimetic exosomes of protein and peptide with higher encapsulation efficiency and smaller particle size.
pharmaceutics; biomimetic exosomes; layer-by-layer assemble methods; BSA-FITC; Box-Behnken design
R94
:A
(本篇责任编辑:赵桂芝)
(2015)04-0117-09
10.14146/j.cnki.cjp.2015.04.001
2014-01-08
国家自然科学基金资助项目(81302721)
常莎莎(1989-), 女(汉族), 安徽宿州人, 硕士研究生,E-mail shashashmily3@163.com; *
:陈大为(1959-) 男(汉族), 辽宁海城人, 教授, 博士, 主要从事药物新剂型的研究, Tel. 024-23986308, E-mail chendawei@syphu.edu.cn。
