光照强度对青钱柳叶形态结构、光合特性和生长的影响1)
2015-03-07邓波曹燕妮方升佐尚旭岚
邓波 曹燕妮 方升佐 尚旭岚
(南京林业大学,南京,210037)
责任编辑:潘 华。
光照是影响植物生长、发育、代谢等生理活动的最重要环境因子之一。在植物的生长发育过程中,根据其生境中可利用光照强度的大小,植物可通过调节其叶片的形态结构、光合机构的结构和组成,以及在生态学、生物化学、生物学上的一系列适应性变化来适应其特定光环境[1-5]。通常,生长于强光环境下的植物具有阳生植物的特性,而生长于弱光环境下的植物具有阴生植物的特性。强光植物的叶片往往具有发育良好的栅栏组织,更高的光合二氧化碳固定速率,更高的生物量及抗氧化物质的积累[1,3-4]。而阴生植物叶片往往呈现出较低的光合能力,但单位质量叶片上含有更多的叶绿素和更高比例的叶绿素b,其光系统II(PSII)具有更高的量子产率等[1,4-6]。植物通过其生境中光照强度大小在形态结构和功能上进行的一系列适应性调整,使得植物可以有效利用环境中的光能,增强生态适应性[2,7-9]。据我们所知,目前极少有研究将生长、光合生理、叶片形态解剖和光合器官的超微结构结合起来系统揭示植物对光照环境的生态适应性。而全面系统了解一种植物对光照强度的反应对于药用植物资源的管理和开发利用具有重要意义。
青钱柳(Cyclocarya paliurus)是我国特有的胡桃科单种属植物,主要分布于我国亚热带地区,具有材用、药用和观赏价值[10]。特别在药用保健价值上,青钱柳在中国古代就有应用历史,民间将其称为“甜茶”,在《中国中药资源志要》中也有记载[10-12]。已有的研究表明,其叶片中含有相对其他木本药用植物更高的一些生理活性成分,如三萜类、黄酮类以及多糖等[11,13-14]。但青钱柳自然资源较少,如何高效进行青钱柳资源培育是生产实践中急需解决的问题。作为一种木本药用植物,矮化及密植管理是今后栽培实践中一个可能涉及和应用的领域。因此,本试验以两根一杆青钱柳苗为对象,探讨青钱柳生长、生物量积累及分配、光合特性及光合机构的成分与结构、叶片形态及解剖结构对光环境的可塑性响应,从而在叶绿体超微结构、光合生理、生长和生物量积累等不同层面上系统阐释青钱柳苗对不同光照强度的适应机制,以期揭示木本药用植物在矮化和密植等新型栽培模式下光环境的改变对其生长和经济产量产生影响的生理生态基础,为青钱柳的栽培和集约化管理提供理论依据。
1 试验地概况
试验地位于江苏镇江扬子江苗圃基地,平均海拔20 m。该地属北亚热带湿润季风区,雨热同季,光照和热量充足。年均气温为14.1 ℃,年降水量为1 000~1 100 mm,且主要集中在6—9月,占全年降水量的60%左右,无霜期为220 d;土壤类型为砂壤土,有机质质量分数为1.77%,水解氮、有效磷、速效钾质量分数分别为77.0、14.9、132.6 mg·kg-1[12]。
2 材料与方法
2009年10月从青钱柳天然林中收集种子,并将从四川沐川单株采种的种子作为本次试验的试材。这些种子经自然风干、脱种翅等处理后,首先进行酸蚀,然后分别用赤霉素浸泡、低温层积以打破其休眠[15]。层积大约3 个月后,将萌芽的幼苗移栽到塑料杯中。待幼苗高约6 cm 时再次移栽到位于镇江苗圃的苗床上。
本试验采用单因素完全随机设计,设置3 个光照梯度,每个光照梯度设置3 个试验重复。2010年6月将苗床上的青钱柳苗移栽到试验地中,每个试验单元20 株,株行距为40 cm×50 cm。次年3月将所有植株地上3 cm 以上的部分进行截杆,以进行矮化管理。当年4月开始进行光照控制试验,试验包括(1)全光(CK);(2)70%的遮阳网遮一层(A1);(3)70%的遮阳网遮两层(A2)。遮阳网放置于地面之上2 m 的位置。试验期间,每个试验处理的光照强度用农业气象监测仪(TNHY 系列,浙江托普仪器公司)进行实时监测,同时记录空气的温度和湿度。光量子通量密度每30 min 采集一次,而空气温湿度每10 min 采集一次数据。首先计算试验期间(2010年6—10月)每月各处理白天(06:00—18:00)的平均光量子通量密度和平均空气温湿度,然后将每月平均值再次平均作为试验总体平均值,结果见表1所示。除遮阴处理和每月1 次的人工除草外,未对青钱柳苗进行额外的水肥管理。

表1 试验期间不同遮阴处理下的平均光量子通量密度和平均空气温湿度
2.1 光合和荧光参数测定
光合和荧光参数测定于2011年8月进行。首先测定各光照处理下每个植株的株高和地径,然后从每个处理中选取接近其平均值的5 株进行标记。选取所标记植株顶芽向下的第5 片复叶上的3 片完好的完全功能小叶作为测定对象,并再次进行标记。净光合速率于每天上午的09:00—11:00 用LI-6400XT 光合系统(LI-COR,Inc.,Lincoln NE,USA)在自然光条件下测定。
荧光参数用FMS2 便携脉冲调制式荧光仪(Hansatech instruments Ltd.,Norfolk,United Kingdom)对上述标记的小叶进行测定。植株暗适应30 min 后测定初始荧光Fo,经饱和脉冲照射后测得暗适应最大荧光Fm。接着打开测量光,一段时间后每隔30 s 照射一次饱和脉冲,这时测得光适应最大荧光F'm和稳态荧光Fs。关闭测量光,同时打开远红光,测量F'o。各荧光参数按以下公式计算[16]:
(1)PSII 原初光能转化效率Fv/Fm=(Fm-Fo)/Fm,
(2)PSII 量子产率QΦPSII=(F'm-Fs)/F'm,
(3)光化学猝灭系数qP=(F'm-Fs)/(F'm-F'o),
(4)非光化学猝灭系数QNP=(Fm-F'm)/F'm。
2.2 叶绿素质量分数和气孔密度测定
从测定光合和荧光参数后的植株的同一部位按单株采集新鲜小叶,洗净擦干后作为叶绿素质量分数测试样品。采用85%丙酮溶液浸提,分别在λ=663 nm 和λ=645 nm 下测定吸光度,叶绿素质量分数按以下公式计算[17]:
(1)Cchl(a)=12.7A663-2.69A645,
(2)Cchl(b)=22.9A645-4.64A663,
(3)Cchl(a+b)=20.2A645+8.02A663。
气孔密度采用印迹法,以指甲油从上述选定植株的相同部位的小叶的下表皮印取气孔痕迹,然后于光学显微镜下(放大100 倍)观察并记录视野中的气孔数量。每个处理观察3 个叶片,各取3 个视野。
2.3 叶片解剖结构和叶绿体超微结构观察
叶片解剖结构和叶绿体超微结构观察的样品均采自上述8月标记的植株。解剖结构采用石蜡切片法,首先将从小叶中部切取的样品(4 mm×6 mm)以FAA 固定液(V(70%乙醇)∶V(冰醋酸)∶V(甲醛)=18 ∶1 ∶1)固定,然后分别以乙醇梯度溶液脱水,乙醇—二甲苯梯度溶液透明后包埋于石蜡中,最后用番红—固绿对切片(8 μm)染色后在Nikon YS100 显微镜(Nikon Co.,Tokyo,Japan)下观察并拍照。叶片厚度及栅栏组织厚度用FW4000 软件进行计算。
叶绿体超微结构观察采用Gueye 等描述的方法[18]。首先将采集的新鲜小叶在4 ℃条件下分别于3%的戊二醛溶液中固定3 h,1%的四氧化锇溶液中固定24 h,然后分别对样品进行乙醇梯度溶液脱水、环氧树脂包埋、聚合、切片等处理。对超薄切片(60 nm)以2%乙酸双氧铀染色后,在HITACHI H-600 电子显微镜(HITACHI,Inc.,Tokyo,Japan)下观察并拍照。
2.4 生长测定
于2011年10月测定各处理下每株青钱柳的株高和地径,每个光照条件下的青钱柳株高和地径表示各处理试验重复的平均值。
2.5 生物量和比叶质量测定
根据10月青钱柳株高和地径测定结果,从各光照处理中选取5 株接近其平均值的青钱柳作为生物量测定的植株。所选取的植株首先进行标记,将整个植株挖出清洗后分解为根、主干、叶片3 个部分。各单株的总叶面积用AM300 便携式叶面积仪(ADC BioScientific Ltd.,Great Amwell,England)进行测定。然后将所有分解并测定叶面积后的植物材料按单株装袋,带回实验室于70 ℃下烘干至恒质量后称其质量。单株总生物量表示其根、主干和叶片的干质量总合。而单株比叶质量表示在单位叶面积上的叶片干质量。
2.6 数据分析
采用SPSS 16.0 对不同光照处理下的各指标进行方差分析,并用Duncan 新复极差法进行多重比较。
3 结果与分析
3.1 光合和荧光特性
见表2所示,不同光照处理下的青钱柳叶片除PSII 原初光能转化效率无显著差异外,净光合速率、PSII 量子产率、光化学猝灭系数和非光化学猝灭系数均有明显的差异(P<0.05)。其中,全光下(CK)青钱柳叶片的净光合速率和非光化学猝灭系数显著大于遮光处理下的叶片。而PSII 量子产率和光化学猝灭系数则随着遮光程度的加大而逐步增大,遮光叶片的这3 个荧光参数显著高于全光叶片。由此可知,叶片的光合机构对光照做出了适应性的调整,以保护光合机构或高效利用有限光能。
3.2 叶绿素质量分数和气孔密度
在青钱柳叶片对其所处光环境的适应过程中,光合膜上的叶绿素质量分数及组成也发生了显著的变化(表2)。遮阴处理增加了叶绿素总质量分数,其中两层遮阴下叶片的叶绿素质量分数显著高于全光叶片(P<0.05),遮阴叶片中还含有更高比例的叶绿素b。此外,与全光叶片的高光合速率相对应,在单位叶面积上它们还具有更多的气孔数量,以满足全光叶片的高光合二氧化碳固定速率所需的与外界环境的气体交换(表2)。
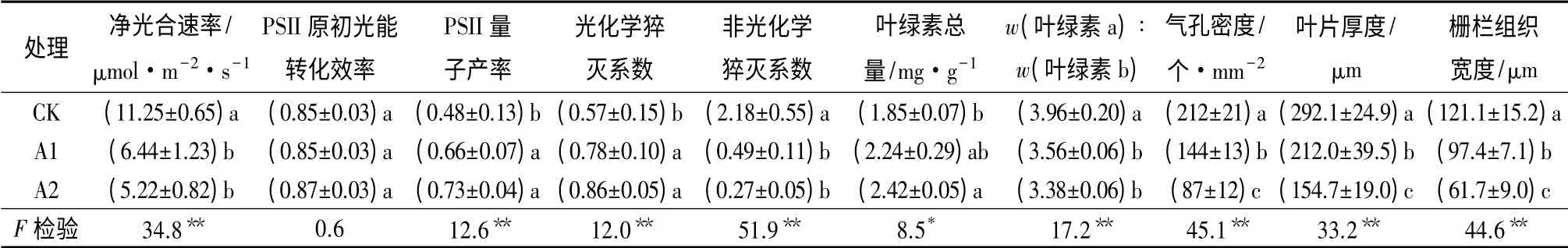
表2 不同光照条件下青钱柳的光合和荧光特性、叶片结构及叶绿素质量分数
3.3 叶片解剖结构和叶绿体超微结构
见表2和图1所示,全光和遮阴条件下,青钱柳叶片都只具有一层栅栏组织细胞。随着遮阴程度的加大,叶片厚度和叶片栅栏组织的宽度均显著减小(P<0.05),但在叶片横切面上,遮阴叶片的更多空间被栅栏组织所占据。此外,与遮阴叶片相比,全光叶片的栅栏组织排列更加紧密。
各光照处理下的叶绿体超微结构见图2所示。生长于全光条件下的青钱柳叶片具有典型的强光叶绿体,它们具有如下特征:更小但是数量更多的基粒堆、每个基粒堆中包含较少的内囊体、更高比例的基粒内囊体膜和少量的基质内囊体、更多数量的淀粉粒等。而遮阴叶片具有弱光叶绿体,它们包含相对较少的基粒内囊体,但每个基粒内囊体的堆叠度较高,还有较高比例的基质内囊体。此外,我们没有在 两层遮阴下的叶绿体中观察到淀粉粒的存在。
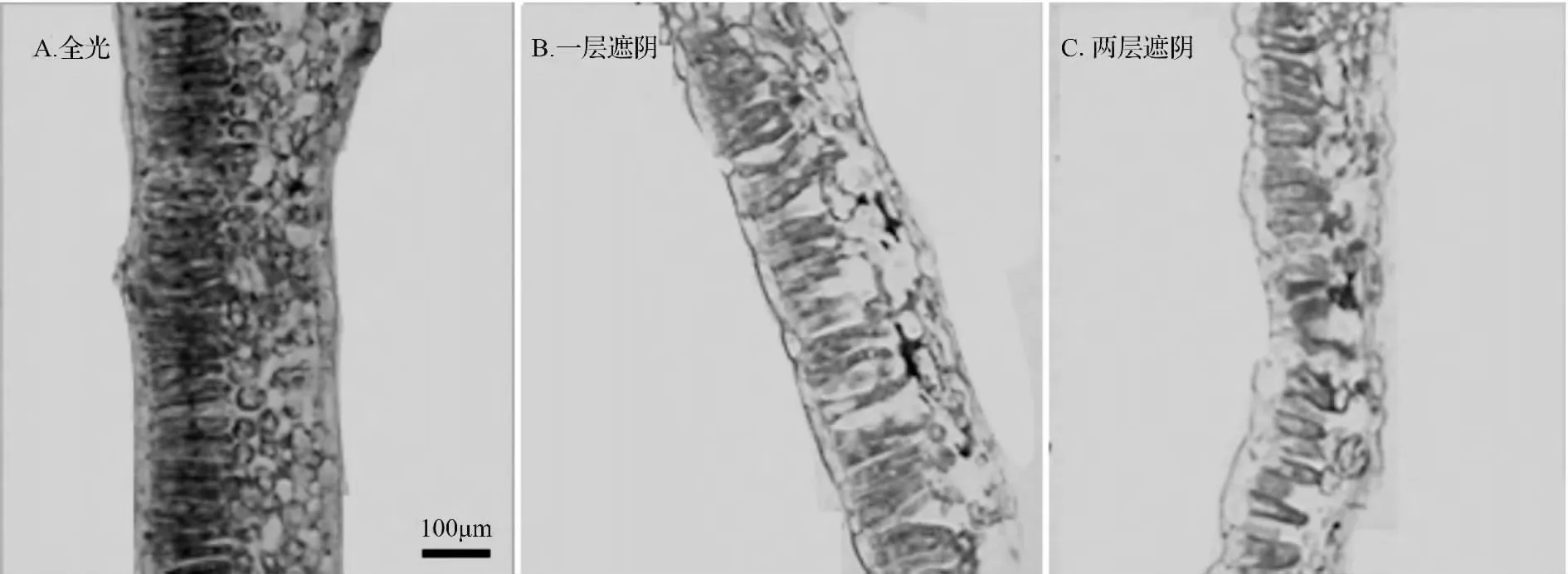
图1 不同光照条件下青钱柳叶片的横切面

图2 不同光照条件下青钱柳叶绿体超微结构
3.4 株高和地径生长
光照强度的差异诱导了光合机构在结构、组成和功能上的变异,这些变异最终在生长上得到了体现。见表3所示,不同光照处理间的株高和地径生长差异显著(P<0.05)。随着遮阴加强,地径依次明显减小,其中全光下青钱柳的平均地径分别为一层和两层遮阴的1.3 和2.5 倍。但最大株高生长在一层遮阴条件下获得,其后依次为全光和两层遮阴。不同光照强度不仅引起了青钱柳生长表现的差异,这种生长变异同样也会为植株在其特定光环境下的生长发育提供物质支撑。
3.5 生物量积累和叶面积
同株高和地径生长一样,光照强度显著影响到了青钱柳植株生物量的积累、生物量在植株各部位的分配以及叶片大小(表3)。就生物量积累而言,随着光照强度减弱,生物量依次降低。但这种下降趋势在植株的地下和地上部分表现有一定的差异。全光和遮阴一层条件下,根系生物量前者是后者的1.8 倍;而对于地上部分的主干和叶片的生物量而言,前者均为后者的1.2 倍。但当植株生长于两层遮阴条件下时,即处于严重遮阴胁迫,地下和地上部分的生物量积累与一层遮阴时的下降程度相反,这时全光下根系、主干和叶片的生物量分别是两层遮阴下的8.2 倍、12.1 倍和9.5 倍。因此,遮阴程度也会影响植株地下和地上部分生物量积累的反应。
根总生物量比和根冠比分析结果同样证实了上述植株地下和地上部分生物量积累对光照强度减弱的不同反应(表3)。在一层遮阴条件下,根系生物量与地上部分及总生物量相比都显著减小(P<0.05)。但两层遮阴条件下,根冠比甚至显著高于全光条件。对叶片生物量而言,不同光照处理没有明显改变其在总生物量中的分配比例。
此外,遮阴处理还在一定程度上增大了青钱柳叶片捕获光能的有效面积。其中一层遮阴条件下的叶面积显著大于全光条件。这种适应性变化对处于遮阴条件下的植株适应较少可利用光能具有重要意义。同时这种变化也使得比叶质量随光照强度的减弱而显著下降,说明弱光叶片更大更薄(表3)。
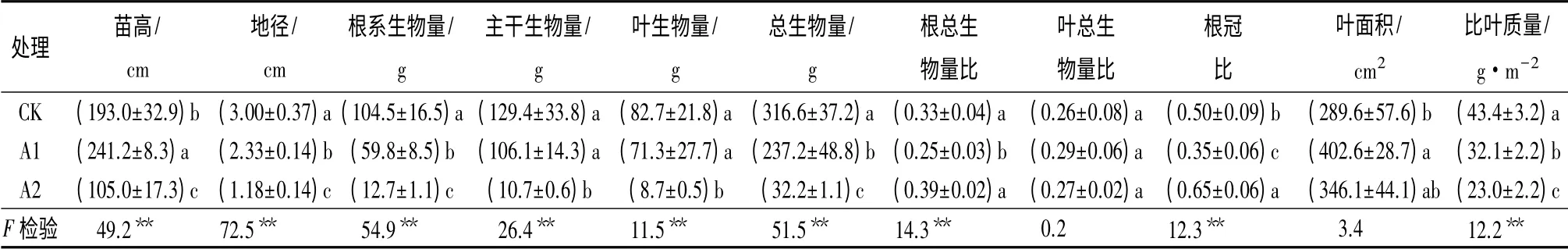
表3 不同光照条件下青钱柳的生物量积累及叶片形态特征
4 结论与讨论
许多研究已经发现,青钱柳叶中含有大量对人体具有生理活性的次生代谢物质[10,19]。但在自然环境中,青钱柳是一种高大乔木,喜光,常处于林分林冠上层,而且自然资源较少且分散[10],这些因素都对其开发利用产生不利的影响。因此,通过人工造林,并辅以矮化和密植等栽培模式来进行资源培育是打破青钱柳资源瓶颈的一个有效途径。但在以往的研究中,少有研究关注矮化及光照受限等条件对青钱柳的生长及生物量积累的影响。本研究中,我们对青钱柳在不同光照条件下的树高和地径生长,根、茎、叶的生物量积累和生物量分配,以及叶片形态和光合特征进行了分析。试验结果表明,在矮化条件下光照强度显著影响到青钱柳的生长及生物量积累,在此适应过程中,青钱柳的叶片形态、光合器官的结构与成分、光合和荧光特性都发生了相应的变化。研究结果同时也表明青钱柳能够从组织、结构、代谢以及生态习性上发生一系列变化,最终使其在特定光环境中获得相应的生态适应性。
光合作用是植物生长和物质积累的基础,本试验中全光植株的净光合速率显著高于遮阴植株,这反映了全光下叶片具有更高的CO2固定和转化的能力,并最终使全光植株获得更高的生物量积累和相对较高的生长量。相似的研究结果还在蒙古栎和白三叶幼苗中得到[20-21]。与全光植物的高光合速率相对应,其叶表单位面积的气孔数量也比遮阴叶片更高,并随光照减弱而显著下降。气孔是植物光合作用过程中与外界环境发生气体交换的通道,数量的增加可以使植物从环境中吸收更多的CO2[22]。与上述结果相反,遮阴叶片中含有更多的叶绿素及更高比例的叶绿素b,这反映了叶绿体光合膜上含有更多的捕光色素a/b 蛋白,这个变化可以使遮阴叶片在弱光环境下捕获有限的光能以进行光合作用,同时更高比例的叶绿素b 可以帮助弱光叶片更好的从弱光环境中吸收短波长的蓝紫光[1,23]。同样,虽然强光和弱光叶片在PSII 原初光能转化效率上无显著差异,但弱光叶片具有明显更高的PSII 量子产率,即弱光叶绿体的光合电子传递链可以更加高效的将吸收的光能用于光合作用。另外,光化学猝灭系数也可以说明弱光叶片具有更加高效的实际光能转化效率。光合电子传递链的这种变化使得弱光叶片可以利用有限光能,使弱光植物获得耐阴性并制造有机物质以维持其生长和发育[16,24-25]。光合系统对光照条件的这些适应性变化在棉花上也得到体现,杨兴洪等发现在强光条件下,棉花叶片的光合速率比遮阴叶片高30%~40%,但实际光化学效率明显比遮阴叶片低[26]。强光叶片具有更高的非光化学猝灭系数,这也是其对强光环境的一种适应方式。在强光条件下,为了保护光合系统不被过剩的光能所破坏,光合系统会通过非光化学途径将过剩的光能耗散掉[27]。
上述荧光参数的适应性变化在叶绿体超微结构观察中得到证实。弱光叶绿体含有较少基粒堆但每个基粒堆的堆叠度较全光下更高,整个叶绿体中几乎都被内囊体膜所充斥。在弱光条件下,这些结构特征可以保证弱光叶片更加有效的捕获和转化光能,增强弱光植株的耐阴性。另外,在强光叶绿体中存在大量的贮存性淀粉颗粒,随着光照减弱而减少并在两层遮阴条件下消失。不同光照条件下叶绿体的这种适应性改变往往是一种系统性变化的结果。叶绿体膜上PSII 和PSI 反应中心、电子载体、捕光色素及ATP 合酶的调整最终导致内囊体结构和功能的改变[2]。
除光合机构外,叶片的形态和解剖结构也发生了相应的改变。强光下叶片及其栅栏组织明显更厚,这可以为光合机构抵御强光提供机械屏障。而弱光叶片具有更大的叶面积但比叶面积明显更小,这一方面增加了弱光叶片的有效捕光面积,同时减少了在单位叶面积上所消耗干物质,以提高光能利用效率,这些变化对弱光植物适应弱光环境至关重要。之前已有研究发现,侵入性物种往往具有较本地物种更强的竞争优势,这与它们独特的叶片结构密不可分,如叶片更薄、单位叶面积上干物质更少以及能高效利用光能等[28-29]。
生长于强光下的青钱柳,与其高光合速率相一致,积累了较遮阴植株更多的生物量及相对较高的生长量,但各部分对光照的反应并不一致。已有研究发现,当光照不足时,植物会将光合作用固定的C优先分配于地上部分,从而使植株地上所占比例增大,以利于获取更多光能[30]。本研究中,一层遮阴使地下部分的根系生物量比地上部分(主干和叶片)的生物量减少的更多。由此可见,青钱柳植株地下部分的根系生物量积累对光照强度减弱的反应比其地上部分的主干和叶片更加灵敏。而两层遮阴与全光相比,结果恰好相反,这可能是由于在重度遮阴下,有限的可利用光能严重限制了地上部分的生长。上述结果与株高生长相一致,中度遮阴(一层遮阴)明显促进了株高生长,在自然条件中这可以使轻度荫蔽的植物获得竞争光能的优势,但重度遮阴则明显阻碍了株高生长,两层遮阴条件下青钱柳的株高仅为全光下的54%。
本研究中,遮阴在一定程度上限制了青钱柳的光合、地径生长和生物量积累,但提高了叶片的光能转化效率。中度遮阴(一层遮阴)显著提高了青钱柳的树高生长,却没有明显减少叶片生物量的积累。在药用青钱柳的栽培实践中,生物量尤其是叶片生物量的积累是最终获得较高目标产物经济产量的物质基础[31]。本研究表明,光照是影响生长及生物量积累的最重要环境因子之一,但在遮阴条件下,青钱柳不仅具有外部形态的可塑性,在光合生理、光合器官的成分和结构、叶片解剖结构上也发生了可塑性的变化,这些系统性的变化有利于青钱柳苗获得更多光照,适应光照不足的环境。因此,在药用青钱柳栽培过程中,通过适当的密度控制及修枝管理技术,可以达到在单位面积上收获较高的干物质。
[1] Lichtenthaler H K,Buschmann C,Doll M,et al.Photosynthetic activity,chloroplast ultrastructure,and leaf characteristics of highlight and low-light plants and of sun and shade leaves[J].Photosynthesis Research,1981,2(2):115-141.
[2] Anderson J M.Photoregulation of the composition,function,and structure of thylakoid membranes[J].Annual Review of Plant Physiology,1986,37:93-136.
[3] Myers D A,Jordan D N,Vogelmann T C.Inclination of sun and shade leaves influences chloroplast light harvesting and utilization[J].Physiologia Plantarum,1997,99(3):395-404.
[4] Johnson D M,Smith W K,Vogelmann T C,et al.Leaf architecture and direction of incident light influence mesophyll fluorescence profiles[J].American Journal of Botany,2005,92(9):1425-1431.
[5] Agati G,Stefano G,Biricolti S,et al.Mesophyll distribution of‘antioxidant’flavonoid glycosides in Ligustrum vulgare leaves under contrasting sunlight irradiance[J].Annuals of Botany,2009,104:853-861.
[6] Burritt D J,Mackenzie S.Antioxidant metabolism during acclimation of begonia×erythrophylla to high light levels[J].Annuals of Botany,2003,91(7):783-794.
[7] Anderson J M,Chow W S,Park Y.The grand design of photosynthesis:acclimation of the photosynthetic apparatus to environmental cues[J].Photosynthesis Research,1995,46(1/2):129-139.
[8] Anderson J M.Insights into the consequences of grana stacking of thylakoid membranes in vascular plants:a personal perspective[J].Australian Journal of Plant Physiology,1999,26(7):625-639.
[9] Beneragama C K,Goto K.Chlorophyll a:b ration increases under low-light in‘shade-tolerant’Euglena gracilis[J].Tropical Agricultural Research,2010,22(1):12-25.
[10] 方升佐,洑香香.青钱柳资源培育与开发利用的研究进展[J].南京林业大学学报:自然科学版,2007,31(1):95-100.
[11] 洑香香,方升佐.青钱柳次生代谢产物及其生理功能[J].安徽农业科学,2009,37(28):13612-13614.
[12] Fang S Z,Yang W X,Chu X L,et al.Provenance and temporal variations in selected flavonoids in leaves of Cyclocarya paliurus[J].Food Chemistry,2011,124(4):1382-1386.
[13] 王克全,曹莹.青钱柳化学成分及药理作用的研究进展[J].黑龙江医学,2007,31(8):577-578.
[14] 何艳,殷志琦,张建,等.青钱柳地上部分的化学成分研究[J].药学与临床研究,2012,20(3):187-189.
[15] Fang S Z,Wang J Y,Wei Z Y,et al.Methods to break seed dormancy in Cyclocarya paliurus (Batal.)Iljinskaja[J].Scientia Horticulturae,2006,110(3):305-309.
[16] Maxwell K,Johnson G N.Chlorophyll fluorescence-a practical guide[J].Journal of Experimental Botany,2000,51(3):659-668.
[17] Arnon D I.Copper enzymes in isolated chloroplasts.polyphenoloxidase in Beta vulgaris[J].Plant Physiology,1949,24(1):1-15.
[18] Gueye M L F,Pagny S,Faye L,et al.An improved chemical fixation method suitable for immunogold localization of green fluorescent protein in the golgi apparatus of tobacco bright yellow(BY-2)cells[J].Journal of Histochemistry and Cytochemistry,2003,51:931-940.
[19] Xie Jianhua,Xie Mingyong,Nie Shaoping,et al.Isolation,chemical composition and antioxidant activities of a water-soluble polysaccharide from Cyclocarya paliurus (Batal)Iljinskaja[J].Food Chemistry,2010,119(4):1626-1632.
[20] 许中旗,黄选瑞,徐成立,等.光照条件对蒙古栎幼苗生长及形态特征的影响[J].生态学报,2009,29(3):1121-1128.
[21] 安慧,上官周平.光照强度和氮水平对白三叶幼苗生长与光合生理特性的影响[J].生态学报,2009,29(11):6017-6024.
[22] Batos B,Viloti C D,Orlovi C S,et al.Inter and intra-population variation of leaf stomata traits of Quercus robur L.in northern Serbia[J].Archives of Biological Science Belgrade,2010,62(4):1125-1136.
[23] Yamazaki J,Takahisa S,Emiko M,et al.The stoichiometry and antenna size of the two photosystems in marine green algae,Bryopsis maxima and Ulva pertusa,in relation to the light environment of their natural habitat[J].Journal of Experimental Botany,2005,56:1517-1523.
[24] Takahashi K,Mineuchi K,Nakamura T,et al.A system for imaging transverse distribution of scattered light and chlorophyll fluorescence in intact rice leaves[J].Plant,Cell and Environment,1994,17(1):105-110.
[25] Vogelmann T C,Evans J R.Profiles of light absorption and chlorophyll within spinach leaves from chlorophyll fluorescence[J].Plant,Cell and Environment,2002,25(10):1303-1311.
[26] 杨兴洪,邹琦,赵世杰.遮阴和全光下生长的棉花光合作用和叶绿素荧光特征[J].植物生态学报,2005,29(1):8-15.
[27] Horton P,Ruban A V,Walters R G.Regulation of light harvesting in green plants[J].Annual Review of Plant Physiology and Plant Molecular Biology,1996,47:655-684.
[28] Maillet J,Lopez-Garcia C.What criteria are relevant for predicting the invasive capacity of a new agricultural weed?The case of invasive American species in France[J].Weed Research,2000,40(1):11-26.
[29] Smith M D,Knapp K.Physiological and morphological traits of exotic,invasive exotic and native species in tallgrass prairie[J].International Journal of Plant Sciences,2001,162(2):785-792.
[30] 霍常富,孙海龙,王政权,等.光照和氮素营养对水曲柳苗木生长及碳-氮代谢的影响[J].林业科学,2009,45(7):38-44.
[31] Deng B,Shang X L,Fang S Z,et al.Integrated effects of light intensity and fertilization on growth and flavonoid accumulation in Cyclocarya paliurus[J].Journal of Agricultural and Food Chemistry,2012,60(25):6286-6292.
