大岩桐试管花芽分化与开花影响因素
2015-03-07董璐李青
董璐 李青
(北京林业大学,北京,100083)
责任编辑:任 俐。
大岩桐为苦苣苔科大岩桐属多年生草本花卉,具有花期长、花型大、花色娇艳等特点,观赏价值及商品价值高,是人们喜爱的室内观赏花卉。但由于花期集中在夏季,一年中的观赏时间仅限于其盛花期;且大岩桐存在花前营养生长时间较长,具有自花不亲和及自交不结实现象[1]。而研发具有新颖视觉效果的大岩桐试管花卉产品,一方面,可开拓大岩桐新的观赏形式,丰富花卉商品种类;另一方面,探索出较为稳定的离体成花体系,为解决大岩桐自花不亲和、自交不结实问题的试管育种等研究工作奠定基础,对大岩桐生产及科研具有实际意义。但目前有关大岩桐试管开花研究仅报道过愈伤组织直接诱导再生花芽[2],鲜有将再生出的植株诱导花芽分化的系统研究;大部分研究集中在快繁体系和再生体系的建立[3-8]。本试验通过对大岩桐(Sinningia speciosa)进行成花诱导,研究不同因素对其试管内花芽分化的影响,探索出较为稳定高频的离体成花体系,以缩短大岩桐成花时间,摆脱季节对其花期的限制,为开发大岩桐试管花卉产品提供组织培养技术理论。
1 材料与方法
以组织培养获得的、经4 次继代,苗径约为3.5 cm 的重瓣深粉色大岩桐(Sinningia speciosa)无菌试管苗为试验材料。
不同基本培养基对大岩桐试管内花芽诱导的影响:分别以MS、WPM、B5、N6、Miller、White 为基本培养基,将生长健壮、长势一致的试管苗接种于其中,研究不同基本培养基对诱导花芽分化的影响。培养60 d 统计试管内花芽分化率。
不同细胞分裂素、生长素种类及质量浓度配比对大岩桐试管内花芽诱导的影响:以WPM 为基本培养基,添加不同质量浓度细胞分裂素6-BA(0.1、0.3、0.5 mg·L-1)、KT(0.1、0.5、1.0 mg·L-1)与不同质量浓度生长素IBA(0、0.1、0.2 mg·L-1)、NAA(0、0.1、0.2 mg·L-1)两两配比,进行完全随机区组试验。培养60 d 后,统计试管内花芽分化率。
不同无机盐质量分数与不同质量浓度6-BA、NAA、蔗糖、琼脂配比对大岩桐试管内花芽诱导的影响:采用L16(45)正交试验,研究在无机盐、6-BA、NAA、蔗糖、琼脂5 个因子共同存在的条件下,不同水平配比对诱导大岩桐花芽分化的影响。培养60 d 后统计试管内花芽分化率。正交设计因子 水平见表1。
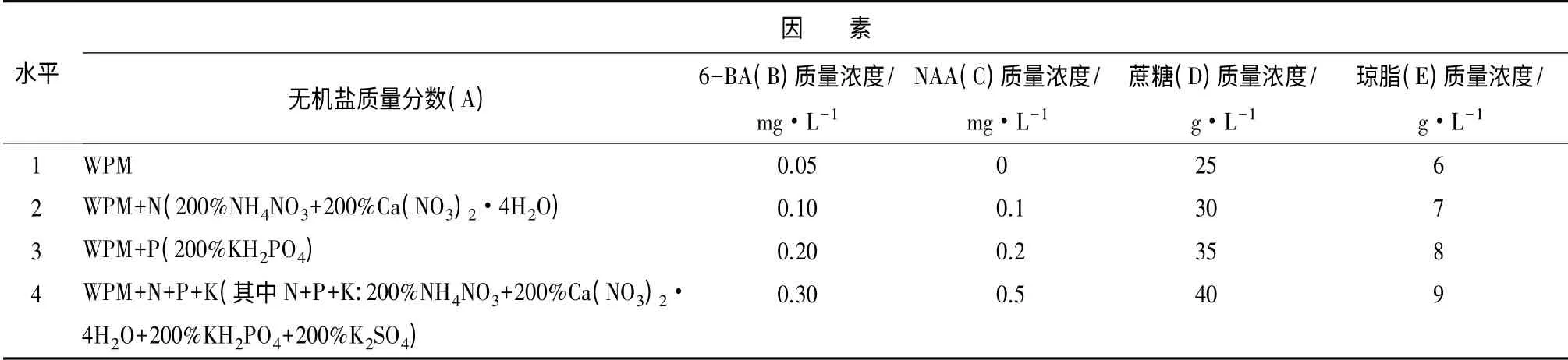
表1 正交设计因子水平
不同质量浓度赤霉素对大岩桐试管内花芽诱导的影响:设置添加不同质量浓度赤霉素(0.1、0.5、1.0、2.0、5.0 mg·L-1),以不添加赤霉素作对照,培养60 d 后统计试管内花芽分化率。
不同苗径对大岩桐试管内花芽诱导的影响:将苗径分别为1.5、2.0、2.5、3.0、3.5、4.0、4.5 cm 的试管苗,转接到诱导花芽分化的培养基上,以研究不同苗径对大岩桐试管内花芽诱导的影响。培养60 d,统计试管内花芽分化率。
培养条件:每个处理pH 值调至6.0。培养温度为(24±2)℃,光照强度2 000~3 000 lx,光照时间14 h·d-1。
数据统计:花芽分化率=花芽数/总试管苗数×100%。每个处理6 瓶,每瓶3 株试管苗,重复3 次。用SPSS 软件对数据进行方差分析,用LSD 法进行多重比较,检验各影响因素的差异显著性(P≤0.05)。
2 结果与分析
2.1 不同基本培养基对大岩桐试管内花芽诱导的影响
培养基的种类及成分直接影响所培养的植物的生长,其中的基本营养元素对诱导植物花芽分化作用不同,所以选择适宜的培养基极其重要。将生长健壮、长势一致,苗径约3.5 cm 的试管苗接种于不同基本培养基中,培养60 d 后统计试管内花芽分化率,试验结果见表2。
不同基本培养基中,大量元素、微量元素、有机化合物、铁盐等成分及质量分数不同,设置的6 种基本培养基各自特点不同:MS 为高盐成分培养基,即其钾盐、铵盐及硝酸盐质量分数均较高,微量元素种类齐全;B5、N6 为硝酸钾质量分数较高的培养基,其中B5 含有较低质量分数的铵态氮;Miller 与WPM 为中等无机盐质量分数的培养基,其中Mn 的质量分数较高;White 为低质量分数无机盐培养基。对花芽分化率进行方差分析和多重比较,对营养状态相同的大岩桐花芽分化的促进效果由大到小的顺序为WPM、N6、B5、MS、Miller、White。大岩桐在WPM 与N6 基本培养基中,花芽分化率显著高于其他基本培养基中的花芽分化率;两者相比较虽差异不显著,但WPM 基本培养基中平均花芽分化率最高,达29.63%,且长势健壮良好,叶片舒展;而N6基本培养基中平均花芽分化率为24.07%,叶片略皱缩,长势不及WPM(表2)。综上所述,WPM 是适宜大岩桐诱导花芽分化,且保证长势健壮的基本培养基。
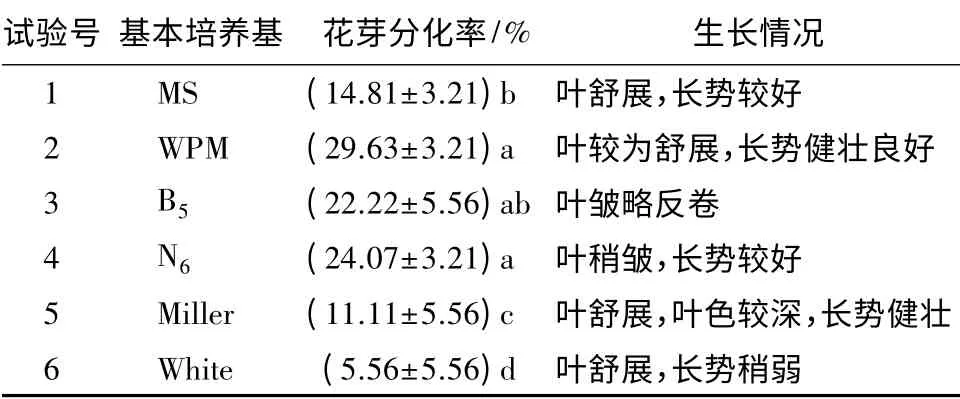
表2 不同基本培养基对大岩桐花芽诱导的影响
2.2 不同细胞分裂素、生长素种类及质量浓度配比对大岩桐试管内花芽诱导的影响
植物的离体培养中,外源激素的调控对器官的形成、生长极为重要,尤其细胞分裂素在离体花的形成过程中起十分重要的作用。将生长健壮、苗高一致的无菌苗接种到附加有不同细胞分裂素、生长素种类及质量浓度配比组合的培养基上,结果见表3。
由表3可知,所有试验组植株花芽分化率、苗高与生长情况不同。对6-BA、KT、IBA、NAA 作单因子多重比较,发现6-BA 与NAA 对大岩桐花芽分化率与苗高的影响均差异显著,而KT 与IBA 的质量浓度变化对诱导大岩桐花芽分化与苗高基本无影响,结果见表4。
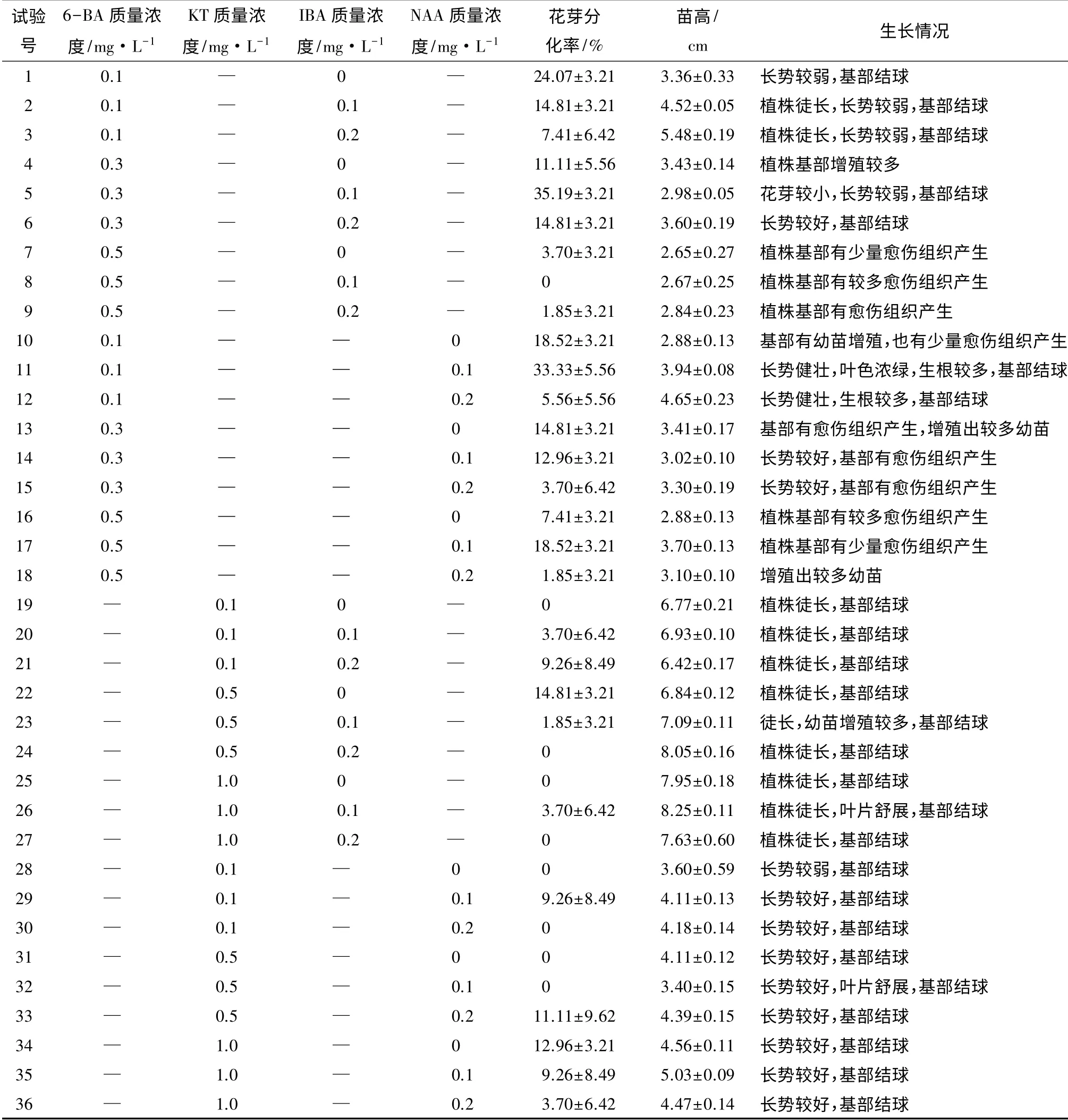
表3 不同种类及质量浓度细胞分裂素、生长素配比对大岩桐花芽诱导的影响
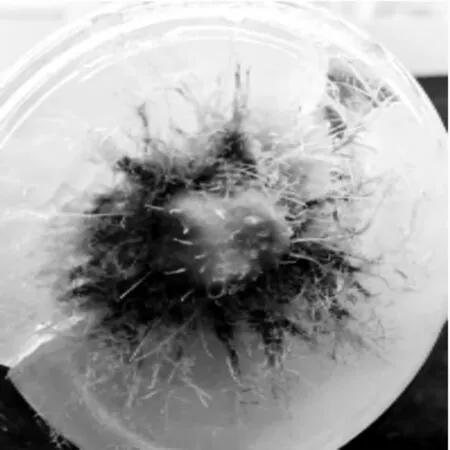
图1 大岩桐试管结球现象
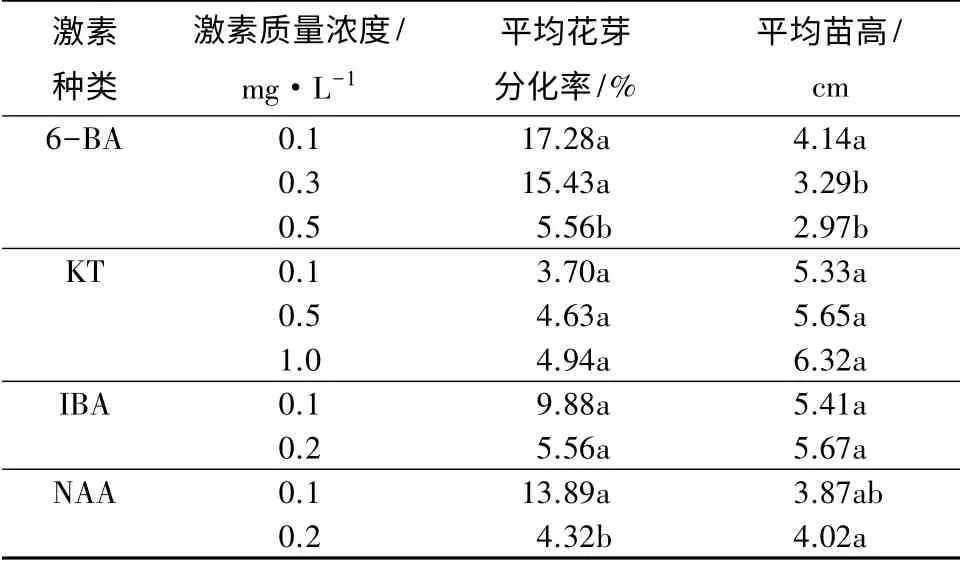
表4 6-BA、KT、IBA、NAA 对花芽分化率影响的单因子多重比较
6-BA 各质量浓度水平的多重比较结果表明,随着6-BA 质量浓度的升高,大岩桐花芽分化率与苗高均呈下降趋势,说明过高的6-BA 质量浓度不利于大岩桐试管苗花芽分化与长高。当6-BA 质量浓度为0.1 mg·L-1时,大岩桐的平均花芽分化率最高,达17.28%,此时平均苗高为4.14 cm。而大岩桐在KT 作用下,花芽分化率较低,试管苗出现徒长现象,其质量浓度变化对诱导花芽分化与苗高影响差异不显著。所以6-BA 与KT 相比较,6-BA 是诱导大岩桐分化与生长适宜的细胞分裂素。
生长素IBA 的质量浓度变化对大岩桐的苗高与花芽诱导率影响差异均不显著,且在其作用下,植株有徒长趋势。而NAA 各质量浓度水平的多重比较结果表明,随着NAA 质量浓度的升高,大岩桐试管苗苗高呈上升趋势,而花芽诱导率呈下降趋势,说明在一定质量浓度范围内(0.1~0.2 mg·L-1),较高质量浓度的NAA 能促进大岩桐长高,但不利于诱导大岩桐试管苗花芽分化。当NAA 质量浓度为0.1 mg·L-1时,大岩桐平均花芽诱导率较高,为13.89%,此时平均苗高较高,为3.87 cm。
大岩桐试管苗在6-BA 与IBA 配比作用下,整体长势较弱,偶有徒长现象,植株基部除有愈伤组织产生,或出现丛生芽增殖较多的情况外,基部均有结球(图1);在6-BA 与NAA 作用下,试管苗整体长势较好,部分试验组植株基部产生愈伤组织,其余试验组植株基部结球。KT 无论与何种生长素(IBA 或NAA)配比作用,所有试管苗基部均结球,但不同培养基上结球情况不同,出现一株结多球、球茎大小不一、球茎上长根等现象。其中KT 与NAA 组合,植株整体长势较好;而与IBA 组合时,植株整体徒长,且长势较弱。
综上所述,细胞分裂素6-BA 与生长素NAA 配比适宜诱导大岩桐试管苗花芽分化。添加0.1 mg·L-16-BA,与0.1 mg·L-1NAA,平均花芽分化率最高,为33.33%。
2.3 不同无机盐质量分数与不同6-BA、NAA、蔗糖、琼脂质量浓度配比对大岩桐试管内花芽诱导的影响
将生长健壮、长势一致的试管苗转接到不同无机盐质量分数与不同6-BA、NAA、蔗糖、琼脂质量浓度的正交设计培养基上,培养60 d,试验结果见表5。

表5 不同无机盐质量分数与不同6-BA、NAA、蔗糖、琼脂质量浓度配比对花芽诱导的影响
由表5可知,各处理中试管苗花芽分化率及长势不同,试验组虽有较高的花芽分化率,但有较多花芽败育。大岩桐在4 号培养基WPM+6-BA0.30 mg·L-1+NAA0.20 mg·L-1+40 g·L-1蔗糖+9 g·L-1琼脂中,平均花芽分化率最高,为48.15%,此时植株长势健壮良好,花芽饱满(图2),后期花芽开放正常(图3)。对花芽分化率进行极差分析,结果见表6。
由表6极差分析结果可知,D 因素(蔗糖)的极差最大,为35.65;其次是C 因素(NAA),极差为15.74;A 因素(无机盐)与E 因素(琼脂)的极差相同,均为14.81;B 因素(6-BA)的极差最小,仅为5.09。说明不同因素水平变化对大岩桐花芽分化率的影响由大到小依次为蔗糖,NAA,无机盐、琼脂,6-BA。
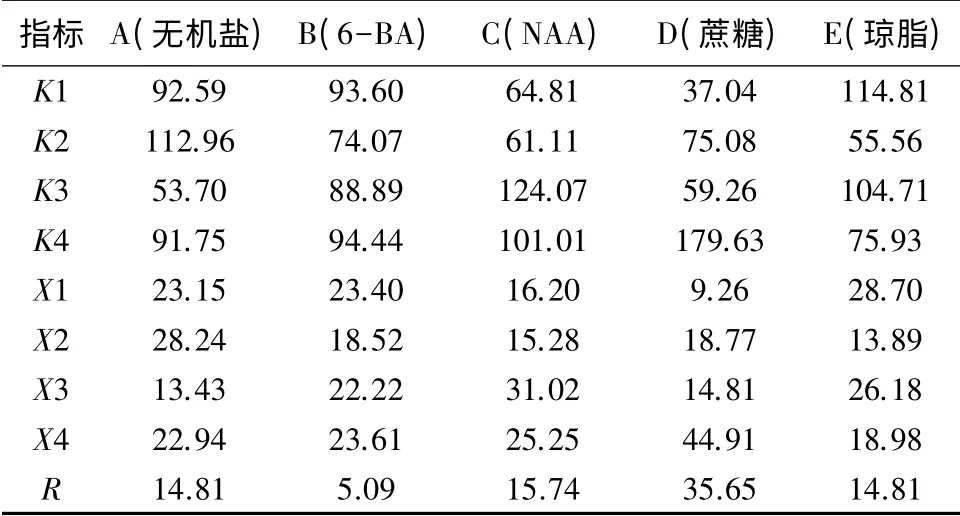
表6 极差分析

图2 适宜培养基上诱导出饱满花芽

图3 饱满花芽正常开放
D 因素的极差值最大,表明在所试验的5 个因素中,蔗糖的质量浓度变化对大岩桐花芽分化率影响最大,随蔗糖质量浓度的升高,花芽分化率整体呈现先上升的变化趋势,当蔗糖质量浓度为40 g·L-1时,平均花芽分化率最高,为44.91%,显著高于其他质量浓度作用下的花芽分化率。
C 因素极差次之,表明NAA 质量浓度变化对大岩桐花芽分化率影响较大。随NAA 质量浓度升高,大岩桐花芽分化率整体呈现先上升后下降的趋势,添加NAA0.1 mg·L-1时,平均花芽分化率最高,为31.02%。
A 因素与E 因素极差值相同,说明无机盐质量分数变化对大岩桐花芽分化率的影响,与琼脂的质量浓度变化对花芽分化的影响差异不显著。从平均值看,无机盐质量分数以第二水平最好,即WPM+N(WPM 大量元素中NH4NO3与Ca(NO3)2·4H2O 质量分数加倍),此时平均花芽分化率最高,为28.24%;而琼脂质量浓度以第一水平最好,即添加6 g·L-1质量浓度的琼脂,平均花芽分化率最高,为28.70%。
B 因素6-BA 质量浓度变化对大岩桐花芽分化率影响最小。除在质量浓度为1 mg·L-1时,大岩桐平均花芽分化率下降,为18.52%外,在其他质量浓度作用下,花芽分化率无明显变化趋势,且两两比较,差异不显著。从平均值看,以第4 水平,即添加0.3 mg·L-1质量浓度6-BA,平均花芽分化率最高,为23.61%。
因此,当无机盐、6-BA、NAA、蔗糖、琼脂5 个因素同时存在时,提高大岩桐花芽分化率的理论培养基为WPM+N+6-BA0.30 mg·L-1+NAA0.10 mg·L-1+40 g·L-1蔗糖+6 g·L-1琼脂。但植株长势及花芽状态可能受到培养基中各因素在不同水平的交互作用影响,此培养基是否适宜大岩桐花芽分化还需进一步验证试验。
综上所述,由试验筛选出,WPM+6-BA0.30 mg·L-1+NAA0.20 mg·L-1+40 g·L-1蔗糖+9 g·L-1琼脂为适宜大岩桐花芽分化的培养基,此时试管苗花芽分化率较高,且保证植株长势健壮良好,花芽饱满。
2.4 不同质量浓度赤霉素对大岩桐试管内花芽诱导的影响
赤霉素可替代低温和长日照作用,以诱导有些长日照植物在短日照条件下开花。以不添加赤霉素作对照,设置不同质量浓度(0.1、0.5、1.0、2.0、5.0 mg·L-1),培养60 d 后统计试管内花芽分化率,试验结果见表7。
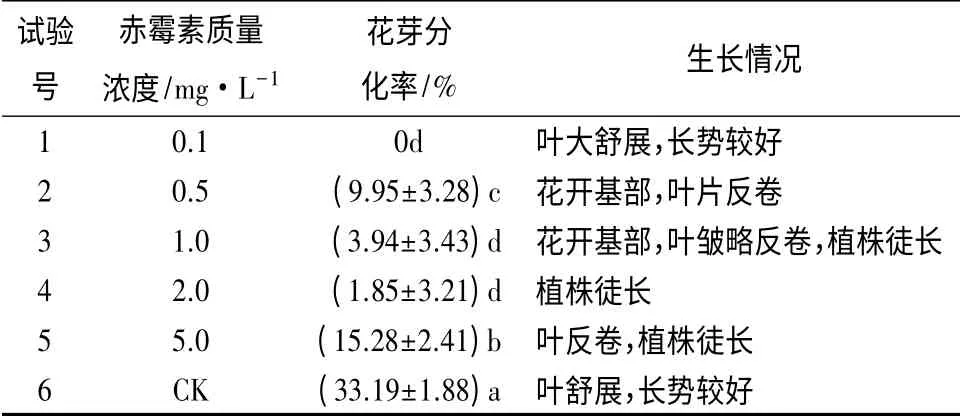
表7 不同质量浓度赤霉素对花芽诱导的影响
对结果进行方差分析可知,当添加有赤霉素时,随赤霉素质量浓度升高,大岩桐花芽分化率呈上升趋势,但植株长势变弱,且趋于徒长。在低质量浓度(0.5~1.0 mg·L-1)作用下,大岩桐花芽在植株基部分化,无花梗,花芽较小,但花色红艳,后期开放时花瓣呈单瓣(图4)。而当赤霉素质量浓度上升至5.0 mg·L-1时,平均花芽分化率较高,为15.28%,此时花芽较大,具花梗,但植株与花梗明显徒长。而对照组不添加赤霉素时的平均花芽分化率为33.19%,显著高于所有添加赤霉素的试验组,且植株长势健壮良好,叶片舒展。因此,以不添加赤霉素对诱导大岩桐花芽分化较为有利。
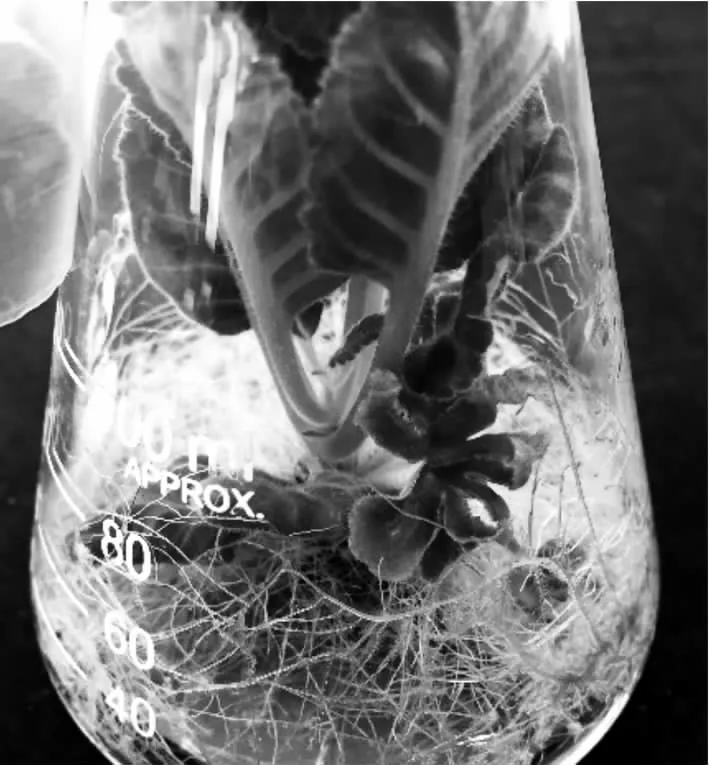
图4 赤霉素作用下植株徒长,花开基部,花瓣单瓣
2.5 不同苗径对大岩桐试管内花芽诱导的影响
苗茎大小作为植物生长的指标,可一定程度上代表植株体内营养物质存贮状况。将不同苗径的试管苗接种到培养基中,培养60 d,试验结果见表8。

表8 不同苗径对花芽诱导的影响
对结果进行方差分析,大岩桐试管苗的苗径大小对其试管内花芽诱导影响显著。试管苗苗径小于3.0 cm 时,植株无花芽分化现象;当试管苗苗径为3.0 cm 时,渐有花芽分化,但此时平均花芽分化率较低,仅为1.75%;苗径大于3.0 cm 时,花芽分化率随苗径增大而增多,苗径为4.5 cm 的试管苗,平均花芽分化率最高,为31.94%,与苗径为4.0 cm 的试管苗平均花芽分化率29.74%相比,差异不显著;而苗径为3.5 cm 的平均花芽分化率为28.94%,又与4.0 cm 的花芽分化率差异不显著。由此得出结论,大岩桐植株的苗径大小影响花芽分化,3.0 cm 的苗径大小是其营养生长向生殖生长转化的临界条件;达到临界条件后,花芽分化率随苗径增加而逐渐增多。
3 结论与讨论
诱导不同种类植物试管开花时所需要的培养基各异,植株只有在适宜的营养状态、适宜的激素调控以及适宜的培养条件下才能诱导花芽分化、花器官的形成。所以探究培养基种类及其组成成分极其必要及重要。
植物必需的矿质元素对植物生长发育各个阶段影响差异显著。大岩桐常规栽培养护,常在生殖生长时,在原营养液配方的基础上适量加大磷、钾肥比例,再添加硼、镁、锰等微量元素,以利开花。研究发现,Mn 质量分数较高的中等无机盐培养基WPM,对诱导大岩桐试管内花芽分化效果最佳,其次为硝酸钾质量分数较高的N6 和B5 培养基,低无机盐培养基White 效果最差。结果与常规养护方法基本一致,同时得出,适量增加微量元素,较增加大量元素更利于成花。
研究发现,在无机盐、细胞分裂素6-BA、生长素NAA、蔗糖和琼脂的共同作用下,对诱导大岩桐花芽诱导影响由大到小的顺序为蔗糖,NAA,无机盐、琼脂,6-BA。蔗糖质量浓度对大岩桐花芽诱导率影响最为显著。糖在培养基中,为植物提供碳源,影响植物体内营养物质的运输和积累,进而影响营养生长和生殖生长。研究发现,不同蔗糖质量浓度,对诱导植物试管内花芽分化效果不同,以添加40 g·L-1质量浓度,诱导大岩桐花芽分化效果最佳。
外源激素在组织培养中调控着植物器官的发生与发育,开花基因的表达同样也会受到激素的影响。本试验中,细胞分裂素6-BA 与KT 相比较,6-BA是诱导大岩桐分化与生长适宜的细胞分裂素,且添加低质量浓度较为适宜,与大部分试管开花研究报道一致[2-5]。生长素NAA 较IBA,添加低质量浓度有利于大岩桐花芽分化,较高质量浓度NAA 抑制花芽的形成。分析可能原因,一方面低质量浓度的NAA 提高了某些能促进成花的内源激素的质量浓度[4],另一方面,较高质量浓度的外源激素刺激植物细胞处于高速分裂的状态,促使植物细胞不断生长,难以诱导细胞分化,即花芽分化。
试管开花研究中,常降低培养基中N 的质量分数[9-18],或提高P 的质量分数[9,11,19],以提高花芽诱导率;而栽培中常在大岩桐花前增施P、K 肥,以提高开花质量,增加开花数量[20]。试验中通过改变基本培养基中大量元素N、P、K 质量分数(即无机盐的质量分数),间接起到对植株增施肥的效果。试验结果显示,在基本培养基的基础上单独加倍P、K质量分数,植株长势健壮,但基部增殖多,花芽分化受到抑制;而同时加倍N、P、K 质量分数,或单独加倍N 质量分数,或不改变基本培养基无机盐质量分数,对诱导大岩桐花芽分化较为有利,与前人试验结果及盆栽的养护方法有差异,分析原因,可能是由于N 质量分数的相对降低,致使植物对大量元素吸收不平衡,影响了植物体内营养物质的贮存,不能及时充分供给花芽分化时所需养分,从而抑制了花芽分化。
赤霉素有促进发芽、枝叶生长、提早开花结果等作用,对植物的影响贯穿整个生命周期中的各个发育进程[21],有研究表明,赤霉素对雄蕊和花瓣发育很重要[22]。本试验研究结果显示,添加赤霉素,不能提高大岩桐花芽诱导率;高质量浓度赤霉素较低质量浓度的有利于提高花芽诱导率,增加成花数量,但植株徒长,长势弱。但添加赤霉素的试验组,花芽后期能正常开放,且花色红艳。杭州师范大学通过赤霉素和细胞分裂素协同作用,建立起离体大岩桐花被切块直接再生花芽的体系,同时用酶联免疫方法测定出花器官中的赤霉素质量浓度水平持续增加,高于营养器官中的赤霉素质量浓度[23]。结合前人研究,得出施加外源赤霉素确实能够促进诱导大岩桐花芽分化。而添加赤霉素的花芽诱导率低于不添加的诱导率,可能原因是具一定苗径大小的试管苗,已完成营养生长,可以自主成花诱导途径向生殖生长转变,此时添加不适宜质量浓度的赤霉素,会影响相关成花基因的表达,同时起到促进茎叶生长的作用,从而表现出无花芽分化,植株徒长的现象。所以,赤霉素在植株不同生理状态时作用,可能存在不同机制,还有待进一步研究。但在完成花芽诱导后,可考虑添加赤霉素,以提高成花品质。
常规栽培中,大岩桐以自主途径完成花芽诱导,即其植株要达到一定的年龄才能开花,否则将促进开花阻抑物基因的表达而不能开花。在花芽诱导试验过程中发现,培养基中各成分的种类或质量浓度变化仅对花芽诱导率有影响,并无培养基中不可或缺的绝对成分,适宜的培养基成分能使大岩桐试管苗有较高的花芽诱导率;而大岩桐试管苗的大小(即自身营养状态)直接影响其是否能够分化花芽,是诱导其花芽分化的必要条件。植株的营养状态对试管内花芽诱导有影响,其基本原理是植物体内的一些化合物种类,如脯氨酸等能与激素类共同作用以诱导开花[24],而处在不同生理阶段的植物体内所含化合物种类及质量浓度不同。近年的研究中发现,在相同增殖培养基上培养得到的不同高度的试管苗,可能由于所处的生理状态或生理阶段不同,花芽诱导率有差异[10]。本试验中,以苗径作为衡量植株营养状态的指标进行研究,发现3.0 cm 的苗径大小是大岩桐由营养生长向生殖生长转化的临界条件,之后随苗径的增加,花芽诱导率增多。分析原因,可能不同苗径的植株,所处营养状态的不同,苗径>3.0 cm 的大岩桐试管苗,植株体内的化合物种类与内源激素水平与外源激素共同作用,有利于促进成花基因的表达。
总之,WPM 是适宜大岩桐诱导花芽分化,且保证长势健壮的基本培养基;细胞分裂素6-BA 与生长素NAA 配比适宜诱导大岩桐试管苗花芽分化;在WPM 的基础上,增加N、P、K 质量分数,或增加N质量分数,或不改变基本培养基无机盐质量分数,对提高大岩桐花芽分化率较为有利;诱导大岩桐试管内花芽分化的适宜培养基为WPM+6-BA0.30 mg·L-1+NAA0.20 mg·L-1+40 g·L-1蔗糖+9 g·L-1琼脂;赤霉素不利于健壮生长。3.0 cm 的苗径大小是大岩桐营养生长向生殖生长转化的临界条件,达到临界条件后,花芽分化率随苗径增加而逐渐增多。
[1] 周鍾信,李建科,朱惠珍,等.大岩桐开花生物学的观察及快繁技术的研究[J].天津农学院学报,1998,5(2):1-8.
[2] 庞基良,王利琳,胡江琴,等.赤霉素对大岩桐花蕾离体培养直接再生花芽的影响[J].实验生物学报,2004,37(3):241-246.
[3] 邵果园,梁国鲁,王力超,等.大岩桐快繁体系优化研究[J].西南大学学报:自然科学版,2007,29(4):127-130.
[4] 戴黎鸣,周伟,陈军峰,等.影响大岩桐试管块茎形成的若干因素[J].上海师范大学学报:自然科学版,2006,35(5):71-75.
[5] 朱苏文,马庆,刘康武.植物激素对大岩桐愈伤组织诱导和芽分化增殖的影响[J].激光生物学报,2006,15(4):394-398.
[6] 王树耀,黄白红.大岩桐的组培快繁技术研究[J].湖南文理学院学报:自然科学版,2004(1):43-44.
[7] 王家远,罗荣芬,周大刚,等.大岩桐叶柄诱导再生植株[J].贵州师范大学学报:自然科学版,2004,22(4):19-21.
[8] 秦廷豪,邹宗兰,饶晓鸿,等.重瓣大岩桐的快速繁殖及其产业化技术程序[J].植物生理学通讯,2002,38(4):313-316.
[9] 孙朝辉,龙美珍,段秀梅,等.'香槟'月季的组织培养和试管开花诱导[J].植物生理学报,2013,49(11):1261-1266.
[10] Zeng S,Liang S,Zhang Y Y,et al.In vitro flowering red miniature rose[J].Biologia Plantarum,2013,57(3):401-409.
[11] 周俊辉,杨寅桂,刘义存,等.微型月季的试管开花诱导研究[J].江西农业大学学报,2008,30(3):504-508.
[12] 褚剑峰,郑琪,孙叶芳,等.玫瑰试管花技术研究及商品化生产[J].上海农业学报,2008,24(1):130-132.
[13] 冯莹.石斛兰ACS 反义基因的遗传转化及离体开花的研究[D].福州:福建农林大学,2008.
[14] 刘燕,陈训.影响西洋杜鹃离体试管苗开花的几个因素[J].安徽农业科学,2008,36(22):9405-9407.
[15] 王军玲,陆方方,陈晓梅,等.鸡冠花试管开花初探[J].热带农业科技,2007,30(4):34-35,44.
[16] 郑丽屏,王玲仙,孙一丁,等.重瓣丝石竹试管花的诱导[J].西南农业学报.2004,17(增刊):58-61.
[17] 余沛涛,何剑锋.诱导何氏凤仙试管内开花的几种生理因素[J].植物生理学通讯,2000,36(6):532.
[18] 师素恩,张曦良.香石竹试管内开花现象初报[J].植物生理学通讯,1995,31(4):281-285.
[19] Tee C S,Maziah M,Tan C S.Induction of in vitro flowering in the orchid Dendrobium Sonia 17[J].Biologia Plantarum,2008,52(4):723-726.
[20] 邓国文.大岩桐栽培历史及种植管理技术[J].中国花卉园艺,2005(24):33-35.
[21] Sun T P,Gubler F.Molecular mechanism of gibberellin signaling in plants[J].Annu Rev Plant Biol,2004,55:197-223.
[22] Koornneef M,van der Veen J H.Induction and analysis of gibberellin sensitive mutants in Arabidopsis thaliana (L.)heynh[J].Theor Appl Genet,1980,58(6):257-263.
[23] 王珍华.离体培养大岩桐花被切块花芽分化过程中开花相关基因表达及内源激素的定量分析[D].杭州:杭州师范大学,2012.
[24] Saxena S N,Kaushik N,Sharma R.Effect of abscisic acid and proline on in vitro flowering in Vigna aconitifolia[J].Biologia Plantarum,2008,52(1):181-183.
