东北白鹅CD8α基因的克隆及其胞外区基因的表达与抗血清的制备
2015-03-07张雪莲魏双施刘晓玫邵建伟张树栋李珊珊高明春张文龙邢育钢王君伟
张雪莲,魏双施,刘晓玫,邵建伟,张树栋,李珊珊,高明春,张文龙,邢育钢,马 波*,王君伟*
(1.东北农业大学动物医学学院,哈尔滨150030;2.黑龙江中医药大学附属第二医院,哈尔滨150001;3.哈药集团生物疫苗有限公司,哈尔滨150069)
CD8分子是一种重要的T淋巴细胞表面标志,CD8+T淋巴细胞经抗原刺激最终分化为杀伤性T细胞(CTL)。CD8分子在MHCⅠ限制性T淋巴细胞上表达,具有高度T细胞特异性,它能以同源二聚体(αα)或者异源二聚体(αβ)形式存在[1]。CD8分子作为TCR的辅助受体参与对MHCⅠ分子递呈抗原的识别。CD8分子与MHCⅠ分子的相互作用能加强MHCⅠ分子和TCR之间结合的亲和力。
1997年,M.Luhtala等[2]克隆得到鸡CD8α基因序列,其开放阅读框为708 bp,编码235个氨基酸。与人和小鼠的CD8α基因序列的相似性分别是31%和29%。2005年,S.Kothlow等[3]克隆获得鸭CD4、CD8α和CD3ε分子。鸭CD8α基因序列的开放阅读框为714 bp,编码237个氨基酸,含有23个氨基酸的信号肽,成熟蛋白质的相对分子质量约为24.1 ku。鸭CD8α蛋白序列与鸡CD8α的相似性为59.6%,与人CD8α的相似性为25.1%。2013年,Q.Zhao等[4]克隆得到四川白鹅CD8α(KC476104)基因,全长为1 459 bp,包含1个711 bp的完整开放阅读框,共编码236个氨基酸,通过半定量RTPCR的方法分析了CD8αmRNA在幼鹅和成鹅体内各组织器官中的转录水平。
本研究首次克隆东北白鹅CD8α基因,并利用原核表达系统表达了其胞外区基因编码产物,制备了抗血清,为建立一种检测鹅外周血CD8+T淋巴细胞方法提供了必要的物质基础。
1 材料与方法
1.1 材料
1.1.1 菌株、载体及主要试剂 E.Z.N.A.®HP总RNA提取试剂盒购自美国OMEGA Bio-tek生物技术有限公司;SMART反转录酶购自Clontech宝生物工程有限公司;Prime STAR DNA聚合酶、限制性内切酶、DNA Marker及蛋白质Marker等购自Ta KaRa宝生物工程有限公司;原核表达载体p ET-28a(+)、p ET-30a(+)购自Novagen公司;RosettaTM(DE3)p LysS由本实验室制备并保存;辣根过氧化物酶标记山羊抗兔IgG(H+L)、FITC标记的羊抗兔IgG抗体以及DAPI购自博奥森公司;Lipofectamine®LTX转染试剂购自美国Invitrogen公司。东北白鹅购自黑龙江省哈尔滨市平山养鹅场;新西兰兔购自哈尔滨兽医研究所实验动物中心。
1.1.2 引物设计 参照GenBank发表的绿头鸭CD8α(AF378373)基因序列设计引物获得东北白鹅CD8α基因。根据测序结果设计CD8α胞外区的原核表达引物及真核表达引物,以上引物均由北京六合华大基因科技有限公司合成,如表1所示。
1.2 方法
1.2.1 东北白鹅CD8α基因的克隆与鉴定 取50 mg东北白鹅胸腺组织加液氮研磨成粉末后,按照E.Z.N.A.HP总RNA提取试剂盒说明书的方法提取总RNA并测定浓度和纯度。按SMART反转录酶试剂盒说明书进行反转录合成cDNA。以cDNA为模板分别用表1中的引物和Prime STAR DNA聚合酶进行PCR扩增,扩增体系为50μL。反应条件:98℃3 min;98℃30 s、57℃30 s、72℃2 min,15个循环;PCR产物用1%的琼脂糖凝胶电泳进行分析。将纯化后的PCR产物与p EASYBlunt载体连接,转化Trans1-T1大肠杆菌感受态细胞,提取质粒进行酶切鉴定,阳性者送北京六合华大基因科技有限公司进行测序并命名为p EASYBlunt-CD8α,测序后的序列利用DNAMAN生物软件及在线数据库进行序列比对分析[5-6]。
1.2.2 东北白鹅CD8α胞外区基因的克隆及表达载体的构建 以p EASY-Blunt-CD8α质粒为模板,利用表1中的表达引物克隆原核表达和真核瞬时表达的东北白鹅CD8α胞外区基因,纯化的PCR产物连接入p EASY-Blunt Simple载体,转化入大肠杆菌感受态细胞TG1,提取质粒酶切鉴定,将鉴定为阳性的单克隆菌液送北京六合华大基因科技有限公司测序。
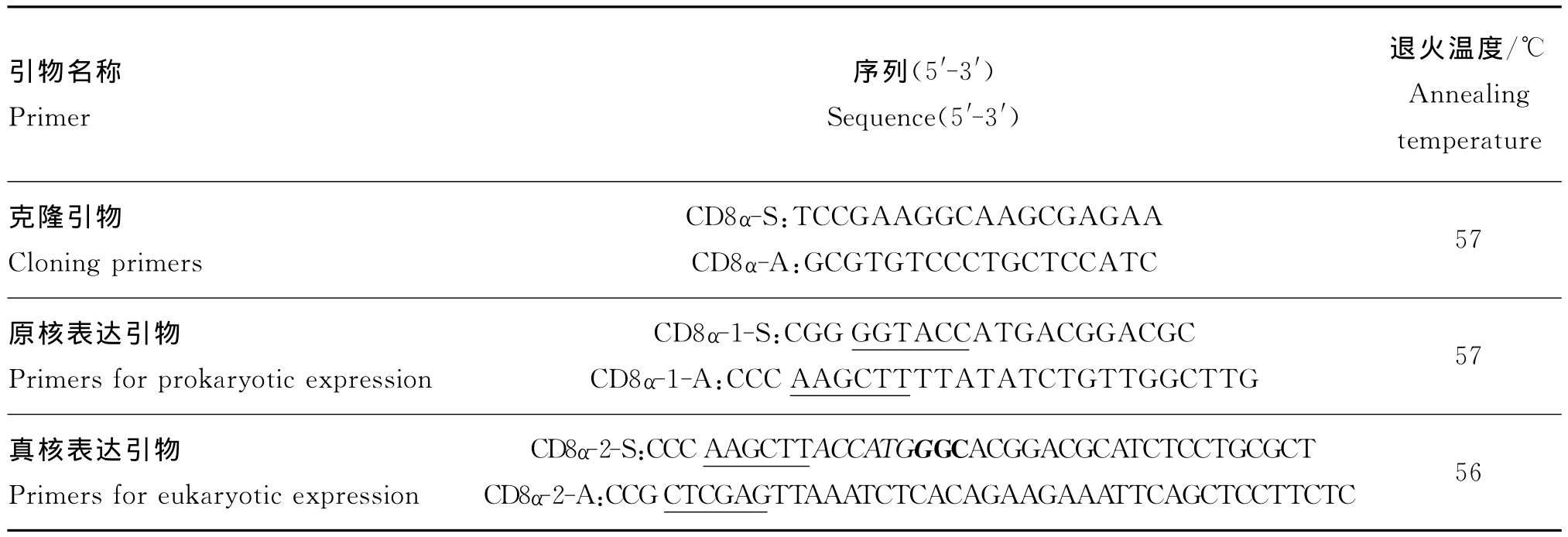
表1 东北白鹅CD8α基因的克隆引物及其胞外区表达引物序列Table 1 Primers sequence for Northeast White Goose CD8αgene clone and extracellular region expression
重组阳性质粒p EASY-Blunt-Simple-CD8αex、p ET-30a(+)和p ET-28a(+)分别用KpnⅠ和Hin dⅢ进行双酶切,回收目的基因与载体片段并连接,转化感受态细胞TG1,提取质粒酶切鉴定,构建CD8α胞外区基因原核表达载体p ET-30a-CD8αex以及p ET-28a-CD8αex,并转化感受态细胞RosettaTM(DE3)p LysS。以同样的方法构建CD8α胞外区基因真核表达载体pcDNA3.1-CD8αex。
1.2.3 东北白鹅CD8α胞外区基因的表达及纯化按文献方法进行目的蛋白的诱导表达[7]。表达产物经12%的SDS聚丙烯酰胺凝胶电泳(SDSPAGE)进行表达产物检测。SDS-PAGE分析显示重组蛋白质以包涵体表达为主,收集到的菌体超声破碎后,12 000 r·min-1离心15 min,沉淀用8 mol·L-1尿素溶解。
根据重组蛋白的表达形式采取变性条件下纯化目的蛋白[8],采用PBS-甘油透析液4℃透析,每隔4~6 h换次液,除去尿素,12%SDS-PAGE分析纯化效果。利用BCA蛋白测定试剂盒测定纯化后蛋白浓度,纯化产物加入20%甘油,分装保存于-20℃。
1.2.4 抗血清的制备与鉴定
1.2.4.1 抗血清的制备:将纯化的目的蛋白以0.1 mg·只-1的剂量免疫新西兰兔,首次免疫时将蛋白质溶液与弗氏完全佐剂等体积混合,乳化至油包水的程度,背部皮下多点注射新西兰兔,此后与等量的弗氏不完全佐剂进行乳化,免疫方法同前。每2周免疫一次,并在免疫后7~10 d耳缘静脉采血检测抗体的ELISA效价,共免疫4次,加强免疫一周后心脏采血,分离血清并保存[8]。
1.2.4.2 I-ELISA方法测定抗血清的效价:以纯化后的重组蛋白质200 ng·孔-1包被ELISA微量反应板,4℃包被过夜,0.5%Tween-PBS洗涤3次,5%脱脂乳37℃封闭2 h,洗涤后,加入倍比稀释的抗血清,同时用免疫前兔血清作为阴性对照。二抗为HRP标记的山羊抗兔IgG,1∶5 000稀释。TMB显色,1 mol·L-1H2SO4终止反应,酶标仪测定OD450nm的吸光度。
1.2.4.3 抗血清的Western blot分析:将纯化后重组蛋白质经SDS-PAGE电泳后转印至硝酸纤维素膜(NC膜)上,以制备的抗血清为一抗(1∶400稀释),HRP标记的山羊抗兔IgG为二抗(1∶2 000),4-CN显色[7],并以p ET-28a(+)空载体做阴性对照。
1.2.4.4 抗血清的纯化:将制备的抗血清利用不同浓度的饱和硫酸铵进行粗纯,再按照GenScript公司Protein G抗体纯化试剂盒的操作说明进行纯化[9]。纯化分离得到的抗血清,用BCA蛋白测定试剂盒测定纯化出的抗体浓度,SDS-PAGE进行检测。
1.2.5 抗血清反应性的鉴定
1.2.5.1 全细胞I-ELISA检测抗血清的反应性:按参考文献[10]过尼龙棉柱分离东北白鹅外周血T淋巴细胞,细胞计数后,1×105·孔-1包被ELISA微量反应板,37℃包被16~24 h,0.5%Tween-PBS洗涤3次,5%脱脂乳37℃封闭2 h,洗涤后,加入倍比稀释的抗血清,同时用免疫前兔血清作阴性对照。二抗为HRP标记的山羊抗兔IgG,1∶5 000稀释。TMB显色后1 mol·L-1H2SO4终止,酶标仪测定OD450nm的吸光度,以抗血清OD450nm接近于1,P/N≥2的血清稀释度为最佳稀释度。
1.2.5.2 间接免疫荧光(IFA)检测抗血清的反应性:常规方法制备鸡胚成纤维细胞(CEF),待细胞生长至60%时,按照转染试剂LTX说明书将pcDNA3.1-CD8αex转染CEF。转染后48 h,弃去培养液,用PBS洗涤细胞3次;适量4%的多聚甲醛4℃固定30 min;PBS洗3次;加入上述纯化的抗血清,经1∶100倍稀释后,37℃作用1 h;PBS洗3次;加入工作浓度FITC标记的山羊抗兔IgG抗体为二抗,37℃避光作用1 h,PBS洗3次,荧光显微镜下观察荧光信号产生情况。并设pcDNA3.1(+)空载体质粒转染孔作为阴性对照。
1.2.5.3 激光共聚焦显微镜检测抗血清的反应性:常规方法制备鹅外周血淋巴细胞(GoPBLs),收集细胞,PBS洗涤3次,进行细胞计数,使细胞数达到1×106·m L-1,将细胞分装于瓶皿中,利用4%的多聚甲醛固定过夜,分散均匀,利用0.5%Triton-X-100处理细胞20 min,PBS洗涤2~3次后,加入抗血清作为一抗,经PBA(含1%BSA的PBS缓冲液)100倍稀释,37℃孵育30 min,PBS洗2~3次,加入工作浓度下的FITC标记的羊抗兔Ig G抗体为二抗,37℃避光孵育45 min,PBS洗2~3次后,利用0.5 mg·m L-1的DAPI进行细胞核染色,37℃作用30 min,PBS洗2~3次,激光共聚焦显微镜下观察荧光信号的产生情况。
2 结 果
2.1 东北白鹅CD8α基因的克隆
PCR扩增得到东北白鹅CD8α基因,扩增产物于1%琼脂糖凝胶电泳分析,电泳显示的条带大小为900 bp左右,与预期结果相符,具体结果如图1A所示。PCR产物经胶回收后连接到p EASY-Blunt载体上,重组质粒p EASY-Blunt-CD8α经Bam HⅠ酶切,获得了4.8 kb的片段;经Bam HⅠ和XhoⅠ双酶切得到约3.9和0.9 kb两条片段;如图1B所示,证实外源基因成功连接到p EASY-Blunt载体上。东北白鹅CD8α基因的核苷酸序列与绿头鸭CD8α(AF378373)及四川白鹅CD8α(KC476104)的相似性分别为89%和99%,Blast结果显示目的基因为CD8α同源物,可以确定目的基因为东北白鹅CD8α的基因序列,将序列提交至NCBI获得登录号JQ272859。

图1 东北白鹅CD8α基因的克隆(A)及鉴定(B)Fig.1 Cloning(A)and identification(B)of Northeast White Goose CD8αgene
2.2 东北白鹅CD8α胞外区原核表达载体的构建
利用表1中所列的CD8α胞外区原核表达引物,PCR扩增得到东北白鹅CD8α胞外区基因,扩增产物用1%琼脂糖凝胶电泳分析,电泳显示的条带大小为552 bp,与预期结果相符,如图2A所示。将纯化的PCR产物连接到p ET-30a载体上,重组质粒经Hin dⅢ单酶切、KpnⅠ与Hin dⅢ双酶切后得到的片段大小与预期结果相符;证实外源基因成功连接到载体p ET-30a(+)上,如图2B所示。将纯化的PCR产物连接到p ET-28a载体上,以重组质粒p ET-28a-CD8αex为模板,经PCR后,得到的片段大小与预期结果相符,证实外源基因成功连入p ET-28a(+)上,如图2C所示。
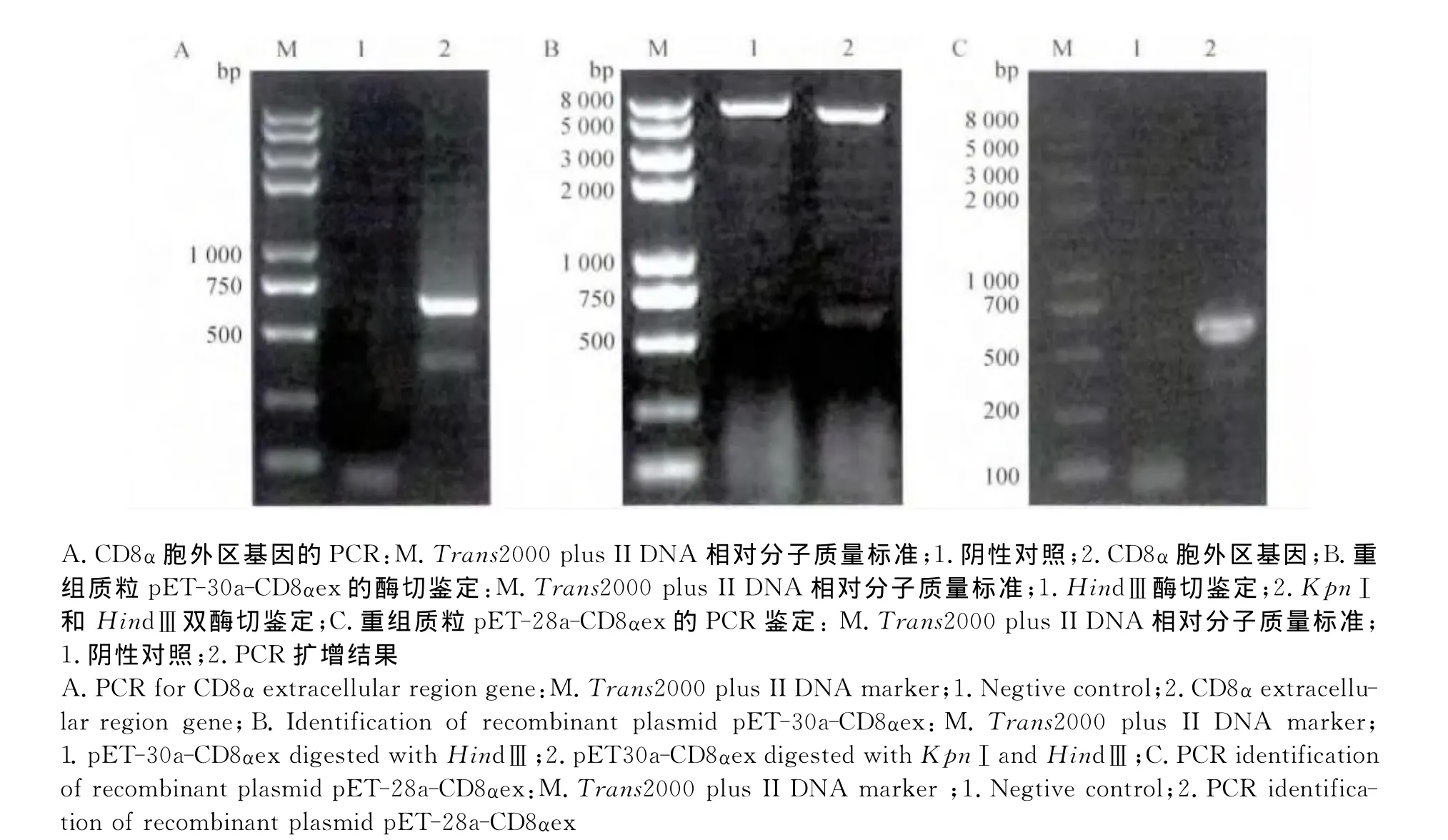
图2 用于原核表达的东北白鹅CD8α胞外区基因的克隆、重组原核表达载体的鉴定Fig.2 Cloning of Northeast White Goose CD8αextracellular region gene used to prokaryotic express and identification of recombinant prokaryotic expression vector
2.3 东北白鹅CD8α胞外区基因真核表达载体的构建
利用表1中所列的CD8α胞外区真核表达引物,PCR扩增获得CD8α胞外区基因(含有Kozak序列),扩增产物用1%琼脂糖凝胶电泳分析,电泳显示的条带大小为558 bp,与预期结果相符,如图3A所示。将纯化的PCR产物连接到pcDNA3.1(+)载体上,经Hin dⅢ单酶切、Hin dⅢ与XhoⅠ双酶切后得到的片段大小与预期结果相符;证实外源基因成功连接到pcDNA3.1(+)载体上,如图3B所示。
2.4 东北白鹅CD8α胞外区基因的诱导表达及纯化
含有重组表达载体p ET-30a-CD8αex、p ET-28a-CD8αex以及空载体p ET-30a(+)、p ET-28a(+)的Rosetta菌经IPTG诱导表达后,通过SDSPAGE分析,在30、25 ku处分别显现出特异性的蛋白质条带,与预计的蛋白质相对分子质量大小相符,利用Ni-NTA柱亲和层析纯化重组蛋白质,结果见图4和图5所示。
2.5 抗血清的鉴定与纯化
2.5.1 I-ELISA方法测定抗血清效价 经间接ELISA测定,制备的抗血清效价为1∶12 800。

图3 用于真核表达的东北白鹅CD8α胞外区基因的克隆(A)及重组真核表达载体的鉴定(B)Fig.3 Cloning(A)of Northeast White Goose CD8αextracellular region gene used to eukaryotic expression and identification(B)of recombinant eukaryotic expression vector
2.5.2 抗血清的Western blot鉴定 纯化的重组蛋白质(p ET-28a-CD8αex)经过SDS-PAGE后,转移到硝酸纤维素膜上进行Western blot分析。以制备的抗血清作为第一抗体,HRP标记的山羊抗兔IgG酶标抗体作为第二抗体进行检测,重组蛋白质均出现特异性反应条带,条带大小均与预期一致,见图6。
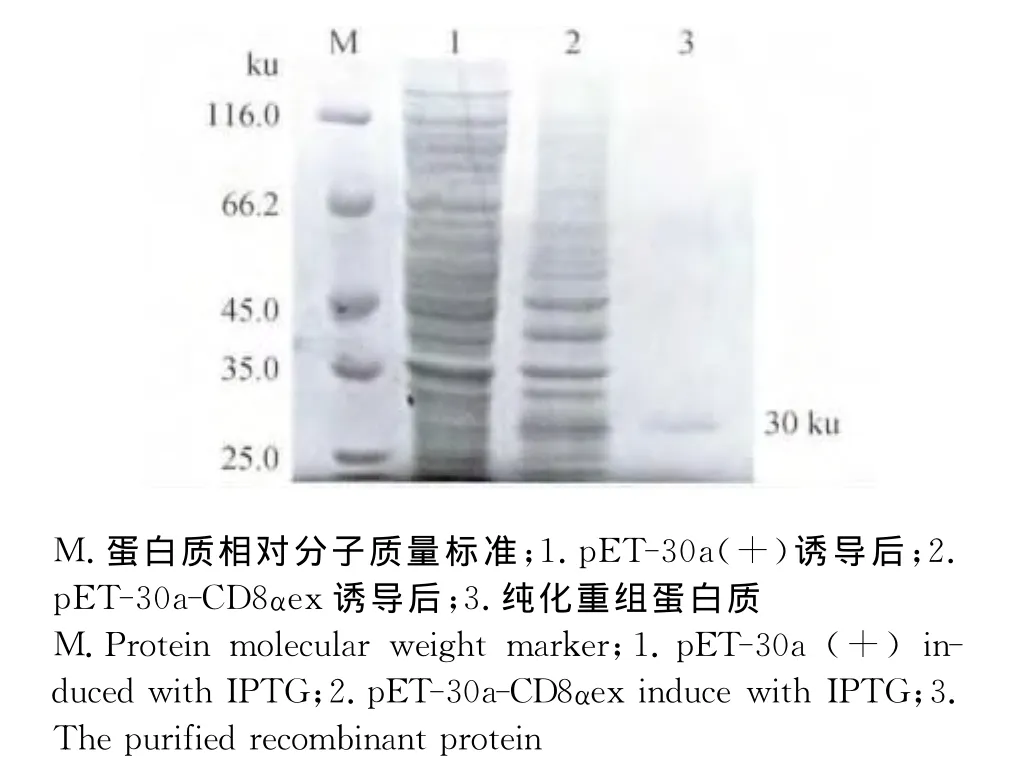
图4 原核表达东北白鹅CD8α胞外区重组蛋白质(pET-30a-CD8αex)的SDS-PAGE分析及其纯化Fig.4 SDS-PAGE analysis and purification of prokaryotic expressed CD8αextracellular region(pET-30a-CD8αex)of Northeast White Goose
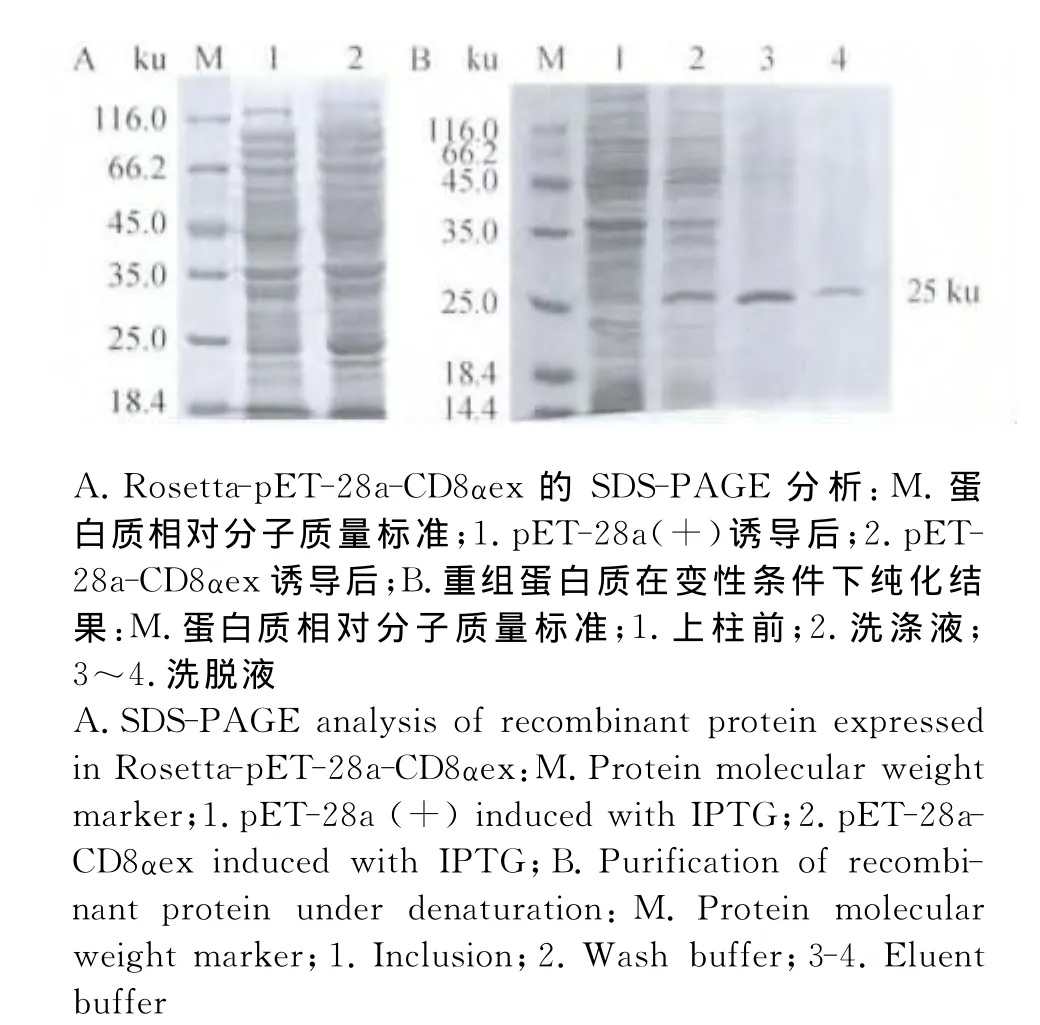
图5 原核表达东北白鹅CD8α胞外区重组蛋白质(pET-28a-CD8αex)的SDS-PAGE分析及其纯化结果Fig.5 SDS-PAGE analysis and purification of prokaryotic expressed CD8αextracellular region(pET-28a-CD8αex)of Northeast White Goose
2.5.3 抗血清的纯化 利用Protein G可与抗体Fc段发生特异性结合的特点,将制备的兔抗鹅CD8α胞外区抗血清进行纯化,SDS-PAGE结果明显显示出2条目的蛋白质条带,一条为重链,相对分子质量约为52 ku左右,另一条为轻链,相对分子质量约为25 ku左右,纯化结果如图7所示。

图6 东北白鹅CD8α胞外区重组蛋白的Western blot分析Fig.6 Western blot analysis of recombinant protein CD8α extracellular region of Northeast White Goose

图7 兔抗东北白鹅CD8α胞外区抗血清的纯化Fig.7 Purification of rabbit anti-CD8αextracellular region of Northeast White Goose antiserum
2.5.4 抗血清的反应性鉴定
2.5.4.1 全细胞I-ELISA检测抗血清的反应性:全细胞I-ELISA检测抗血清的反应性,结果如图8所示。纯化后的抗血清可与外周血T淋巴细胞发生特异性结合,且最佳的血清稀释度为1∶800。
2.5.4.2 间接免疫荧光(IFA)检测抗血清的反应性:将构建的重组真核表达质粒pcDNA3.1-CD8αex和空载体质粒pc DNA3.1(+)分别转染CEF后,收获转染的CEF用于荧光信号的检测。如图9显示,抗血清能特异性识别转染pcDNA3.1-CD8αex的CEF,且检测到较强的荧光信号,而空载体质粒pcDNA3.1(+)转染的细胞则无荧光信号,表明制备的抗血清与CEF瞬时表达的CD8α胞外区蛋白质发生特异性抗原抗体反应。

图8 全细胞I-ELISA检测兔抗东北白鹅CD8α胞外区抗血清的反应性Fig.8 Reactivity identification of rabbit anti-CD8αextracellular region of Northeast White Goose antiserum by the whole cells I-ELISA
2.5.4.3 激光共聚焦显微镜检测抗血清的反应性:利用荧光标记和激光共聚焦显微镜相结合的方法,在激光共聚焦显微镜下观察发现,对照组鹅外周血淋巴细胞(GoPBLs)在只添加FITC标记的羊抗兔IgG和DAPI染色结果叠加下未见特异性绿色荧光,仅有蓝色荧光;试验组以制备的抗血清作为一抗,FITC标记的羊抗兔IgG为二抗和DAPI染色结果叠加发现显著的绿色荧光集中在细胞膜上,细胞轮廓清晰如图10所示。
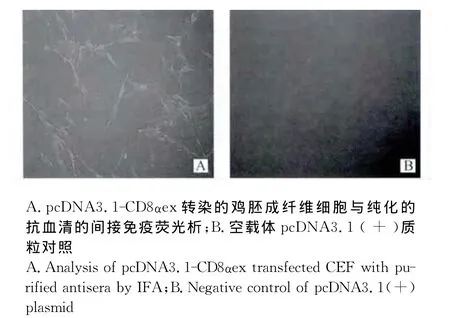
图9 兔抗东北白鹅CD8α胞外区抗血清的间接免疫荧光鉴定(200×)Fig.9 Identification of rabbit anti-CD8αextracellular region of Northeast White Goose antiserum by immuofluorescence(200×)
3 讨 论

图10 激光共聚焦法检测鹅CD8+T淋巴细胞(400×)Fig.10 Confocal scanning microscopy detects goose CD8+T lymphocytes(400×)
T淋巴细胞是机体免疫应答的核心细胞,根据其表面分化抗原的不同,可将T细胞分成若干亚群,其中具有CD8抗原的T细胞为细胞毒性T细胞(Tc细胞),又称为杀伤性T细胞(CTL细胞),是介导细胞免疫的效应细胞之一。Tc细胞可分泌细胞毒素-穿孔素(perforin)和颗粒酶(granzyme),导致靶细胞发生溶解,并可产生细胞因子——TNF-β和IFN-γ,其中TNF-β可与靶细胞表面的相应受体结合,诱导靶细胞自杀[11]。因此检测机体CD8+T淋巴细胞并结合细胞因子水平可评价机体Tc细胞免疫的状态[11-14],为阐明机体抗感染和抗肿瘤的机制提供理论依据。
2005年,S.Kothlow等对北京鸭CD8α分子进行真核表达,制备了相应的单克隆抗体,对鸭的脾、胸腺、法氏囊及外周血液中淋巴细胞类型进行鉴定[15]。2008年,栾维民等利用小鼠抗鸡CD3、CD4、CD8等单克隆抗体通过免疫组织化学的方法对鸡外周免疫器官中淋巴细胞及其亚群的发育进行了系统研究[16]。2011年,王燕等取发育到第14天的鹅胚胎到1日龄雏鹅的脾以小鼠抗人CD8单克隆抗体为第一抗体用免疫荧光双标法研究雏鹅CD8抗原的表达,并利用Hoeschst33342的荧光染色方法分析细胞凋亡率,探索鹅胚脾淋巴细胞选择机制[17]。Q.Zhao等[4]克隆得到四川白鹅CD8α(KC476104)基因全长为1 459 bp,包含一个711 bp的完整开放阅读框,共编码236个氨基酸,通过半定量RT-PCR的方法分析了CD8αmRNA在幼鹅和成鹅体内各组织器官中的转录水平。目前针对鹅CD8+T淋巴细胞特异性检测试剂尚未见报道,这制约了有关鹅基础免疫及免疫机制等方面的研究。
本研究克隆得到东北白鹅CD8α基因并通过生物学软件分析比较了鹅和其他物种CD8α氨基酸序列,发现其胞外区亲水性、抗原性较为明显,说明该基因的重要功能结构域在胞外区,进而利用原核表达系统,获得鹅CD8α胞外区蛋白质。并以纯化的重组蛋白质为免疫原制备抗血清,利用重组蛋白质为抗原的I-ELISA方法和全细胞I-ELISA方法测得制备抗血清效价分别为1∶12 800和1∶800,表明原核表达的重组蛋白质具有良好的免疫原性,可在兔体内产生较高滴度的抗体。经全细胞I-ELISA及IFA,证明制备的抗血清特异性较高,能识别T细胞表面的CD8α分子和真核细胞表达的鹅CD8α胞外区蛋白质。同时利用荧光标记和激光共聚焦显微镜相结合的方法,在激光共聚焦显微镜下观察到CD8+T淋巴细胞的细胞膜上出现明显的荧光信号,为研究在不同发育时期CD8+T淋巴细胞在鹅体内的发生、分布及分化提供了物质基础。该抗血清也可用于病原性感染或免疫抑制状态下,鹅外周血中CD8+T淋巴细胞的动态变化的研究,为揭示机体的免疫机制提供理论依据。本研究为进一步制备抗鹅CD8α分子的单克隆抗体奠定了物质基础[18]。截至目前,本实验室已成功制备东北白鹅CD4[19]、CD8α分子的抗血清,为建立完善的检测鹅T淋巴细胞亚群的技术平台提供了物质贮备。
(
):
[1] LUHTALA M,TREGASKES C A,YOUNG J R,et al.Polymorphism of chicken CD8-α,but not CD8-β[J].Immunogenetics,1997,46(5):396-401.
[2] LUHTALA M.Chicken CD4,CD8αβ,and CD8ααT cell co-receptor molecules[J].Poult Sci,1998,77(12):1858-1873.
[3] KOTHLOW S,MANNES N K,SCHAERER B,et al.Characterization of duck leucocytes by monoclonal antibodies[J].Dev Comp Immunol,2005,29(8):733-748.
[4] ZHAO Q,LIU F,CHEN S,et al.Chinese goose(Anser cygnoides)CD8α:cloning,tissue distribution and immunobiological in splenic mononuclear cells[J].Gene,2013,529(2):332-339.
[5] LARKIN M A,BLACKSHIELDS G,BROWN N P,et al.Clustal W and Clustal X version 2.0[J].Bioinformatics,2007,23(21):2947-2948.
[6] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Mol Biol Evol,2011,28(10):2731-2739.
[7] 郭永丽.鹅免疫球蛋白λ型轻链基因克隆及其恒定区
特异性抗体的制备与应用研究 [D].哈尔滨:东北农业大学,2012.
GUO Y L.Clone of goose immunoglobulin light chain withλtype and application of specific antibody prepared against its constant region[D].Harbin:Northeast Agricultural University,2012.(in Chinese)
[8] 李 勐,李忠秋,李昭春,等.牛IgG轻链的分离纯化
及其多克隆抗血清的制备[J].东北农业大学学报,2006,37(6):788-790.
LI M,LI Z Q,LI Z C,et al.Purification of bovine immunoglobulin G light chain and preparation of rabbit anti-bovine IgG-L sera[J].Journal of Northeast Agricultural University,2006,37(6):788-790.(in Chinese)
[9] 徐晶晶,李 迪,曹永生,等.辣根过氧化物酶标记兔抗丝状噬菌体衣壳蛋白抗体的制备与初步应用[J].黑龙江畜牧兽医,2013(3):114-116.XU J J,LI D,CAO Y S,et al.Preparation and preliminary application of the rabbit antibody against capsid protein of the filamentous phage labeled with horseradish peroxidase[J].Heilongjiang Animal Science and Veterinary Medicine,2013(3):114-116.(in Chinese)
[10] 李洪涛,马 波,王君伟.抗鸭胸腺细胞单克隆抗体的制备及其免疫组织化学研究[J].中国免疫学杂志,2008,24(1):42-46.LI H T,MA B,WANG J W.Prepartion and immunohistochemical study of monoclonal antibodies to duck thymocyte[J].Chinese Journal of Immunology,2008,24(1):42-46.(in Chinese)
[11] 杨汉春,姚火春,王君伟,等.动物免疫学[M].北京:中国农业大学出版社,2003:130-135.YANG H C,YAO H C,WANG J W,et al.Animal Immunology[M].Beijing:China Agricultural University Press,2003:130-135.(in Chinese)
[12] BARBOZA L,SALMEN S,PETERSON D L,et al.Altered T cell costimulation during chronoc hepatitis B infection[J].Cell Immunol,2009,257(1-2):61-68.
[13] PARVIZI P,READ L R,ABDUL-CAREEM M F,et al.Cytokine gene expression in splenic CD4+and CD8+T cell subsets of genetically resistant and susceptible chickens infected with Marek′s disease virus[J].Vet Immunol Immunopathol,2009,132(2-4):209-217.
[14] BETTS M R,CASAZZA J P,KOUP R A.Monitoring HIV-specific CD8+T cell responses by intracellular cytokine production[J].Immunol Lett,2001,79(1- 2):117-125.
[15] KOTHLOW S,MANNES N K,SCHAERER B,et al.Characterization of duck leucocytes by monoclonal antibodies[J].Dev Comp Immunol,2005,29(8):733-748.
[16] 栾维民,杨树宝,杨丽华,等.鸡盲肠扁桃体中T淋巴细胞及其亚群的发育[J].中国兽医科学,2008,38(4):338-341.LUAN W M,YANG S B,YANG L H,et al.Development of T lymphocyte subpopulations in caecal tonsil of chicken[J].Chinese Veterinary Science,2008,38(4):338-341.(in Chinese)
[17] 王 燕,周学军,蔡亚非,等.鹅胚脾淋巴细胞选择机制研究[J].南京农业大学学报,2011,34(2):107-112.WANG Y,ZHOU X J,CAI Y F,et al.Study on the selection mechanism of lymphocytes in goose fetal spleen[J].Journal of Nanjing Agricutural University,2011,34(2):107-112.(in Chinese)
[18] LUHTALA M,KOSKINEN R,TOIVANEN P,et al.Characterization of chicken CD8-specific monoclonal antibodies recognizing novel epitopes[J].Scand J Immunol,1995,42(1):171-174.
[19] 张雪莲,魏双施,邵建伟,等.东北白鹅CD4基因的克隆及其胞外区的表达与抗血清的制备[J].畜牧兽医学报,2014,45(4):639-646.ZHANG X L,WEI S S,SHAO J W,et al.Molecular cloning and expression of extracellular region of northeast white goose CD4 gene and preparation of its antiserum[J].Acta Veterinaria et Zootechnica Sinica,2014,45(4):639-646.(in Chinese)
