4种花生蛋白的分级提取及其结构的扫描电镜观察
2015-03-06彭宇宁王丹丹
李 婷,彭宇宁,李 强,王丹丹,任 虹
(北京工商大学食品学院/食品添加剂与配料北京高校工程研究中心/北京市食品风味化学重点实验室/食品质量与安全北京实验室,北京 100048)
4种花生蛋白的分级提取及其结构的扫描电镜观察
李 婷,彭宇宁,李 强,王丹丹,任 虹*
(北京工商大学食品学院/食品添加剂与配料北京高校工程研究中心/北京市食品风味化学重点实验室/食品质量与安全北京实验室,北京 100048)
以花生粕为原料,采用超声辅助分级提取法研究花生清蛋白、球蛋白、醇溶蛋白和谷蛋白的提取工艺,并利用扫描电镜观察其表面结构。研究结果表明,花生清蛋白的较佳提取条件:提取温度为50℃,时间为12 min,料液比为1∶12,提取率为53.59%,清蛋白质量分数为72.14%;花生粕球蛋白较佳提取条件:提取温度为50℃,时间为10 min,NaCl溶液质量浓度为0.4 g/L,料液比为1∶10,提取率为9.03%,球蛋白质量分数为73.20%;花生醇溶蛋白较佳提取条件:乙醇溶液体积分数为70%,提取时间为12 min,料液比为1∶6,提取率为8.62%,醇溶蛋白质量分数为64.28%;花生粕谷蛋白较佳提取条件:提取温度为45℃,时间为15 min,pH值为8,料液比为1∶10,提取率为4.85%,谷蛋白质量分数为68.79%。通过扫描电镜观察,4种花生蛋白表面具有不同的结构。
花生蛋白;工艺优化;电镜扫描
我国是世界上花生生产大国,花生年产量位居世界第一[1]。我国大约50%~60%的花生用于榨油[2-3],榨油后的副产物花生粕每年大约有900万吨。花生粕富含蛋白质,还含有黄酮类、酚类、氨基酸、蛋白质、鞣质、糖类、三萜或甾体类化合物等,不含胆固醇[4-5]。花生粕蛋白质富含人体必需氨基酸,且谷氨酸、天冬氨酸含量较高,与动物蛋白相近,具有丰富的营养价值[6]。目前大部分花生粕被用作饲料,尤其花生粕蛋白质利用价值过低,故开展花生粕蛋白的深度加工研究,合理开发利用其中富含的营养物质,具有十分重要的现实意义。
有关花生蛋白的提取,国内外有较多的研究,主要提取方法有水剂法[7]、碱溶酸沉法[8]、水酶法[9]、膜过滤法[10]、等电点沉淀法[11]等,然而,这些提取方法只得到了一种花生粕蛋白或花生粕总蛋白。分级提取法是根据蛋白质理化性质不同,通过水溶、盐溶、醇溶、碱溶等逐级分离提取植物原料中的蛋白质。目前分级提取法在米糠、燕麦麸、小麦等植物蛋白质提取研究中比较活跃[12-15],而用于提取花生粕蛋白质的研究鲜有报道。本实验采用分级提取法,并结合超声辅助法提取花生粕中不同性质的蛋白质,优化其提取工艺,旨在得到多种花生蛋白,并提高其提取率,为花生蛋白提取工业化生产提供工艺参考。
1 材料与方法
1.1 材料与试剂
花生粕由北京市青龙湖万春园蔬菜种植中心提供;BCA试剂盒,北京博奥森生物技术有限公司;氯化钠、无水乙醇、氢氧化钠,北京化工厂,均为分析纯。
1.2 仪器与设备
FW-400A型倾斜式高速万能粉碎机,北京中兴伟业仪器有限公司;SENCO R-201型旋转蒸发仪,上海申顺生物科技有限公司;ALPHA1-2LD plus型冷冻干燥机,博劢行仪器有限公司;KQ-400KDB型高功率数控超声波清洗器,昆山市超声仪器有限公司;Spectra Max 190型连续波长酶标仪,上海普迪生物技术有限公司;DK-S22型电热恒温水浴锅,上海精宏实验设备有限公司;TP-213型电子天平,北京赛多利斯仪器系统有限公司;pHS-3D型pH计,上海三信仪表厂;SC-3610型低速离心机,科大创新股份有限公司;TD5A型台式低速离心机,湖南赫西仪器装备有限公司;VEGAⅡ-LMH型扫描电子显微镜,捷克TESCAN公司。
1.3 实验方法
1.3.1 4 种花生蛋白的分级提取
参照分级提取方法[16],并做适当修改,计算蛋白提取率。花生粕中4种蛋白质的分级提取工艺流程如图1。
1.3.2 花生粕中蛋白质提取条件的优化
根据花生粕4种蛋白在提取过程中影响因素的不同,以蛋白质提取率为指标,进行单因素实验和正交试验,确定花生粕4种蛋白的较佳工艺并进行验证实验。花生粕4种蛋白正交试验因素水平表见表1。
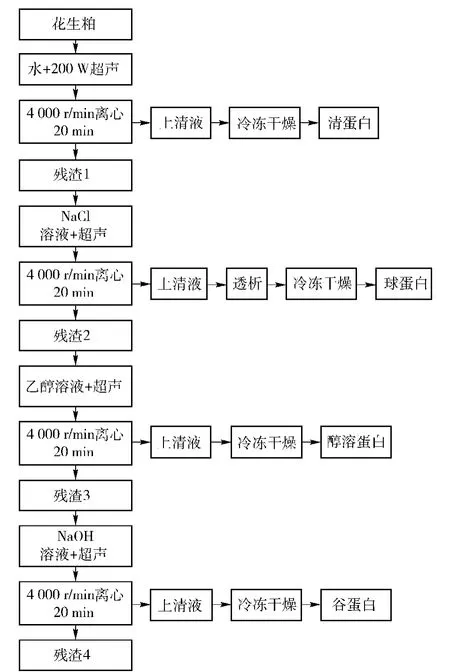
图1 花生粕中4种蛋白质的分级提取工艺Fig.1 Fractional extraction technology of four protein fractions from peanut meal
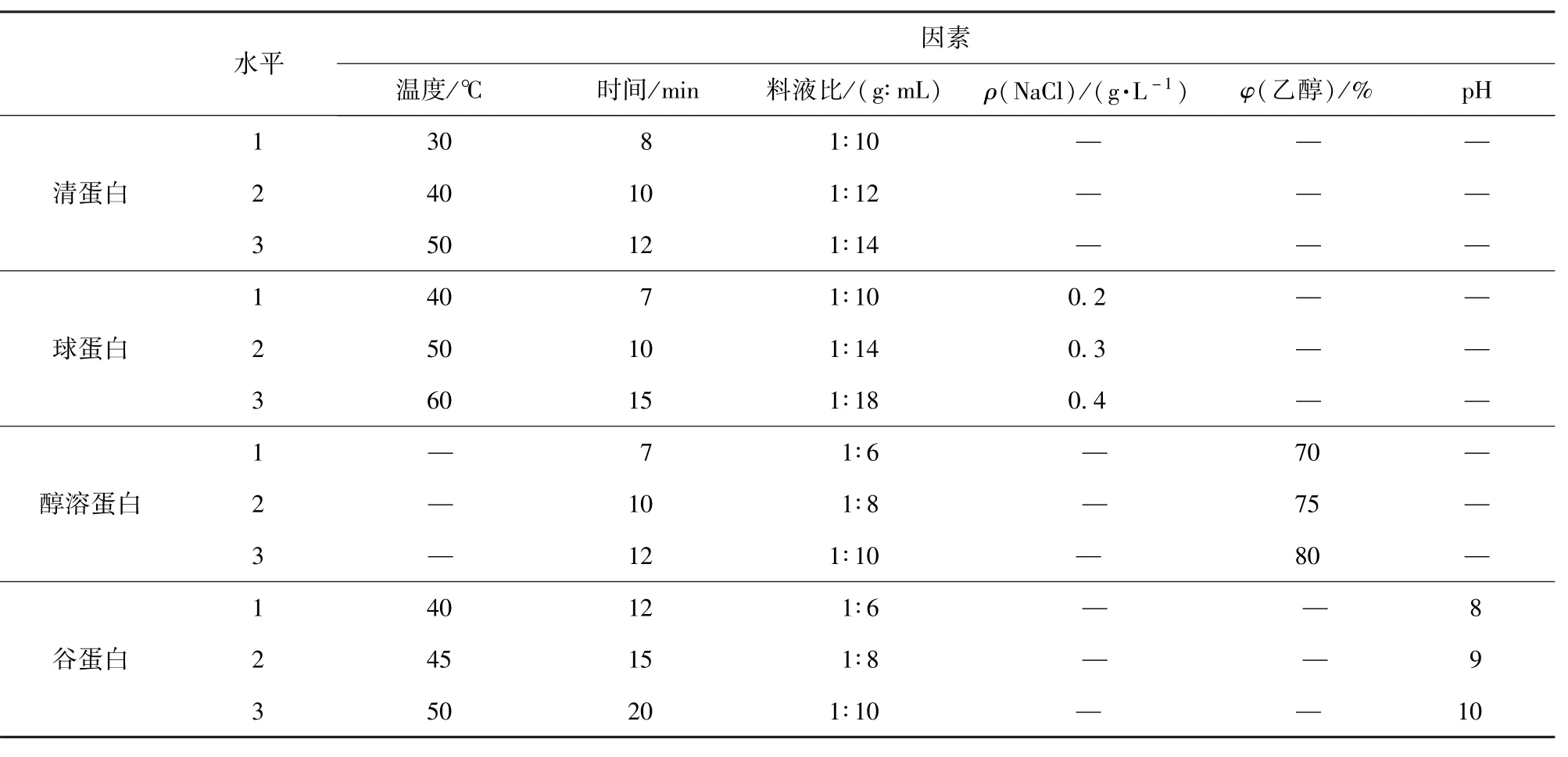
表1 花生粕4种蛋白质正交试验因素水平表Tab.1 Orthogonal experiment factors for 4 protein fractions from peanut meal
1.3.3 蛋白含量的测定方法及指标
1.3.3.1 BCA试剂盒法测定蛋白质含量
使用BCA(bicinchoninic acid)试剂盒测定可溶性蛋白浓度。标准曲线的绘制:取牛血清白蛋白标准品用磷酸盐缓冲液配制质量浓度为0.5 g/L,将标准品按0,2,4,6,8,12,16,20 μL加到96孔板的蛋白标准品孔中,加PBS至20 μL,各孔加入200 μL BCA工作液,37℃放置20 min,在562 nm下测定吸光度,绘制标准曲线。
取样品放入96孔板,加PBS至20 μL,加200 μL BCA工作液,37℃水浴30 min,冷却至室温,在A562下,用酶标仪测定OD值。
1.3.3.2 凯氏定氮法
根据GB 5009.5—2010中凯氏定氮法测定样品中蛋白含量。
1.3.3.3 蛋白含量测定指标
花生粕中4种蛋白的提取率和质量分数根据式(1)、式(2)计算。

1.3.4 扫描电镜观察4种花生蛋白
将处理后的花生蛋白样品均匀固定在贴胶的电镜进样台上,放入HVS-SGB喷金机,真空条件下进行样品的喷金,然后固定在载物台,调节最佳视野和放大倍数进行观察。
2 结果与讨论
2.1 清蛋白提取工艺优化结果
2.1.1 不同提取条件对清蛋白提取的影响
提取温度对清蛋白提取的影响如图2(a),随着温度的升高,蛋白质含量明显增加,当提取温度升高至40℃时,蛋白质含量无明显增高,故得出清蛋白提取的较佳温度为40℃。
提取时间对清蛋白提取的影响如图2(b),随着提取时间的增长,蛋白含量明显增加,增至10 min时,蛋白含量达到最大值。由于时间的增加清蛋白溶解后会发生少量水解[17],导致10 min后蛋白质含量呈下降趋势,故清蛋白提取的较佳时间为10 min。
料液比对清蛋白提取的影响如图2(c),随着料液比的增加,蛋白含量明显增加,增至1∶12后,蛋白质含量无明显增加。花生粕中含有一定淀粉、糖类、膳食纤维等物质,吸水膨胀[18],因此当提取剂量少时溶液黏稠不易使花生粕与水混溶,不易提取出蛋白质,从而蛋白质含量较低。相应提高料液比可提高蛋白质提取率,故清蛋白提取较佳料液比为1∶12。
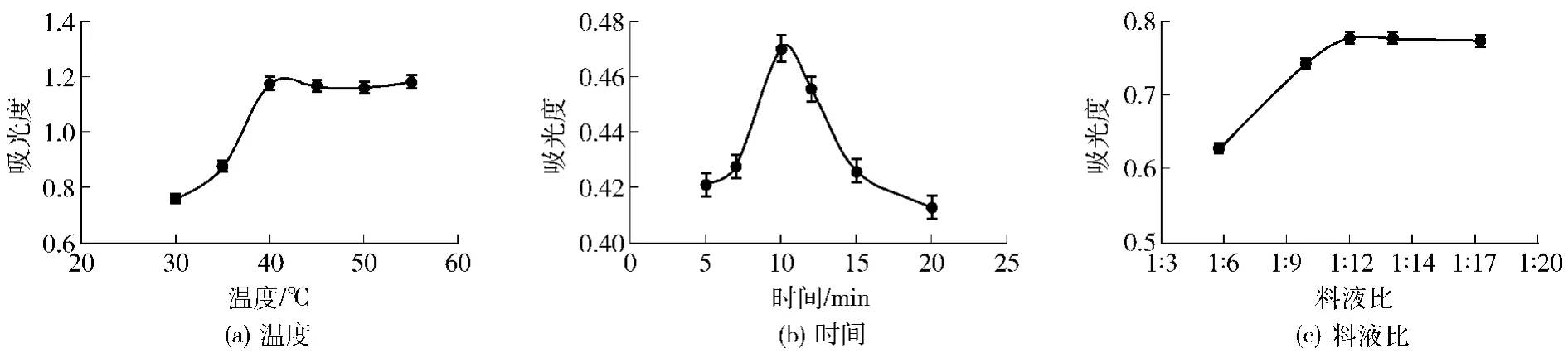
图2 提取条件对花生粕清蛋白提取液吸光度的影响Fig.2 Effects of extraction condition on extraction of albumin
2.1.2 清蛋白正交试验结果分析
表2为清蛋白提取正交试验结果。由表2的极差分析结果可以得出,RA>RC>RB,提取温度、时间、料液比对花生粕清蛋白提取的影响大小依次为提取温度(A)、料液比(C)、提取时间(B)。3个因素中提取温度对清蛋白的提取影响较为显著。在实验设计范围内,优化得到的超声提取花生粕清蛋白的较佳条件为A3B3C2,即提取温度50℃,提取时间12 min,料液比1∶12。
2.2 球蛋白提取工艺优化结果
2.2.1 不同单因素对球蛋白提取的影响
提取温度对花生球蛋白提取的影响如图3(a),随温度的增加,蛋白含量明显增加,增至50℃后,由于球蛋白溶解后发生少量变性导致蛋白含量明显下降,故球蛋白的较佳提取温度为50℃。
提取时间对花生粕球蛋白的影响如图3(b),随时间的增加,蛋白含量明显增加,增至10 min后,蛋白含量无明显升高,故球蛋白提取较佳时间为10 min。
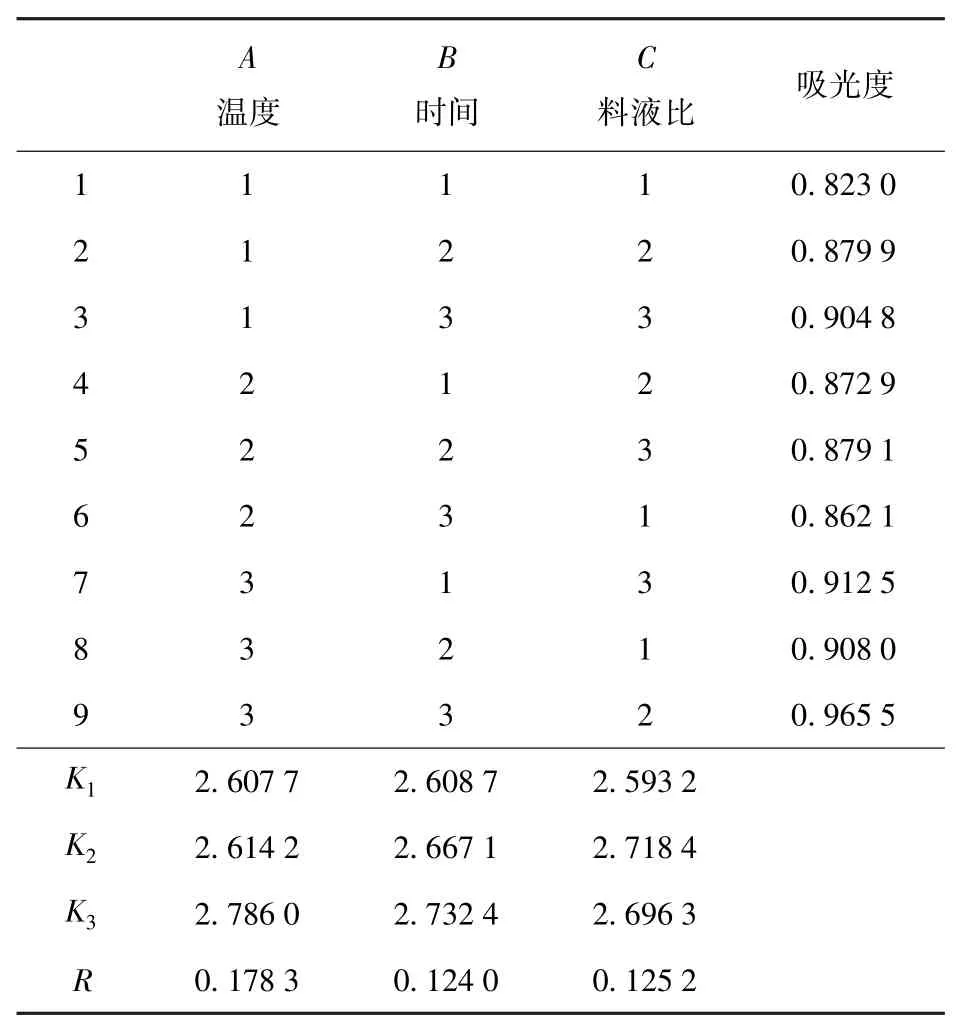
表2 清蛋白正交试验结果Tab.2 Results of orthogonal experiment for albumin
NaCl溶液的浓度对花生粕球蛋白提取的影响如图3(c),随着NaCl溶液质量浓度的增加,蛋白含量明显增加,NaCl溶液质量浓度增加至0.3 g/L后,球蛋白含量明显下降,低浓度离子会增加蛋白质表面电荷量,增强蛋白质与水分子的作用,产生盐溶现象,当离子浓度过高时,会出现盐析现象,蛋白质溶解度降低[19],故球蛋白提取所用NaCl溶液较佳质量浓度为0.3 g/L。料液比对花生粕球蛋白提取的影响如图3(d),随着料液比的增加,蛋白质含量明显增加,当料液比增加至1∶14后,蛋白质含量呈下降趋势,故提取球蛋白较佳料液比为1∶14。
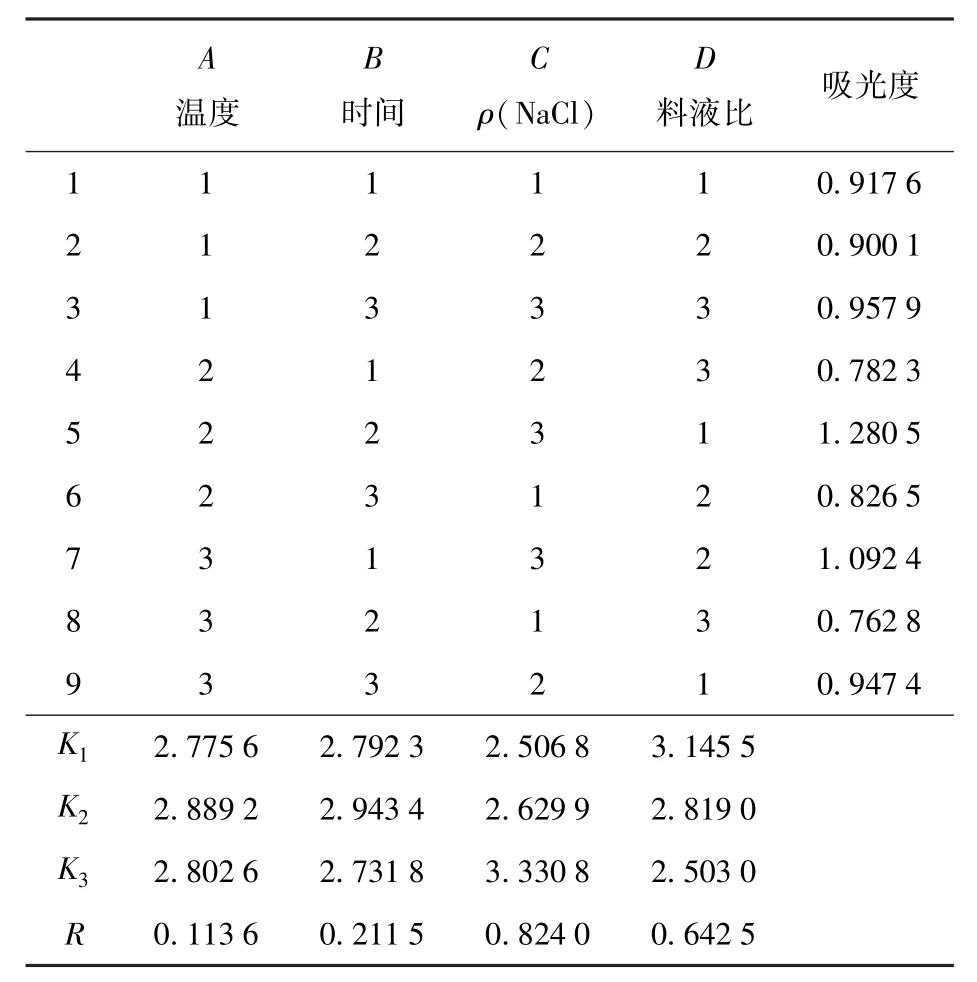
表3 球蛋白正交试验结果Tab.3 Results of orthogonal experiment for globulin
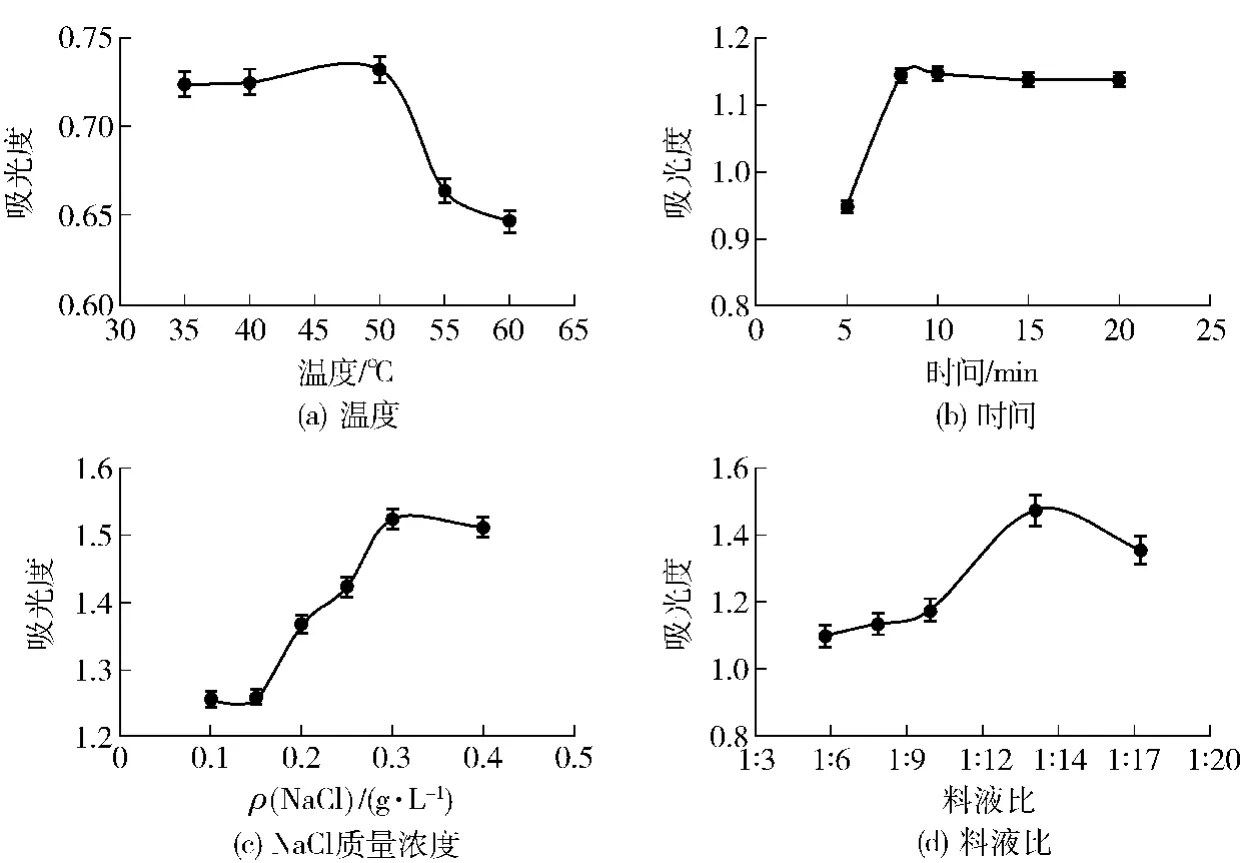
图3 提取条件对花生粕球蛋白提取液吸光度的影响Fig.3 Effects of extraction condition on extraction of globulin
2.2.2 球蛋白正交试验结果分析
表3为球蛋白提取正交试验结果。由表3的极差分析结果可以看出,RC>RD>RB>RA,4个因素对花生粕球蛋白提取的影响大小依次为NaCl溶液质量浓度(C)、料液比(D)、提取时间(B)、提取温度(A)。4个因素中,NaCl溶液质量浓度和料液比的影响较为显著,其中NaCl溶液质量浓度的影响更为显著。在试验设计范围内,优化得到的超声提取花生粕球蛋白的较佳条件为A2B2C3D1,即提取温度50℃、提取时间10 min、NaCl溶液质量浓度0.4 g/L、料液比1∶10。
2.3 醇溶蛋白提取工艺优化结果
2.3.1 不同单因素对醇溶蛋白提取的影响
提取时间对花生粕醇溶蛋白提取的影响如图4(a)所示,随着时间的增加,蛋白质含量明显增加,当提取时间增加至10 min时,蛋白质饱和达到最大值,蛋白质含量基本不变[17],故醇溶蛋白的较佳提取时间为10 min。
乙醇浓度对花生粕醇溶蛋白提取的影响如图4(b)所示,随着乙醇浓度的增加蛋白含量缓慢上升,乙醇浓度增至75%后,蛋白含量下降,最佳乙醇溶液体积分数为75%。
料液比对花生粕醇溶蛋白提取的影响如图4(c)所示,随着料液比的增加,蛋白质含量明显增加,当料液比增加至1∶8后,蛋白质含量下降,故醇溶蛋白提取的最佳料液比为1∶8。
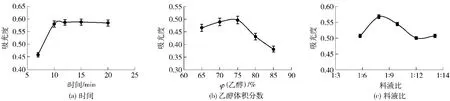
图4 提取条件对花生醇溶蛋白提取液吸光度的影响Fig.4 Effects of extraction condition on extraction of prolamine
2.3.2 醇溶蛋白正交试验结果分析
表4为醇溶蛋白提取正交试验结果。由表4的极差分析结果可以看出,RC>RA>RB,3个因素对花生粕醇溶蛋白提取的影响大小依次为料液比(C)、乙醇浓度(A)、提取时间(B)。3个因素中,乙醇浓度和料液比的影响较为显著,其中料液比的影响更为显著。在试验设计范围内,优化得到的超声提取花生粕醇溶蛋白的较佳条件为A1B3C1,即乙醇溶液体积分数70%、提取时间12 min、料液比1∶6。
2.4 谷蛋白提取工艺优化结果
2.4.1 不同单因素对花生粕谷蛋白提取的影响
提取温度对花生粕谷蛋白提取的影响如图5(a)所示,随着温度增加,蛋白质含量明显增加,增至45℃后,蛋白质因温度增高变性而导致含量降低,故提取花生粕谷蛋白的较佳温度为45℃。
提取时间对花生粕谷蛋白提取的影响如图5(b)所示,随时间的增长蛋白质含量逐渐增大,增至15 min后,由于谷蛋白溶解后发生少量水解导致蛋白质含量下降,故谷蛋白的较佳提取时间为15 min。
pH值对花生粕谷蛋白提取的影响如图5(c)所示,随pH值的增加,蛋白质含量增加,在pH值为8时,谷蛋白的提取率最大,碱性过强会引起某些氨基酸发生脱氨、脱羧,将氨基酸转变为有毒化合物[20],谷蛋白提取的较佳pH值为8。
料液比对花生粕谷蛋白提取的影响如图5(d)所示,料液比为1∶8时,蛋白质提取率最高。由于在前3次提取中持有水分,因此在此次提取中较小的料液比更有利于谷蛋白的提取,故谷蛋白提取的较佳料液比为1∶8。
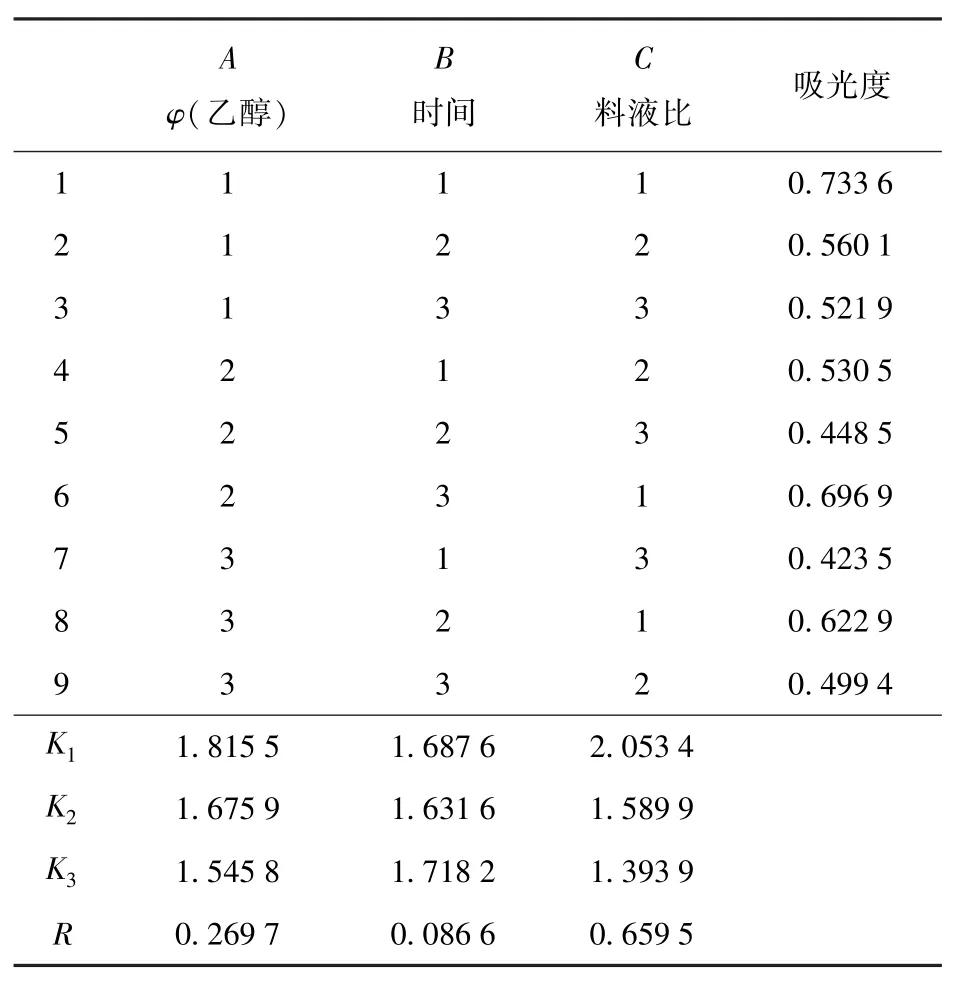
表4 醇溶蛋白正交试验结果Tab.4 Results of orthogonal experiment for prolamine
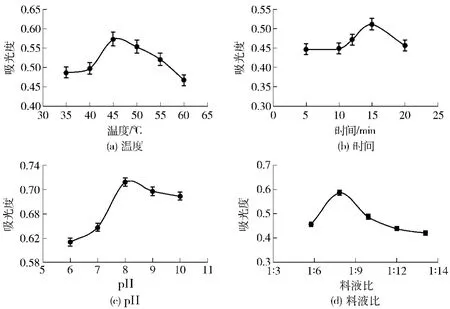
图5 提取条件对花生粕谷蛋白提取液吸光度的影响Fig.5 Effects of extraction condition on extraction of glutelin
2.4.2 谷蛋白正交试验结果分析
表5为谷蛋白提取正交试验结果。由表5的极差分析结果可以看出,RC>RB>RA>RD,4个因素对花生粕蛋白提取的影响大小依次为pH(C)、提取时间(B)、提取温度(A)、料液比(D)。4个因素中,pH值的影响较为显著。在试验设计范围内,优化得到的超声提取花生粕谷蛋白的较佳条件为A2B2C1D3,即提取温度45℃、提取时间15 min、pH值8、料液比1∶10。
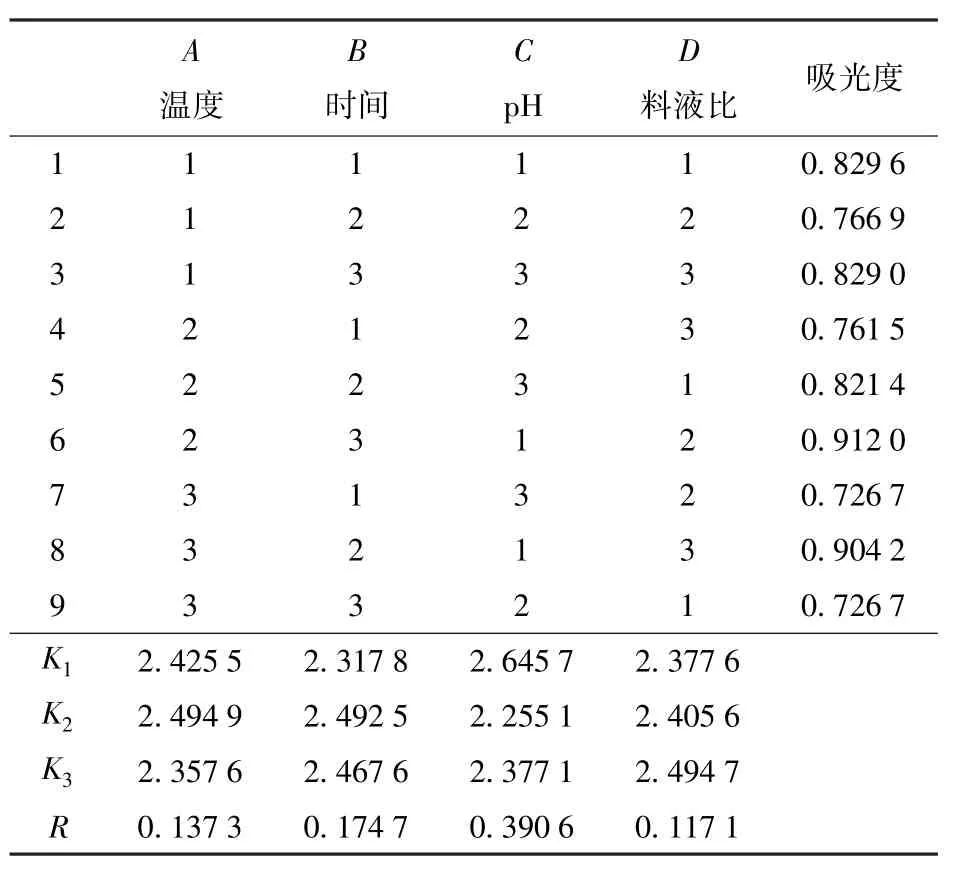
表5 谷蛋白正交试验结果Tab.5 Results of orthogonal experiment for glutelin
2.5 花生粕4种蛋白含量测定结果
BCA试剂盒测定可溶性蛋白浓度所绘制的标准曲线如图6,根据此标准曲线及凯氏定氮法计算得出花生粕4种蛋白的提取率和含量测定结果如表6。清蛋白的提取率为53.59%,远远大于其他3种蛋白。在花生粕蛋白含量测定结果中,清蛋白和球蛋白的纯度大于醇溶蛋白和谷蛋白。
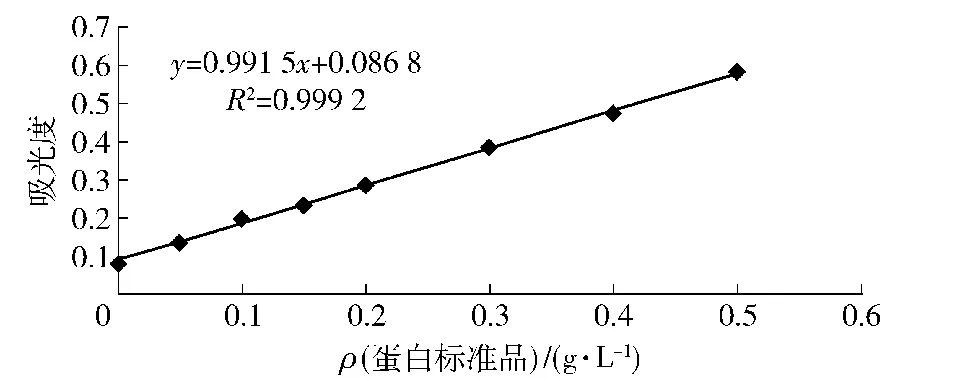
图6 蛋白标准品标准曲线Fig.6 Standard curve of standard protein product albumin
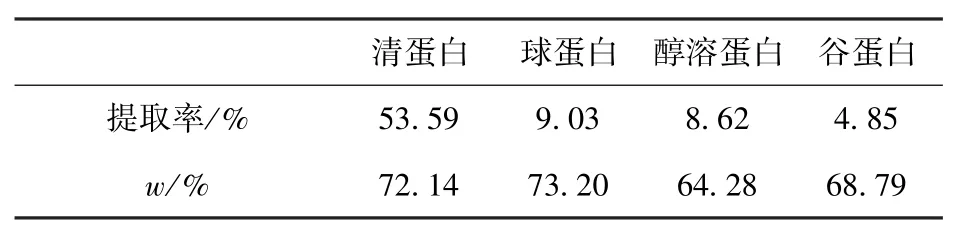
表6 花生4种蛋白提取率及含量测定结果Tab.6 Yield and purity of four protein in peanut meal
2.6 花生粕4种蛋白电镜扫描结果
花生粕4种蛋白的电镜扫描结果如图7,在2 000倍扫描电镜下观察花生粕4种蛋白,清蛋白的表面有棱状突起和孔状结构,突起以外的位置较平滑;球蛋白的表面凹凸不平,没有孔状结构;醇溶蛋白表面极不平整,呈球状,并且紧密连接在一起;谷蛋白的表面较醇溶蛋白平整,但有不规则的突起结构。由于4种蛋白的结构不同,故其所表现性质也不同。

图7 花生粕4种蛋白的电镜扫描结果Fig.7 Scanning results of four protein fractions on electron microscope
3 结论
通过采用超声辅助分级提取法对花生粕中清蛋白、球蛋白、醇溶蛋白和谷蛋白进行工艺研究,结果表明:1)花生粕清蛋白提取的较佳条件为提取温度50℃、时间12 min、料液比1∶12;花生粕球蛋白较佳提取条件为提取温度50℃、时间10 min、NaCl溶液质量浓度0.4 g/L、料液比1∶10;花生粕醇溶蛋白较佳提取条件为乙醇溶液体积分数70%、时间12 min、料液比1∶6;花生粕谷蛋白较佳提取条件为提取温度45℃、时间15 min、pH值8、料液比1∶10。2)花生粕清蛋白的提取率为53.59%,质量分数为72.14%;球蛋白的提取率为9.03%,质量分数为73.20%;醇溶蛋白的提取率为8.62%,质量分数为64.28%;谷蛋白的提取率为4.85%,质量分数为68.79%。3)通过扫描电镜观察,花生粕4种蛋白具有不同的结构特征。
实验结果表明,采用分级提取结合超声辅助提取法,实现了花生粕中4种蛋白质的提取分离,提取过程安全低毒、设备简单、操作容易、提取率较高、用时较少,对花生粕蛋白质工业化生产具有一定参考意义。
[1]Su G W,Ren J Y,Yang B,et al.Comparison of hydrolysis characteristics on defatted peanut meal proteins between a protease extract from Aspergillusoryzae and commercial proteases[J].Food Chemistry,2001,126:1306-1311.
[2]赵晓燕,孙秀平,陈锋亮,等.花生蛋白的研究进展与开发利用现状[J].中国粮油学报,2011,26(12):118-122.
[3]Wu H W,Wang Q,Ma T Z,et al.Comparative studies on the functional properties of various protein concentrate preparations of peanut protein[J].Food Research International,2009,42:343-348.
[4]吴肖,刘通讯,林勉.花生粕酶水解液中黄曲霉毒素脱毒定性研究[J].粮油食品科技,2003,11(1):32-33.
[5]刘传富,张兆静.花生蛋白及其在食品中的应用[J].中国食物与营养,2005(1):24-25.
[6]张岩,肖更生.花生粕的应用进展[J].食品工业科技,2006(8):197-198.
[7]张伟,徐志宏,孙智达,等.花生粕提取蛋白质工艺的优化研究[J].食品工业科技,2006(12):125-127,131.
[8]章玉清,杨瑞金,张文斌,等.蒸汽闪爆结合碱溶酸沉法提取高温花生粕中的蛋白质[J].食品工业科技,2013,34(14):278-282,286.
[9]王章存,王雷,董吉林,等.酶法预处理对花生蛋白提取效果的影响[J].农业工程学报,2009,25(3):287-290.
[10]李明姝,姚开,贾冬英,等.碱提酸沉法制取花生分离蛋白的优化条件[J].中国油脂,2004,29(11):21-23.
[11]YU Jianmei,Ahmedna M,Goktepe L.Peanut protein concentrate:production and functional properties as affected by processing[J].Food Chemistry,2007,103(1):1121-1129.
[12]Adebiyi A P,Adebiyi A O,Hasegawa Y,et al.Isolation and characterization of protein fractions from deoiled rice bran[J].European Food Research and Technology,2009,228(3):391-401.
[13]冯明珠,何聪芬,赵华,等.燕麦麸蛋白质的Osboren分类及SDS-PAGE电泳分析[J].食品工业科技,2007(1):77-79.
[14]郭荣荣,章肇敏,关杨,等.甜荞蛋白质组分的物化特性研究[J].中国粮油学报,2008,23(2):52-55.
[15]李小华,于新,毕阳.非洲山毛豆种子蛋白质组分分析[J].食品工业科技,2010(3):158-161.
[16]王艳玲.米糠中四种蛋白的提取工艺及特性研究[D].哈尔滨:东北农业大学,2013.
[17]陈义勇,王伟,沈宗根,等.米糠可溶性蛋白提取工艺中各因素影响的研究[J].现代食品科技,2006,22(4):64-67
[18]黄娜.麦胚清蛋白、球蛋白的提取及其理化和功能性质的研究[D].哈尔滨:东北农业大学,2011.
[19]Marion M.Rapid and sensitive method for the quantitation of microgram quantities ofprotein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[20]邵佩兰,徐明.提取大豆分离蛋白的工艺研究[J].粮油加工与食品机械,2005(9):47-48.
Study on Extraction and Structure of Four Kinds of Peanut Proteins
LI Ting,PENG Yuning,LI Qiang,WANG Dandan,REN Hong*
(School of Food and Chemical Engineering/Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients/Beijing Key Laboratory of Flavor Chemistry/Beijing Laboratory for Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China)
Four protein fractions(albumin,globulin,prolamine and glutelin)were fractionated from peanut meal and their surface structures were observed using scanning electron microscope.The result showed that the optimum extraction condition for albumin was temperature 50℃,extraction time 12 min,and the ratio of material to solvent 1∶12.The extraction yield and purity of albumin was 53.59%and 72.14%.The optimum extraction condition of globulin was temperature 50℃,concentration of NaCl is 0.4 g/L,and the ratio of material to solvent 1∶10.The extraction yield and purity of globulin were 9.03%and 73.20%.The optimum extraction condition of prolamine was concentration of ethanol 70%,extraction time 12 min,and the ratio of material to solvent 1∶6.The extraction yield and purity of prolamine were 8.62%and 64.28%.The optimum extraction condition of glutelin was extraction temperature 45℃,extraction time 15 min,pH 8,and the ratio of material to solvent 1∶10.The extraction yield and purity of glutelin were 4.85%and 68.79%.The result of scanning electron microscope showed that the surface of the four protein fractions was different.
peanut protein;process optimization;scanning electron microscope
叶红波)
TS229
A
10.3969/j.issn.2095-6002.2015.03.007
2095-6002(2015)03-0035-08
李婷,彭宇宁,李强,等.4种花生蛋白的分级提取及其结构的扫描电镜观察[J].食品科学技术学报,2015,33(3):35-42.
LI Ting,PENG Yuning,LI Qiang,et al.Study on extraction and structure of four kinds of peanut proteins[J].Journal of Food Science and Technology,2015,33(3):35-42.
2014-10-13
国家“863”计划项目(2011AA060701)。
李 婷,女,硕士研究生,研究方向为天然活性物质;
*任 虹,女,副教授,博士,主要从事天然活性物质方面的研究。
。
