禽呼肠病毒感染对SPF鸡外周血T细胞亚型变化和细胞因子转录的影响
2015-03-06张昆丽谢芝勋谢丽基刘加波邓显文谢志勤罗思思
张昆丽 ,谢芝勋,黄 莉,谢丽基,刘加波,邓显文,谢志勤,范 晴,罗思思
(1.广西大学动物科学技术学院,广西南宁 530004; 2.广西壮族自治区兽医研究所广西畜禽疫苗新技术重点实验室,广西南宁 530001)
研究论文
禽呼肠病毒感染对SPF鸡外周血T细胞亚型变化和细胞因子转录的影响
张昆丽1,谢芝勋2*,黄 莉2,谢丽基2,刘加波2,邓显文2,谢志勤2,范 晴2,罗思思2
(1.广西大学动物科学技术学院,广西南宁 530004; 2.广西壮族自治区兽医研究所广西畜禽疫苗新技术重点实验室,广西南宁 530001)
为探讨禽呼肠病毒(ARV)对SPF鸡外周血淋巴细胞中CD4+、CD8+T细胞数量变化和细胞因子mRNA转录水平的影响,利用流式细胞术和实时荧光定量PCR方法分别测定了ARV感染后1、7、14、21、28、35 d感染组和对照组SPF鸡外周血淋巴细胞中CD4+、CD8+T细胞含量和细胞因子IL-1β、IL-6、IL-17、IL-18、IFN-γ、TNF-α基因mRNA相对转录时相。流式细胞术检测结果表明,SPF鸡感染ARV后7 d和14 d CD4+、CD8+T细胞比值高于对照组,其中感染7 d,CD8+T细胞含量差异显著(P<0.05);感染后1、21、28、35 d感染组CD4+、CD8+T细胞比值均低于对照组,感染1 d后CD4+、CD8+T细胞含量均差异显著(P<0.05),说明外周血T细胞亚型变化是ARV感染的重要表现之一。实时荧光定量PCR结果表明,与对照组相比,感染组外周血淋巴细胞中IL-1β、IL-6(除7 d外)、IL-18(除14 d外)和TNF-α在整个感染过程中表达上调,IL-17和IFN-γ除感染1 d外,均表达下调,说明IL-1β、IL-6、IL-17、IL-18、IFN-γ和TNF-α均参与了ARV的感染进程。
禽呼肠病毒;细胞因子;转录水平;流式细胞术;外周血淋巴细胞
禽呼肠病毒(Avian reovirus, ARV)属呼肠病毒科、正呼肠病毒属的成员,可感染鸡、火鸡、鸭、鹅及野鸟等多种禽类[1]。目前,ARV广泛分布于世界各地,自20世纪80年代中期开始我国各地相继分离到ARV。ARV感染导致鸡群生长缓慢,生产性能下降,免疫抑制,从而导致疫苗免疫失败,各种细菌性病毒性疾病的继发感染给全球养禽业造成巨大的经济损失。
CD3是所有T细胞的表面标志,CD4则是辅助T细胞(Th)和效应T细胞的表面标志,Th细胞包括Th0、Th1、Th2、Th17亚群,具有辅助、诱导细胞和体液免疫的作用,Th通过释放多种细胞因子辅助B细胞和效应T细胞活化,上调机体的免疫功能;CD8是细胞毒T细胞(CTL或 Tc)和抑制T细胞(Ts)的表面标志,细胞毒性T细胞(CTL)在清除病原和导致病理损伤过程中起重要作用,抑制T细胞(Ts)通过释放抑制因子抑制B细胞和效应T细胞活化,下调机体的免疫功能。多种禽类病毒性疾病研究表明,病毒感染可导致T细胞亚型变化和细胞因子表达水平异常,如马立克病毒感染可导致CD8+T细胞数量明显增加[2]和IFN-γ表达量增加[3];H5N1亚型禽流感病毒可引起“细胞因子风暴”效应和激发体内CD4+、CD8+T细胞异常表达并参与病理损伤[4];IBV感染可导致气管黏膜组织多种细胞因子被局部激活[5]。但目前对ARV的研究主要是病原分离鉴定、病毒全基因测序、临床检测试剂盒开发等[6-7],对禽呼肠病毒的致病机制研究相对较少,目前尚未见ARV感染对鸡外周血T细胞亚型变化及细胞因子转录的相关研究。本研究通过建立禽呼肠病毒的人工感染SPF鸡动物模型,分别利用流式细胞术和实时荧光定量PCR检测方法测定分析ARV感染后不同时间段SPF鸡外周血淋巴细胞中CD4+、CD8+T细胞含量和细胞因子IL-1β、IL-6、IL-17、IL-18、IFN-γ、TNF-α mRNA的转录水平,探讨T细胞亚型和细胞因子变化在禽呼肠病毒感染的过程中的作用,为禽呼肠病毒致病机理的进一步阐述奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要仪器与试剂 Gallios三激光10色流式细胞仪为BackMan公司产品;Lightcycler 2.0荧光定量PCR仪为Roche公司产品;RNA提取试剂Trlzol LS Reagent为Invitrogen公司产品;反转录酶、dNTP、RNA抑制剂、RNA/DNA样品保护液、SYBR○RPremix ExTaqⅡ等为宝生物工程(大连)有限公司产品。
1.1.2 病毒和试验用动物 禽呼肠病毒S1133标准强毒株(ARV-S1133)为中国兽药监察所产品;SPF鸡胚为北京梅里亚公司产品,购买后在实验室人工孵化,并在SPF隔离器中饲养至试验结束。
1.2 方法
1.2.1 动物处理和样品采集 7日龄SPF雏鸡62只随机分成2组,每组31只。ARV感染组:双侧足垫注射ARV-S1133病毒0.2 mL/只(约为104个TCID50);对照组:双侧足垫注射无菌PBS,0.2 mL/只。感染组和对照组在隔离器中分开饲养,饲养条件相同。每组分别于感染后1、7、14、21、28、35 d随机取5只鸡,经翼静脉各采集外周血1 mL,肝素钠抗凝,并将采血后的试验鸡清除试验组。翼静脉抗凝血的处理参照淋巴细胞分离液说明书,分离得到鸡外周血淋巴细胞。
1.2.2 外周血淋巴细胞中CD4+、CD8+T细胞含量的检测 参照淋巴细胞分离液说明,制备浓度为1×106个/mL的鸡外周血淋巴细胞悬液。参照试剂说明,染色标记。24 h内上机检测感染组和对照SPF鸡外周血淋巴细胞中CD4+、CD8+T细胞的含量。每组检测5个样品,设置每份样品获取10 000个细胞,获取淋巴细胞阳性百分比。
1.2.3 RNA抽提及反转录 分离得到外周血淋巴细胞,加入750 μL Trizol裂解。参照Trizol LS Reagent使用说明书分别提取感染组和对照组各时间点的组织样品RNA。抽提完后加入DEPC水35.0 μL、反转录引物1.5 μL;70 ℃ 10 min;冰浴5 min;加入反转录体系:5×Prime Script 10 μL、dNTP 2 μL 、RNA酶抑制剂0.5 μL、Prime Script Reverse Transcriptase 1 μL,瞬时离心,42 ℃水浴90 min;95 ℃水浴5 min灭活反转录酶,制备的cDNA置-30 ℃保存备用。
1.2.4 实时荧光定量PCR检测 以反转录得到的cDNA为模板,内参基因GAPDH为对照,用已建立的各细胞因子real-time PCR检测方法[8-9]测定组织中各细胞因子(IL-1β、IL-6、IL-17、IL-18、IFN-γ、TNF-α)和内参基因GAPDH的Ct值。每个采样时间点,试验组对照组各取3个样品,每个样品重复3次。1.2.5 数据处理和统计分析 流式细胞术数据用Backman Coulter的配机软件分析淋巴细胞检测结果,并用Excel制图;real-time PCR后,获得目的基因和内参基因GAPDH的Ct值。以GAPDH为参照,采用2-ΔΔCT法计算各基因在不同时相的相对表达量,用GraphPad Prism 6制图,所有结果用Excel进行单因素方差分析。
2 结果
2.1 ARV感染后试验鸡外周血中CD4+T细胞的变化
分离得到的外周血淋巴细胞用CD4+FITC单抗染色后,用流式细胞仪检测CD4+T细胞数量,检测分析结果如图1所示。SPF鸡感染禽呼肠病毒感染后7 d和14 d后CD4+T细胞比值高于对照组(P<0.01),表明感染7 d~14 d是机体清除ARV的主要时期;感染后1、21、28、35 d感染组CD4+T细胞比值均低于对照组,其中感染1 d和21 d后差异显著(P<0.05)表明ARV可抑制感染后期CD4+T细胞的分化。
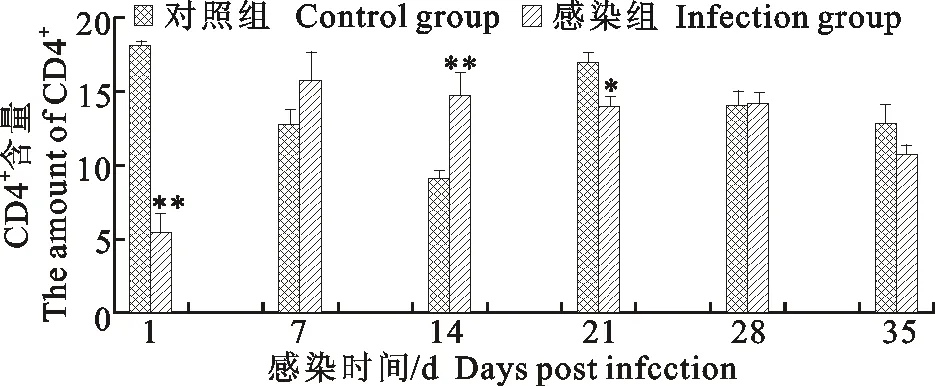
图1 外周血中CD4+T细胞含量的变化Fig.1 The changes of CD4+T cell levels in peripheral blood
2.2 ARV感染后试验鸡外周血CD8+T细胞的变化
分离得到的外周血淋巴细胞用CD8+FITC单抗染色后,用流式细胞仪检测CD8+T细胞数量,检测分析结果如图2所示。SPF鸡感染禽呼肠病毒感染1 d,由于机体对病毒入侵的急性抗病毒反应和应激作用,血液中的CD8+T细胞显著低于对照组,且差异显著(P<0.05);由于病毒的持续性作用,感染后7 d和14 d,使得血液中CD8+T细胞含量升高,且与对照组相比差异显著(P<0.05);感染21、28、35 d,血液中CD8+T细胞含量与对照组相比均下降,但差异不显著(P>0.05),这可能与机体的全身性免疫调节和对病毒的免疫耐受相关。
2.3 试验鸡外周血中6种细胞因子表达的变化
鸡感染ARV-S1133株后1、7、14、21、28、35 d后,细胞因子IL-1β、IL-6、IL-17、IL-18、IFN-γ、TNF-α在外周血白细胞中的表达变化如图3所示。结果表明,IL-1β和TNF-α在整个感染过程中均保持均一水平(约1.5倍);IL-17和IFN-γ在感染后1 d分别上调3.23倍和1.67倍,感染7 d后IL-17和IFN-γ mRNA表达量均下调;IL-6除感染14 d外均表达上调;IL-18在外周血白细胞中的变化最为明显,尤其是感染后1、14和28 d,其mRNA表达量与对照组相比分别上调24.11、16.40、5.82倍(P<0.05)。
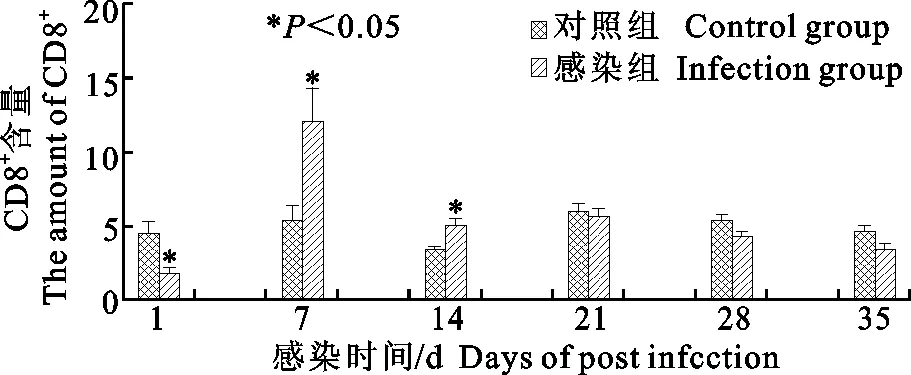
图2 外周血中CD8+T细胞量的变化Fig.2 The changes of CD8+T cell levels in peripheral blood
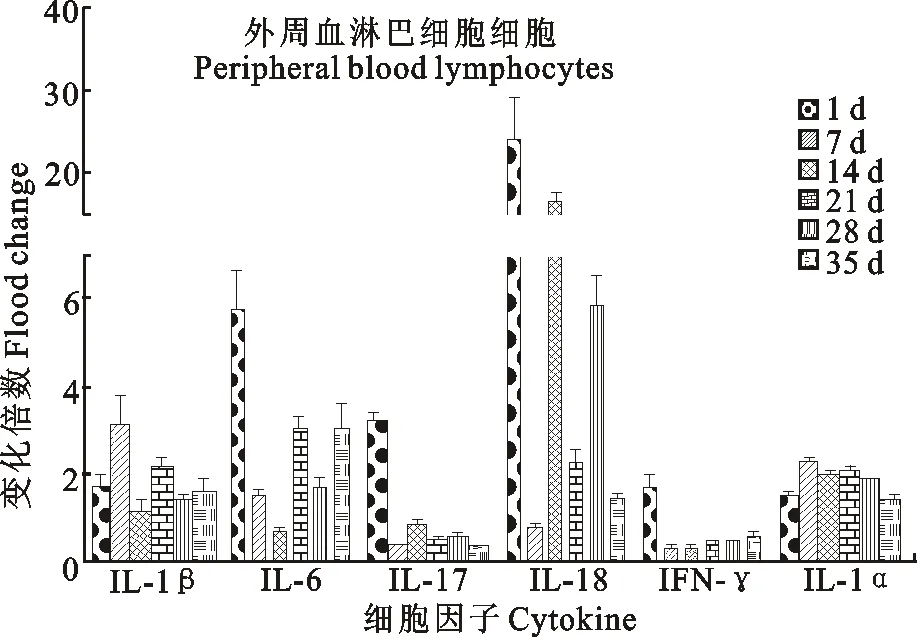
图3 ARV感染SPF鸡外周血中各细胞因子基因mRNA的相对动态转录时相Fig.3 Relative transcription dynamic phases of cytokine gene mRNA in ARV-infected SPF chickens
3 讨论
CD4、CD8是参与T细胞识别、黏附和活化过程的主要CD分子之一。CD4+T细胞称为辅助性T细胞,包括Th0、Th1和Th2亚群。Th细胞的抗病毒作用在机体的病毒免疫机制中十分重要。CD4分子是MHC Ⅱ类分子限制的T细胞TCR识别抗原的辅助受体,当ACP递呈与MHC Ⅱ类分子结合的非自身抗原肽(如病毒肽)时,激活CD4+T细胞。激活后的CD4+T细胞可辅助B淋巴细胞产生抗体,启动免疫反应[10]。CD4+T细胞含量高时,表明机体免疫功能强,不易被病原体感染,当外源性病原微生物侵入体内能很快启动免疫反应,对抗和清除病原。研究结果表明,SPF鸡感染禽呼肠病毒感染后21、28、35 d感染组CD4+T细胞比值均低于对照组,且IL-17和IFN-γmRNA也表达下调,表明在ARV感染后期CD4+T细胞活化受到抑制,并可能进一步抑制Th细胞的分化,导致Th1典型细胞因子IFN-γ和Th17细胞因子IL-17表达下调;CD4+水平降低,且具有促进B细胞产生促进ADCC和补体活化作用的抗体的IFN-γ表达量下降,也可能提示了B淋巴细胞产生抗体的辅助作用和对其他免疫细胞的活化作用减弱,表明感染鸡细胞免疫和体液免疫机能发生障碍,是ARV感染导致免疫抑制的重要表现。CD8+T细胞(细胞毒性T细胞,CTL)对清除病原起重要作用,细胞内复制的病原体被递呈在感染细胞表面的MHC Ⅰ类分子上,使感染细胞成为CTL的靶标。本研究发现SPF鸡感染ARV后7 d和14 d,血液中CD8+T细胞含量升高,其中感染7 d与对照组相比差异显著(P<0.05),这可能是病毒大量感染机体后诱导细胞毒性T细胞(Tc)增殖,清除被感染的细胞的结果,CD8+T细胞数量上的扩增,也有可能提示抑制性T细胞群的活性增强,从而导致免疫调节发生异常,这可能与ARV感染引起鸡出现免疫抑制有关。ARV感染21 d后,感染组外周血CD4+和CD8+T细胞含量与对照组相比,差异不显著,这可能是因为本试验感染日龄或病毒感染剂量有关;也有可能是ARV与感染鸡相互作用导致体内一系列综合免疫反应后的结果。
细胞因子在病毒的致病机制中具有重要作用。Kaiser P等[3]研究表明IL-18与马立克病毒的免疫抑制相关;Brown C等[11]研究发现IFN-γ与新城疫病毒的免疫抑制相关;在动物病毒性传染病中,如马立克病毒、传染性法氏囊病病毒、网状内皮组织增生病病毒、H5N1亚型AIV感染均可引起雏鸡体内TNF-α上调[12-13];流感病毒研究表明,CD8+T细胞的出现与病毒的清除同步,其作用方式为直接裂解被感染细胞或释放IFN-γ和TNF-α等促炎性细胞因子,同时构成了炎性细胞渗出的主要成分。本研究发现,在SPF鸡感染ARV后1 d,外周血中具有抗病毒作用的IL-18、IFN-γ、TNF-α的mRNA表达量均上调(IL-18和TNF-α,P<0.05),而外周血CD8+T细胞含量则在14 d显著增加(P<0.05),表明在感染早期机体启动免疫保护程序,通过上调抗病毒因子表达水平,清除和控制病毒感染。细胞因子mRNA的表达早于与CD8+T细胞含量上升,可能是由于基因表达和蛋白质合成之间的时间滞后。炎症细胞因子IL-1β、IL-6(除14 d)在ARV感染过程中持续表达上调,解释了ARV感染引起组织器官的广泛炎症,如肝炎、心肌炎、胃肠炎、关节炎、肌腱炎等[1]。
本研究通过流式细胞术检测数据发现ARV感染可引起鸡外周血CD4+、CD8+T细胞含量的异常变化和细胞因子IL-1β、IL-6、IL-17、IL-18、IFN-γ、TNF-α mRNA转录水平发生变化,说明外周血T细胞亚型变化是ARV感染的重要特征之一,且上述6个细胞因子均参与了ARV的感染进程,为ARV分子致病机制的进一步研究奠定了基础。
[1] Calnek B W.禽病学[M].高 福, 苏敬良, 译. 10版.北京:中国农业出版社,1999:902-913.
[2] Morimura T, Hattori M, Ohashi K, et al. Immunomodulation of peripheral T cells in chickens infected with Marek's disease virus: involvement in immunosuppression[J].J Gen Virol,1995,76(Pt12):2979-2985.
[3] Kaiser P, Underwood G, Davison F. Differential cytokine responses following Marek′s disease virus infection of chickens differing in resistance to Marek′s disease[J].J Virol,2003,77(1):762-768.
[4] 吕 进, 王希良.流感病毒感染介导的免疫病理损伤研究进展[J].生物化学与生物物理进展,2009,36(8):961-967.
[5] Guo X. Molecular mechanisms of mucosal immunity using avian
infectious bronchitis virus (IBV) and CpG oligodeoxynucleotides (ODN) as model systems[D].South Dakota State University,2009.
[6] Teng L Q, Xie Z X, Xie L J, et al. Complete genome sequences of an avain orthoreovirus isolated from Guangxi,China[J].Genome Announcements,2013,1(4):495-13.
[7] 黄娇玲, 谢芝勋, 谢丽基, 等. 基于纳米材料电化学免疫传感器检测禽呼肠孤病毒研究[J].中国农业科学,2014,47(5):1006-1012.
[8] 张昆丽, 谢芝勋, 滕丽琼, 等.鸡IL-1β、IL-18、TNF-α基因荧光定量PCR检测方法的建立[J].中国畜牧兽医,2013,40(9):90-95.
[9] 张昆丽, 谢芝勋, 滕丽琼, 等.鸡IL-6、IL-17、IFN-γ实时荧光定量PCR检测方法的建立[J].南方农业学报,2013,44(10):1740-1745.
[10] Mark Tak W, Saunders Mary E.免疫应答导论[M].吴玉章,等.译.北京:科学出版社,2012.
[11] Brown C, King D J, Seal B. Detection of amacrophage-pecific antigen and the production of interferon gamma in chickens infected with Newcastle disease virus[J].Avian Dis,1999,43(4):696-703.
[12] 陈 龙, 王丙云, 毛鑫智, 等.雏鸡感染传染性法氏囊病病毒后血浆肿瘤坏死因子-α和花生四烯酸代谢物的动态变化[J].中国兽医学报,1999,19(6):531-534.
[13] 郑世民, 高雪丽, 刘超男, 等. H5N1禽流感病毒感染雏鸡免疫器官细胞因子的变化[J].畜牧兽医学报,2010,41(6):755-760.
Effects of Avian Reovirus Infection on Peripheral Blood T-cell Subtype Change and Cytokine Transcription in SPF Chickens
ZHANG Kun-li1,XIE Zhi-xun2,HUANG Li2,XIE Li-ji2,LIU Jia-bo2,DENG Xian-wen2,XIE Zhi-qin2,FAN Qing2,LUO Si-si2
(1.CollegeOfAnimalScienceandTechnology,GuangxiUniversity,Nanning,Guangxi,530004,China; 2.GuangxiVeterinaryResearchInstitute,GuangxiKeyLaboratoryofAnimalVaccinesandNewTechnology,Nanning,Guangxi,530001,China)
In order to explore the avian reovirus effect on the amount of CD4+, CD8+T cells and cytokine mRNA transcription levels of peripheral blood lymphocytes in SPF chickens, we examined the amount of peripheral blood CD4+, CD8+T cells by flow cytometry and determined mRNA expression levels of IL-1β,IL-6,IL-17,IL-18,IFN-γ and TNF-α by fluorescence quantitative PCR on 1, 7, 14, 21, 28 and 35 days in SPF chickens after infection with ARV. Our results showed that 7 d and 14 d post-infection, CD4+and CD8+T cell ratio in experiment group was higher than that in control group. Seven days post-infection, CD8+T cells were significantly increased(P<0.05); 1, 21, 28, 35 d post-infection, CD4+and CD8+T cell ratio in experiment group was lower than that in control group. One day post-infection, CD4+and CD8+ratio was significantly altered(P<0.05). Quantitative PCR results showed that, compared with the control group, the expression of IL-1β, IL-6 (except 7 d), IL-18 (except 14 d), TNF-α were up-regulated, whereas except 1 d, IL-17 and IFN-γ were down-regulated during the entire course of infection in peripheral blood lymphocytes.
Avian reovirus;cytokine;transcription level;flow cytometry;peripheral blood lymphocyte
2014-06-01
国家自然科学基金项目(31160512);广西科技项目(桂科重1222003-2-4,2013GXNSFBA019120);桂渔牧科项目(1304523);广西特聘专家专项(2011B020)
张昆丽(1988-),女,云南玉溪人,硕士研究生,主要从事禽病防治与病原分子生物学研究。*
S852.659.4
:A
:1007-5038(2015)01-0001-04
