鸡爪槭叶片色素组成及叶色变化1)
2015-03-06蔡雪雁李厚华李玲于航陈盖包努恩都特
蔡雪雁 李厚华 李玲 于航 陈盖 包努恩都特
(西北农林科技大学,杨凌,712100)
责任编辑:任 俐。
随着社会发展,人们对色彩美的需求越来越强烈,不仅仅局限于欣赏自然界天然的绿色之美,而更加追求红肥绿瘦的变化之美、炫彩斑斓的多样之美。但色彩缤纷的花朵花期短,远不能满足人们对自然之物的长久欣赏、留恋之意,而植物叶片具有发育周期长,观赏期长的优势,彩叶树种就成了人们追捧的新奇之物[1]。在越来越多的园林景观设计中,彩叶树种不仅用来点缀、装饰、丰富色彩,更是被用来与其他景观要素相协调,充分营造植物空间的层次感及丰富植物景观,表达特定的园林意境[2]。
鸡爪槭(Acer palmatum Thunb)为槭树科槭树属彩叶树种,落叶小乔木。叶色初春鲜红、夏季变绿,到了秋天再变红,季相变化丰富,且其色彩变化契合季节变换,夏为绿色,给人一种清凉感,秋则转红,平添秋意,加之树姿潇洒而体量适中,可种植形式多样,在园林景观中应当更加广泛的应用。目前,对鸡爪槭转色期叶片色素的研究,主要集中在叶绿素、总花青苷、可溶性糖质量分数、生理变化和影响颜色变化的因子方面[3-6],还未对决定其叶色变化色素进行细化研究。本研究旨在对鸡爪槭各变色时期的主要成色色素进行分析,阐述其变色机理,为彩叶植物新品种培育提供理论参考。
1 材料与方法
以2013年采自本地校园内的鸡爪槭叶片为试验材料,选取生长健壮、长势一致的植株,从初春开始,依次采集鸡爪槭7个变色时期(即鸡爪槭由鲜红变黄绿,黄绿变深绿再变紫红的过程)向阳生长的无破损的叶片(中位叶),包括芽叶期、展叶期、初叶期、小绿期、大绿期、绿叶期和红叶期。取样重复3次,保存于-80℃。
标准品有矢车菊素、槲皮素、矢车菊素半乳糖苷、矮牵牛素、绿原酸、芦丁、二氢杨梅酮、香豆酸、对香豆酸、杨梅素、儿茶素、表儿茶素、根皮苷。
将冰箱中-80℃冻存的材料转置于真空冷冻干燥机,处理48 h后,研磨成粉末备用。
类黄酮提取液:分别精确称量7个变色时期叶片粉末0.25 g,加10 mL甲醇提取,超声3次,合并提取液,旋转蒸发后用原溶液定容至10 mL[7],重复3次。
叶绿体色素提取液:分别精确称量7个变色时期叶片粉末0.1 g,加10 mL 96%乙醇提取[8],重复3次。
花青苷提取液:分别精确称量7个变色时期叶片粉末0.25 g,加10 mL 1%甲醇盐酸提取液提取,超声3次,合并提取液,旋转蒸发后用原溶液定容至10 mL[7],重复3次。
花青素萃取液:取300μL花青苷提取液及600 μL 2N盐酸加入小离心管中,95℃金属浴加热45 min。冰上冷却后加入300μL 3-甲基丁醇,剧烈晃动,离心10 min(8 000 r·min-1,4℃)。置于4℃冰箱待其分层,上层液体含有花青苷水解后的花青素和其他类黄酮,收集上相[7]。
光谱鉴定:用岛津-2450紫外可见分光光度计对上述类黄酮、花青苷提取液及花青素萃取液在200~600 nm检测吸收波峰,对鸡爪槭叶片中所含色素种类进行初步鉴定[9]。
光度测定:用分光光度计分别在663、645、470 nm下测定叶绿体色素提取液在各个吸收波长处的吸收值,据此计算叶绿素和类胡萝卜素的质量分数[8],计算公式如下:
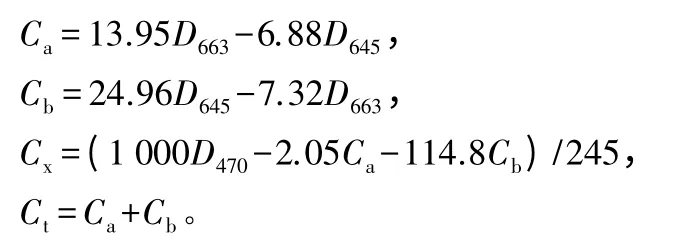
色素质量分数=(色素质量浓度×提取液总量×稀释倍数/样品量)×1 000。
式中:C代表质量分数;D代表吸光度;a代表叶绿素a;b代表叶绿素b;x代表类胡萝卜素;t代表叶绿素(a+b)。
薄层层析分析:取类黄酮提取液、花青素萃取液按顺序点样于薄层板上,将薄层板放置于流动相Formic(V(浓盐酸)∶V(甲酸)∶V(水)=2∶5∶3)中展开,根据Rf值(Rf=原点至组分斑点中心的距离/原点至溶剂前沿的距离)来辅助判断花青素/苷种类[7]。对于自然状态观察不到的类黄酮物质,在紫外光(254 nm)下和氨水熏蒸薄层板后观察颜色变化来推断[10-11]。
高效液相色谱分析:用高效液相色谱仪检测(L-2000),二极管阵列检测器(L-2455),检测波长200~700 nm。检测参数为C18柱,进样量为10μL,柱温40℃,流速0.50 mL·min-1。检测波长为280、360、520、535 nm。流动相参数为A是0.04%的甲酸水溶液,B是色谱级乙腈。梯度洗脱,0~40 min,A.95%~0,B.5%~100%;40~60 min,B.100%。由标准品检测结果绘制标曲,计算叶片中各单体酚的质量分数(mg·kg-1)[7]。
pH值测定:pH值采用细胞液提取法(cell sap extract)测定,采后鲜叶研磨,用pH酸度计进行检测[12]。
统计分析:采用Excel软件处理数据、SPSS软件做相关性分析。
2 结果与分析
2.1 紫外可见分光光度计检测
2.1.1 初步鉴定色素类别
鸡爪槭各变色时期叶片类黄酮提取液、花青苷提取液和花青素萃取液光谱扫描结果显示,类黄酮提取液:芽叶期叶片类分别在紫外区280、290、330 nm有吸收峰,推测其可能含有黄酮醇类、二氢黄酮醇类及酚酸类物质;展叶期、小绿期和大绿期叶片检测到分别在210、250、330、380 nm有吸收峰,推测其可能含有黄酮醇类、黄烷酮类及酚酸类物质;初叶期、绿叶期和红叶期叶片分别在210、240、255、330、390 nm有吸收峰,推测其可能含有黄酮醇类、黄烷酮类及酚酸类物质[13]。花青苷提取液:芽叶期分别在紫外区210、275、330 nm和可见光区530 nm处检测到花青苷特征吸收峰,推测芽叶期叶片中可能存在花青苷类物质,且种类很可能是矢车菊素[14];展叶期、初叶期、小绿期、大绿期、绿叶期、红叶期鸡爪槭叶片分别在210、275、330、470、530 nm检测到吸收峰,推测其可能含有花青苷类物质及类胡萝卜素[13]。花青素萃取液:各时期除了检测到花青苷特征吸收峰外,还检测到初叶期和红叶期水解萃取液在329 nm下有吸收峰,该波峰位于300~330 nm,表明该花青苷分子内有酰基化,其结合的糖基可能为半乳糖[15]。
2.1.2 叶片中叶绿素和类胡萝卜素的质量分数变化
光度测定的结果表明,鸡爪槭叶片中叶绿素的质量分数和类胡萝卜素的质量分数变化趋势基本一致。前3个时期质量分数变化趋势平稳,波动极小;从初叶期开始,叶绿素的质量分数开始逐渐增加,到了大绿期增加的幅度变大,类胡萝卜素的质量分数从大绿期开始增加,这使得绿叶期叶绿素和类胡萝卜素的质量分数均达到最大值,质量分数分别是最小值的2.56倍和1.84倍;绿叶期到红叶期二者质量分数开始急速下降,且最终质量分数均略低于芽叶期(表1)。
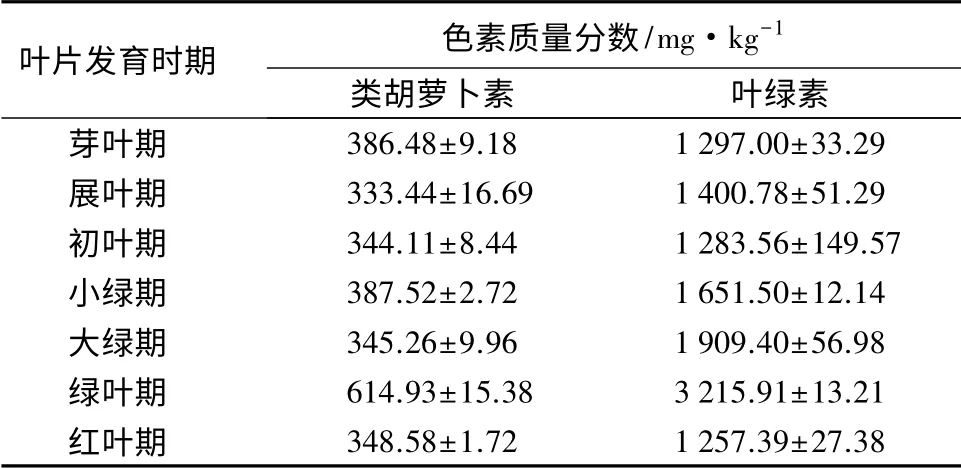
表1 不同叶片发育时期叶绿素和类胡萝卜素质量分数变化
2.2 薄层层析色谱分析
将鸡爪槭叶片花青素萃取液及花青苷提取液按变色时期,顺序点样进行薄层层析,结果表明,各变色时期叶片提取液均观察到红色斑点,花青苷提取液观察到两个肉眼可见的红色斑点,花青素萃取液观察到一个肉眼可见的红色斑点。叶片芽叶期、展叶期、初叶期和红叶期在薄层层析板上红色斑点颜色较深,小绿期、大绿期和绿叶期斑点颜色很淡。芽叶期到绿叶期斑点逐渐变浅,说明花青苷/素的质量分数逐渐减少;红叶期斑点加深,说明花青苷/素质量分数增加。计算结果表明,两个斑点的Rf值分别为0.22和0.57,与标准品Rf值进行对比,与矢车菊素及矢车菊素半乳糖苷的基本一致,因此,可以初步推测鸡爪槭叶片花青苷类物质的种类可能为矢车菊素及矢车菊素半乳糖苷[15]。
薄层板在紫外灯照射下,条带中出现了Rf值为0.07,呈现亮黄色的斑点,而在可见光下此斑点呈现无色,推测可能为二氢黄酮醇类物质;同时还观测到了Rf值为0.66,呈现淡蓝色的新斑点,推测可能为黄烷酮类物质;而可见光下显示为浅红色的斑点在紫外光下为暗橙色,进一步验证了该物质为花青苷类物质[7]。
将薄层板用氨气熏蒸后,在可见光下显现浅红色的斑点变为蓝色。花青苷类物质酸性条件下呈亮红色,碱性条件下呈蓝色。因此,结合自然光下和紫外灯照射下薄层层析的结果,可以判断萃取液中含有花青苷类物质矢车菊素和矢车菊素半乳糖苷[16]。
2.3 高效液相色谱法检测
2.3.1 叶片中的色素组成
高效液相色谱对鸡爪槭各时期叶片花青苷提取液检测结果显示,520 nm下检测到在保留时间18.56 min处有吸收峰出现,对照标准品,鉴定为矢车菊半乳糖苷,同时还检测到微弱的矢车菊素、矮牵牛素、槲皮素的吸收峰(表2)。对比紫外及薄层层析结果,可以确定矢车菊素半乳糖苷是鸡爪槭叶片中的主要花色苷。
鸡爪槭各时期叶片花青素萃取液检测结果显示,在520 nm下,矢车菊素半乳糖苷的信号强度减弱,而矢车菊素的信号强度增强,原因是矢车菊素衍生糖苷只含有矢车菊素半乳糖苷一种,矢车菊素半乳糖苷水解为矢车菊素而质量分数下降,表现为信号强度下降。
鸡爪槭各时期叶片花青苷提取液在280 nm下的检测结果显示,检测到的吸收峰与表1中编号4到13的这10种标准品出峰时间一致,结合薄层和紫外检测结果,可以判断出以下单体酚的存在(表2)。
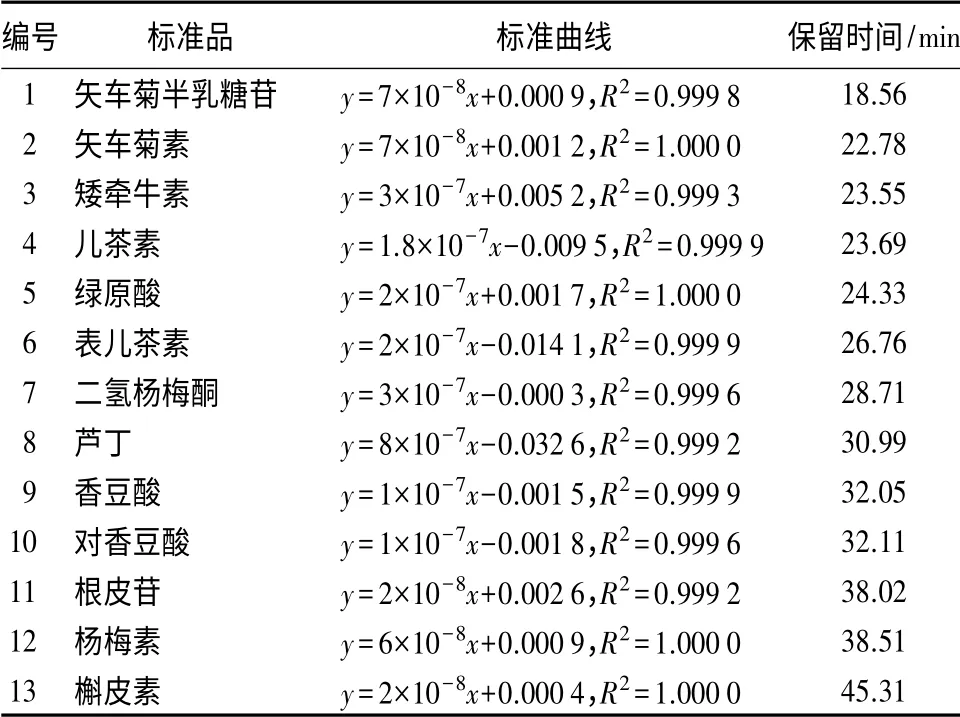
表2 标准品保留时间及标准曲线
2.3.2 叶片中的色素变化
鸡爪槭叶片各变色时期单体酚质量分数计算结果如表3,将13种单体酚质量分数与叶片发育时期做显著性分析,可知矢车菊素、矢车菊素半乳糖苷、绿原酸、对香豆酸、杨梅素与叶片发育时期有显著相关性,其余单体酚则是有极显著相关性。矢车菊素半乳糖苷质量分数的变化趋势为从芽叶期到绿叶期,矢车菊素半乳糖苷的质量分数快速降低,从3 509.51 mg·kg-1降低到46.88 mg·kg-1;从绿叶期开始,质量分数大幅升高,直到红叶期质量分数达到最大值3 541.11 mg·kg-1。矢车菊素质量分数的变化趋势与矢车菊素半乳糖苷一致;同属花青素的矮牵牛素,质量分数在整个叶片发育时期变化幅度不大;其他检测到的单体酚中,儿茶素的质量分数从芽叶期到展叶期增加,展叶期到大绿期降低,随后增加,红叶期质量分数最高;绿原酸质量分数从芽叶期到展叶期增加,展叶期到初叶期降低,初叶期到小绿期增加,小绿期到绿叶期降低,绿叶期到红叶期大幅增加,红叶期质量分数最高;表儿茶素、香豆酸和杨梅素的质量分数都在展叶期增加到了最大值,随后质量分数降低,从绿叶期到红叶期质量分数又有所增加;二氢杨梅酮的质量分数呈现先降低后增加如此往复的变化趋势,红叶期质量分数最高;芦丁质量分数从芽叶期到小绿期增加,小绿期到绿叶期降低,到了红叶期再增加到最高;对香豆酸的质量分数从芽叶期到展叶期增加,展叶期到大绿期降低,大绿期到绿叶期增加,绿叶期到红叶期降低;根皮苷的质量分数,从芽叶期到展叶期增加,从展叶期到大绿期降低,大绿期到红叶期增加;槲皮素的质量分数从芽叶期到展叶期降低,从展叶期到初叶期增加,初叶期到绿叶期降低,绿叶期到红叶期增加,红叶期质量分数最高。
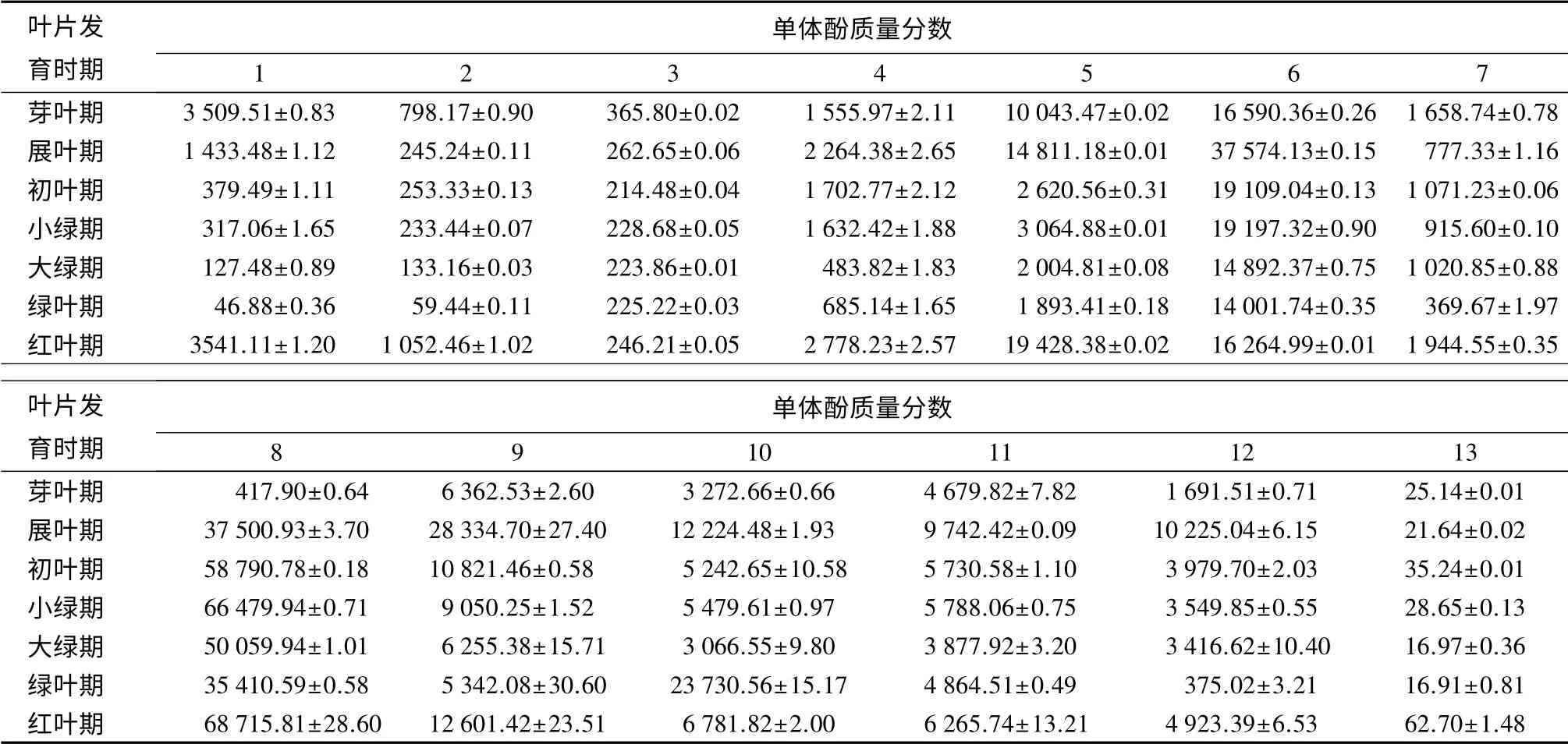
表3 不同叶片发育时期单体酚质量分数的变化 mg·kg-1
总花青苷质量分数和叶绿素质量分数的比值变化趋势,从芽叶期到绿叶期,比值依次为1.89、0.77、0.31、0.28、0.15和0.13,可以看出比值下降,且仅在芽叶期这个比值大于1;绿叶期到红叶期,二者比值骤然上升到3.32,且达到了最大值。
2.4 pH值测定
pH值检测结果表明,鸡爪槭叶片发育的各个时期细胞液的pH值分别为5.30、5.40、5.20、5.20、5.50、5.40和5.40,当pH值为5.20~5.50时,pH值与各时期叶绿素和总花青苷质量分数的相关系数分别为0.34和0.04,且相关性不显著。
3 结论与讨论
高效液相色谱检测结果显示,可以导致鸡爪槭叶片呈现红色的花青素/苷有矢车菊素、矢车菊素半乳糖苷及矮牵牛素,但是在薄层层析检测中,花青素萃取液中没有观测到矮牵牛素和矢车菊素半乳糖苷的斑点,高效液相色谱分析,矮牵牛素在各变色时期中最高质量分数仅为365.80 mg·kg-1,而矢车菊素半乳糖苷的最高质量分数是矮牵牛素最高质量分数的9.68倍,据此推断矮牵牛素未观察到斑点的原因可能是质量分数过低,也可能是显色情况肉眼无法观测[14]。在花青素萃取液中,观察到矢车菊素却没有观察到矢车菊素半乳糖苷的显色斑点,原因很可能是大量矢车菊素半乳糖苷水解为矢车菊素,使得矢车菊素质量分数明显增加而显示斑点;花青苷提取液中观察到了矢车菊素和矢车菊素半乳糖苷的两个斑点,这可能是因为矢车菊素半乳糖苷的不完全水解,增加了矢车菊素的质量分数,使得两者同时存在。
紫外分光光度计光度检测和高效液相色谱单体酚质量分数计算结果显示,单体酚质量分数和鸡爪槭叶片发育时期显著相关,从芽叶期到初叶期叶绿素质量分数变化幅度极小,几乎呈水平趋势,而矢车菊素半乳糖苷质量分数急剧下降,从3 509.51 mg·kg-1降到379.49 mg·kg-1,此时,鸡爪槭叶色从鲜红色转变成浅红色,红色逐渐变浅,矢车菊素半乳糖苷质量分数急剧下降是叶色变化的主要原因;初叶期到绿叶期,叶绿素的质量分数从1 283.56 mg·kg-1逐步增加,在绿叶期达到最高值3 215.91 mg·kg-1,而矢车菊素半乳糖苷质量分数从379.49 mg·kg-1下降到最低值46.88 mg·kg-1,鸡爪槭叶片从浅红色转变为深绿色,此段时间叶色转变是叶绿素大量积累和花青苷质量分数降低共同作用的结果;绿叶期是鸡爪槭变色期中持续时间最长的时间段,从6月下旬到9月下旬,大约3个月,绿叶期到红叶期,叶绿素质量分数由最高值3 215.91 mg·kg-1下跌到最低值1 257.39 mg·kg-1,矢车菊素半乳糖苷的质量分数则是从最低值46.88 mg·kg-1上升到最高值3 541.11 mg·kg-1,叶色由深绿转变为紫红,这个时期叶色急剧变化是叶绿素和矢车菊素半乳糖苷相互作用的结果。从总花青苷和叶绿素的质量分数比变化趋势看,在两者比值大于1的芽叶期和红叶期,绿色互补效应弱,叶片呈现红色;而在其他时期,比值都小于1,绿色互补效应强,叶片呈现出不同程度的绿色,从展叶期到绿叶期比值越来越小,鸡爪槭叶片的颜色越来越绿,由此可见,二者的比值是决定叶色的关键因素。
植物叶片的颜色是自身的遗传因子和外界环境共同作用的结果,叶色表达不仅与色素的种类、质量分数和分布有关,叶片内部的pH值同是影响叶色的重要因素之一。花色苷的稳定性受到pH值很大影响,随着pH值的升高,稳定性降低[17]。而本试验中,鸡爪槭不同叶片发育时期pH值基本稳定,与总花青苷质量分数间相关性弱,说明其叶色变化与pH值无关,是色素分配的结果。在酸性pH值下,矢车菊素半乳糖苷的颜色应为亮红色[18],而叶片颜色在其质量分数最高的红叶期呈紫红色,导致这种现象的原因可能是大量叶绿素的存在,矢车菊素半乳糖苷的亮红色与叶绿素的绿色为互补色,二者质量分数相互作用,且矢车菊素及其衍生糖苷占主导地位,导致鸡爪槭叶片呈现紫红色。
除了叶绿素、矢车菊素、矢车菊素半乳糖苷和矮牵牛素以外,叶色呈现红色,其他色素起到了辅助作用,包括类胡萝卜素类、黄酮醇类(芦丁、杨梅素、槲皮素)、黄烷酮类(儿茶素、表儿茶素)、酚酸类(绿原酸、香豆酸、对香豆酸)、二氢黄酮醇类(二氢杨梅素)、根皮苷[19-20]。
[1]王慧娟,赵秀山,孟月娥,等.彩叶植物及其在园林中的应用[J].河南农业科学,2004(11):70-72.
[2]杨兵强.彩色叶树种在园林景观设计中的应用研究[D].杨凌:西北农林科技大学,2013.
[3]荣立苹,李倩中,李淑顺,等.鸡爪槭黄色品种叶片转色期生理变化[J].西北农业学报,2012,21(1):187-191.
[4]黄可,王小德,柳翼飞,等.红枫春季叶色变化与色素含量的相关性[J].浙江农林大学学报,2012,29(5):734-738.
[5]楚爱香,张要战,王萌萌.四种槭树属(Acer)植物秋色叶变化与色素含量和可溶性糖的关系[J].江西农业大学学报,2013,35(1):108-111.
[6]高东菊,张凤娥,仲肇森,等.血红鸡爪槭红色素提取及稳定性[J].东北林业大学学报,2013,41(5):105-108.
[7]Li Houhua,Flachowsky H,Fischer T C,et al.Maize Lc transcription factor enhances biosynthesis of anthocyanins,distinct proanthocyanidins and phenylpropanoids in apple(Malus domestica Borkh.)[J].Planta,2007,226(5):1243-1254.
[8]高俊凤.植物生理学实验技术[M].西安:世界图书出版公司,2000.
[9]Fuleki T,Franeis F J.Quantitative methods for anthocyanins.2.Detemrination of total anthocyanins and degradation index for cranberry juice[J].Food Sci,1968,33:78-82.
[10]Harborne J B.Classes and functions of secondary products from plants[M].London:Imperial College Press,1999:1-25.
[11]Harborne J B,Williams C A.Advances in flavonoid research since 1992[J].Phytochemistry,2000,55(6):481-504.
[12]周文彬,邱保胜.植物细胞内pH值的测定[J].植物生理学通讯,2004,40(6):724-728.
[13]Harborne J B.Spectral methods of characterizing anthocyanins[J].Biochemical,1958,70(1):22-28.
[14]李玲.五种红色叶植物叶片色素分析[D].杨凌:西北农林科技大学,2013.
[15]徐渊金,杜琪珍.花色苷分离鉴定方法及其生物活性[J].食品与发酵工业,2006,32(3):67-72.
[16]李玲,李厚华,王亚杰,等.紫叶小檗叶片色素成分分析[J].东北林业大学学报,2013,41(7):58-62.
[17]Harborne J B.The flavonoids:Advances in research since 1986[M].New York:Chapman&Hall,1994.
[18]Chalker Scott L.Environment significance of anthocyanin in plant stress response[J].Photochem Photobiol,1999,70(1):1-9.
[19]安田·齐.花色之谜[M].张承志,佟丽,译,北京:中国林业出版社,1989.
[20]Manetas Y.Why some leaves are anthocyanic and why some anthocyanic leaves are red[J].Flora,2006,201(3):163-177.
