我院抗肿瘤药致不良反应报告分析
2015-03-06杨国韬
杨国韬
恶性肿瘤已成为我国城乡居民发病和死亡的主要病因,且呈持续增长趋势。2010年全国癌症新发病例约为309.30万例,发病率为235.23/10万;死亡病例约为195.66万例,病死率为148.81/10万[1]。我院作为湖北省特色肿瘤专科医院,抗肿瘤药物应用广泛,其引起的药品不良反应(ADR)近年来均占总报告数首位。本文对我院2010至2013年报告的113例抗肿瘤药致 ADR病例进行回顾性分析,总结抗肿瘤药致ADR发生的特点及规律,为改进我院抗肿瘤药物监测工作及临床合理使用提供参考和依据。
1 资料与方法
1.1 一般资料 收集本院2010至2013年填写的113例抗肿瘤药致ADR报告。
1.2 方法 整理资料后将患者年龄、性别、原患疾病与过敏史、联合用药及给药途径、涉及药品种类、累及器官或系统及临床表现、关联性评价及转归等信息录入Excel软件进行统计与分析。
2 结果
2.1 ADR患者一般情况 113例抗肿瘤药致ADR报告中,男31例(27.43%),女82例(72.57%);年龄36~71岁,平均年龄55岁。原患疾病中乳腺癌45例,肺癌18例,宫颈卵巢癌16例,直肠结肠癌9例,鼻咽癌7例,胃癌6例,淋巴瘤5例,食管癌3例,胰腺癌、扁桃体癌各2例。既往有药物过敏史者11例(9.73%),无过敏史者73例(64.60%),过敏史不详者29例(25.67%)。见表1。
2.2 联合用药及给药途径 113例ADR报告中单独用药103例(91.15%),联合用药10例(8.85%),包括多西紫杉醇联合顺铂4例,多西紫杉醇联合吡柔比星2例,多西紫杉醇联合奥沙利铂、氟尿嘧啶联合亚叶酸钙、伊立替康联合奈达铂、长春新碱联合顺铂各1例。给药途径中静脉给药98例(86.73%),口服给药9例(7.96%),其他给药途径(胸腔腹腔给药、皮下注射、肌内注射)6例(5.31%)。
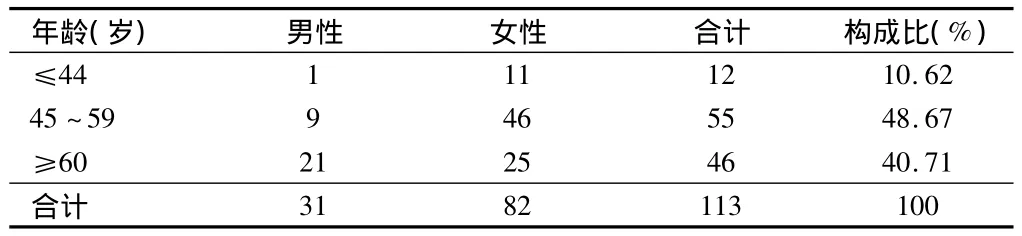
表1 ADR患者年龄与性别分布 例
2.3 ADR涉及药品种类分布 113例ADR报告共涉及抗肿瘤药6类19个品种,其中植物来源的抗肿瘤药及其衍生物引发的ADR位居首位。见表2。
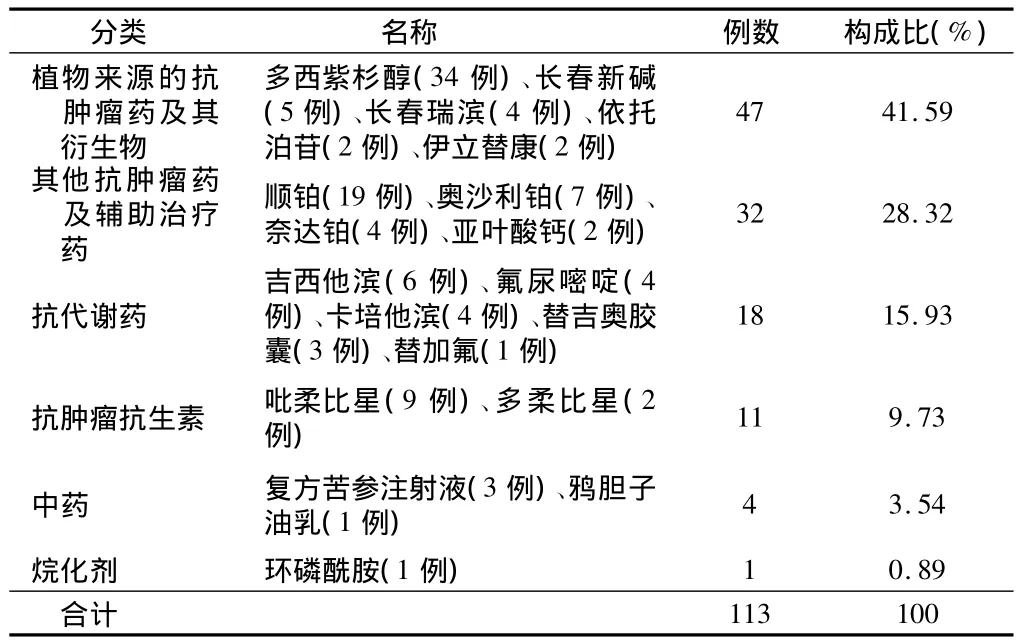
表2 引发ADR的抗肿瘤药物分布
2.4 ADR累及器官或系统分布及主要临床表现 根据国家药品不良反应监测中心编写的《WHO药品不良反应术语集》进行分类统计,抗肿瘤药致ADR累及的系统或器官及主要临床表现(因部分ADR患者同时累及多个器官或系统,故实际发生例次>113例)。见表3。
2.5 ADR关联性评价及转归 根据国家药品不良反应监测中心发布的ADR关联性评价标准,113例ADR报告中评价为“肯定”27例(23.89%),“很可能”73例(64.60%),“可能”10例(8.85%),“待评价”3例(2.66%)。经过停药或对症治疗等处理后,68例ADR患者痊愈(60.18%),43例好转(38.05%),未好转2例(1.77%),无后遗症及死亡病例。
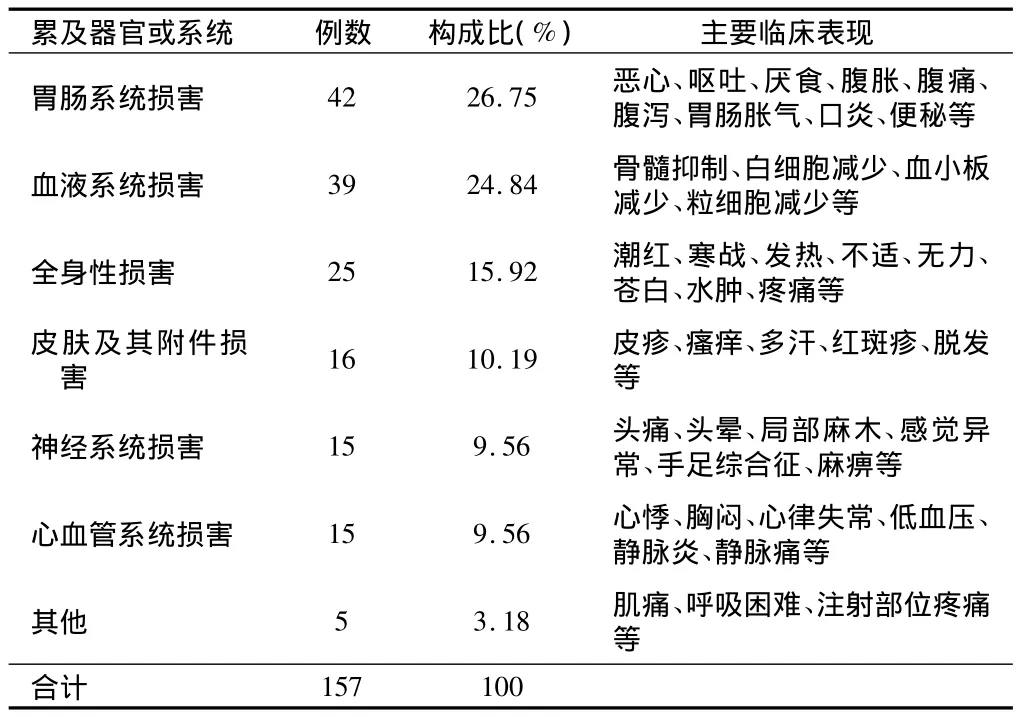
表3 ADR累及器官或系统及主要临床表现
3 讨论
本院2010至2013年填写的113例ADR报告中,男女比例为1∶2.65,女性明显高于男性,可能与我院就诊人群特点及妇科恶性肿瘤比例较高有关。由表1可知,ADR患者人群中45~59岁的中年患者所占比例最大,达到48.67%;其次为60岁以上的老年患者,占40.71%。中老年人群是恶性肿瘤的高发人群,也是我院发生ADR的高风险人群,由于许多器官的储备功能明显下降,对处置药物的能力和对药物反应上与青年人有明显差异,加之合并用药种类增多以及对医生处方的依从性差,因而ADR的发生率高[2]。
引发 ADR的给药途径主要为静脉给药(86.73%),抗肿瘤药由于其生物利用度等原因,注射剂型的品种多于口服剂型,因而临床上肿瘤化疗较多采取静脉给药方式;注射剂的pH值、微粒、内毒素、赋形剂以及药物的配制、输注过程等也较其他给药途径更易引起ADR[3]。建议临床医师和临床药师应详细掌握药物的理化性质及药动学特点,考虑药物禁忌证及相互作用,根据病情采用适当的药物剂型和给药途径,安全、合理的使用抗肿瘤药。
从涉及药品分布看,我院引发ADR的药品种类主要为植物来源的抗肿瘤药及其衍生物和铂类药物,与其他文献报道[4]一致。临床表现主要为胃肠系统损害(26.75%)及血液系统损害(24.84%),这主要是胃肠黏膜,骨髓等增殖活跃细胞对抗肿瘤药物的作用,尤其是细胞毒药物较为敏感的缘故[5],同时也与上述两类药物的大量使用有关。特别是植物来源的抗肿瘤药及其衍生物近年来发展迅速,用药份额一直位于各类抗肿瘤药之首。这类药物主要作用于有丝分裂M期,干扰肿瘤细胞微蛋白合成,在抗肿瘤药物中有不可替代的地位,但其所含有效成分复杂、质量标准低、可控性差,不溶性微粒易导致静脉炎及过敏反应[4]。
目前我院用量较大的植物来源抗肿瘤药主要为多西紫杉醇,113例ADR报告中多西紫杉醇占34例(包括骨髓抑制18例,胃肠系统损害8例,过敏样反应3例,发热2例,静脉炎1例,脱发1例,低血压1例),其所致的骨髓抑制为剂量限制性毒性,随着剂量和疗程的增加,其血液学毒性加重,但可逆转不蓄积[6],主要表现为中性粒细胞减少,最快发生在用药1 d后,最迟发现于第88天,多数患者发生时间集中在用药后3~8 d,中位数为6 d。由于紫杉烷类药物在水中的溶解性能极差,注射剂中助溶剂含有聚氧乙烯蓖麻油(Cremophor EL)、聚山梨醇酯80(吐温-80,Tween-80)和无水乙醇混合液可引起多种毒性反应[7],因此目前国内外临床制剂研究的热点是致力于开发多西紫杉醇的新剂型,避免使用聚山梨酯80,增加药物溶解度,降低毒副作用。现已报道的新剂型包括脂质体、白蛋白纳米粒、微乳和乳剂、聚合胶束、环糊精包合物等,但想实现大规模临床应用还有待进一步深入研究。
根据我院就诊患者的人群及用药特点,应针对抗肿瘤药物完善监测管理制度,临床医药人员要高度重视抗肿瘤药的潜在危险,充分了解可能出现的不良反应,根据患者年龄、病情、过敏史、药物特性及配伍禁忌等因素制定个性化给药方案,对紫杉烷类药物用药前必须实施常规预处理,给药初期应控制滴注速度,严密监测可能发生的过敏反应,化疗结束后应随时关注患者血液学指标及肝肾功能变化,同时做好针对性的防治措施,一旦发现异常情况要及时处理,最大程度规避和降低不良反应造成的损害。
1 陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡.中国肿瘤,2014,23:1.
2 安泽余,殷玉会,顾吉顺.我院290例药品不良反应报告分析.河北医药,2012,34:1252-1253.
3 钱锦,张树,吴俊华,等.422例抗肿瘤药物不良反应分析.南京医科大学学报,2013,33:915.
4 李蓉,董志,路晓钦,等.重庆市818例抗肿瘤药不良反应报告分析.中国药房,2013,24:3225.
5 刘加涛,金亮,汪燕燕,等.我院抗肿瘤及辅助治疗药物不良反应164例分析.中国药物警戒,2012,9:184.
6 朱婉贞.53例多西紫杉醇注射液不良反应报道文献分析.中国临床药学杂志,2010,19:381.
7 刘韬,林子超,潘莹,等.31例紫杉烷类注射剂过敏反应临床观察.中国医院用药评价与分析,2009,9:777.
