脾切断流术对老年肝硬化门静脉高压症患者血清HGF、TGF-β1和肝功能的影响
2015-03-05许日昊吉林大学第二医院吉林长春130041
许日昊 (吉林大学第二医院,吉林 长春 130041)
脾切断流术对老年肝硬化门静脉高压症患者血清HGF、TGF-β1和肝功能的影响
许日昊(吉林大学第二医院,吉林长春130041)
〔摘要〕目的检测老年肝硬化门静脉高压症患者行脾切断流术后血清干细胞生长因子(HGF)、转化生长因子(TGF) -β1和肝功能指标的水平。方法采用酶联免疫分析方法测定86例老年肝硬化门静脉高压症患者血清HGF和TGF-β1水平,同期的30例健康体检者作为对照组。采用全自动生化分析仪测定肝功能生化指标,包括总胆红素(TBIL)、转氨酶(AST、ALT)、胆碱酯酶(CHE)、前白蛋白(PA)。对比患者术前及术后血清因子水平和肝功能生化指标的变化。结果与正常对照组相比,血清指标HGF和TGF-β1在门静脉高压症患者中的表达显著增高(P<0.05)。手术治疗组患者和保守治疗组患者的血清HGF含量在术后显著升高,TGF-β1水平含量在术后显著降低,与术前相比差异显著(P<0.05)。术后1~12 w手术治疗组和保守治疗组患者血清HGF水平逐渐升高,TGF-β1水平逐渐降低,且手术治疗组血清水平与保守治疗组差异显著(P<0.05)。结论脾切断流术可以提升老年肝硬化门静脉高压症患者血清HGF水平,降低TGF-β1水平,改善患者肝功能。
〔关键词〕肝硬化;门静脉高压;脾切断流术;肝功能;肝细胞生长因子;转化生长因子
第一作者:许日昊(1973-),男,博士,主要从事主动脉夹层治疗与发病机制治疗。
老年肝硬化门静脉高压症临床主要表现脾大、脾功能亢进、腹水等。目前常采用脾切断流手术治疗,以降低门静脉压力和消除脾功能亢进等症状〔1〕。肝脏纤维化及肝组织的再生能力,有大量的细胞因子参与调控。其中,肝细胞生长因子(HGF)在组织形成、肿瘤转移及损伤修复中起着重要作用〔2〕。研究证实HGF通过抑制细胞外基质合成,加速细胞外基质的降解,是重要的抗纤维化因子〔3〕。转化生长因子(TGF) -β1的表达水平也与肝纤维化损伤程度密切相关〔4〕。本研究旨在探讨脾切断流术对老年肝硬化门静脉高压症患者肝功能的治疗价值。
1 资料与方法
1.1一般资料选择本院2013年1月至2014年6月收治的老年肝硬化门静脉高压症患者86例。分为行脾切断流手术组和行内科保守治疗组。行脾切断流手术组52例男33例,女19例,年龄58~82〔平均(63.3±6.8)〕岁,肝硬化类型:乙型肝炎性21例,酒精性8例,代谢性5例,胆汁淤积性2例,其他2例。肝功能分级A级29例,B级23例。行内科保守治疗组34例,男22例,女12例,年龄61~81〔平均(65.6±5.4)〕岁,肝硬化类型:酒精性6例,代谢性3例,其他1例。肝功能分级A级20例,B级14例。选择同时期经体检确定的无其他急慢性疾病的健康者30例作为对照组,其中男性19例、女性11例,年龄56~79〔平均(66.1±7.3)〕岁,乙型肝炎性34例,胆汁淤积性3例。全部患者均经血常规、凝血常规、肝功能、影像学及临床诊断确诊为老年肝硬化门静脉高压症。采用肝功能Child-Pugh分级评分法对全部患者肝功能评估分为A级和B级。各组性别、年龄、肝硬化类型、肝功能分级、基础用药等一般资料的差异均无统计学意义(P>0.05)。
1.2处理方法三组患者于术前5 d清晨采集静脉血4 ml,分离血清,-20℃保存待测。采用酶联免疫分析方法检测患者行脾切断流手术前1 d及手术后1、2、4、8、12 w的血清HGF和TGF-β1水平。采用全自动生化分析仪测定肝功能生化指标,包括总胆红素(TBIL)、转氨酶(AST、ALT)、胆碱酯酶(CHE)、前白蛋白(PA)。
1.3评价标准对比血清HGF和TGF-β1水平在正常组和门静脉高压症患者中的差别,对比行脾切断流术前和术后治疗组患者血清因子HGF和TGF-β1水平和肝功能生化指标差异。分析术后1、2、4、8、12 w的手术治疗组和同期保守治疗组的血清因子HGF和TGF-β1水平变化趋势。
1.4统计学方法应用SPSS17.0软件进行t检验。
2 结果
2.1对照组和门静脉高压症患者血清因子水平比较血清指标HGF和TGF-β1在门静脉高压症患者中高度表达〔(5.29± 1.91)μg/L,(106.23±11.59)μg/L〕,对照组显著低于门静脉高压症患者〔(2.86±0.11)μg/L,(46.53±8.25)μg/L〕(P<0.05)。
2.2术前与术后各血清指标水平比较术前手术治疗组和保守治疗组血清HGF和TGF-β1水平均显著高于对照组(P<0.05)。手术治疗组患者和保守治疗组患者的血清HGF含量在术后显著升高,TGF-β1水平含量在术后显著降低(P<0.05)。术后,手术治疗组的血清HGF水平显著高于同期保守治疗组,血清TGF-β1水平显著低于保守治疗组(P<0.05)。见表1。
2.3手术治疗组和保守治疗组术后血清HGF和TGF-β1水平变化曲线术后1~12 w的过程中,手术治疗组和保守治疗组患者血清HGF水平逐渐升高,且手术治疗组血清HGF水平高于保守治疗组(P<0.05)。两组患者血清TGF-β1水平逐渐降低,且手术治疗组低于保守治疗组(P<0.05)。见图1。
2.4肝功能各指标变化情况手术治疗组患者行脾切断流术后,TBIL、AST、ALT水平均较手术前显著降低,且与同期保守治疗组相比也显著降低(P<0.05)。与手术前相比,手术治疗组的CHE和PA指标在手术后显著升高,且高于同期保守治疗组(P<0.05)。见表2。
表1 各组患者术前和术后血清HGF和TGF-β1水平比较(±s,μg/L)

表1 各组患者术前和术后血清HGF和TGF-β1水平比较(±s,μg/L)
与对照组比较: 1) P<0.05;与术前比较: 2) P<0.05;与保守治疗组比较: 3) P<0.05
组别 n HGF手术前 手术后TGF-β1手术前 手术后对照组 30 2.86±0.11 2.97±0.26 46.53±8.25 47.69±7.61手术治疗组 52 5.43±2.011)9.62±2.181) 2) 3)105.62±12.371)79.82±11.751) 2) 3)保守治疗组 34 5.18±1.921) 7.55±1.861) 2) 109.17±13.241) 92.28±12.631) 2)
2.5术前和术后肝功能分级手术治疗组行脾切断流术后肝功能A级的患者增长为38例,B级仅有14例,即有9例肝功能由B级转为A级,转化率为39.1%。而同期保守治疗组有3例肝功能由B级转为A级,转化率为21.4%。
表2 两组患者肝功能各指标手术前后的变化(±s)
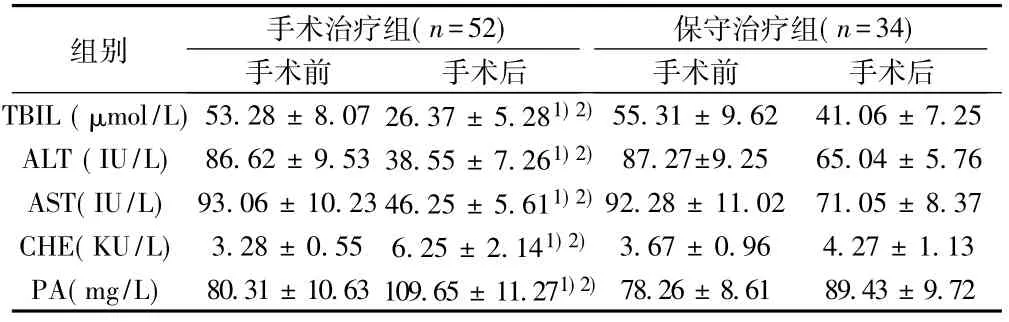
表2 两组患者肝功能各指标手术前后的变化(±s)
与手术前比较: 1) P<0.05;与同期保守治疗组比较: 2) P<0.05
组别 手术治疗组(n=52)手术前 手术后保守治疗组(n=34)手术前 手术后TBIL (μmol/L) 53.28±8.07 26.37±5.281) 2)55.31±9.62 41.06±7.25 ALT (IU/L) 86.62±9.53 38.55±7.261) 2)87.27±9.25 65.04±5.76 AST(IU/L) 93.06±10.23 46.25±5.611) 2)92.28±11.02 71.05±8.37 CHE(KU/L) 3.28±0.55 6.25±2.141) 2)3.67±0.96 4.27±1.13 PA(mg/L) 80.31±10.63 109.65±11.271) 2)78.26±8.61 89.43±9.72

图1 手术治疗组和保守治疗组术后血清HGF水平变化曲线
3 讨论
老年肝硬化门静脉高压症以门静脉系统血流动力学异常和压力持久增高为主要症状,门静脉高压症发生的原因在于老年肝硬化患者肝功能受损,肝组织再生结节和纤维组织压迫破坏了肝脏的血管结构,使门静脉血流受阻,压力随之升高。其次,肝脏对血管活性物质如胰高血糖素和一氧化氮等的清除能力下降,使内脏血管扩张,心输出量增加。出现门静脉高压症时,门静脉血主要经侧支分流,而肝脏血流量的主要来源是门静脉供血,因此导致入肝的血流量减少。临床常采用外科手术以降低门静脉压力,保证肝脏足够的血液供应。门静脉的主要分支是脾静脉和肠系膜静脉〔5〕,行脾切断流术后,切断了经脾静脉回流的血液,门静脉血流量明显减少,可以有效缓解门静脉高压状态〔6〕。
HGF参与肝脏再生信息调控通路,主要作用于肝细胞增殖阶段,有抗纤维化及促进细胞增殖的作用〔7〕。在老年肝硬化门静脉高压症患者中,血清HGF水平反映了肝组织受损和修复的能力与过程。本研究术后血清HGF水平的增高显示,行脾切断流术后,肝脏再生能力增强,以修复受损肝组织减缓肝脏纤维化进程。
TGF-β1是肝纤维化病变发展过程中重要的细胞因子〔8〕,在肝纤维化过程中,TGF-β1明显升高,与肝硬化病理进展程度密切相关〔9〕。本研究显示血清TGF-β1水平在肝脏纤维病变中具有重要作用,能够反映门静脉高压症患者肝纤维化程度及肝功能水平。血清TGF-β1水平下降机制推测为脾切断流手术后切断了经脾来源的TGF-β1释放,同时肝组织内间质细胞活化增殖受到抑制,减轻了肝纤维化程度〔10〕。
老年肝硬化门静脉高压症行脾切断流术后,常伴有上消化道出血,肝损伤甚至肝功能衰竭等并发症,肝功能衰竭是影响术后患者生存率的主要原因〔11〕。因此术后准确评估肝脏相关功能,对于预防肝衰竭及其他并发症,提高患者预后质量具有重要意义。
4 参考文献
1 Walusimbi MS,Dominguez KM,Sands JM,et al.Circulating cellular and humoral elements of immune function following splenic arterial embolisation or splenectomy in trauma patients〔J〕.Injury,2012; 43(2) : 180-3.
2 Tomita N,Morishita R,Taniyama Y,et al.Angiogenic property of hepatocyte growth factor is dependent on upregulatlon of essential transcription factor for angiogenesis,ets-1〔J〕.Circulation,2003; 107(10) : 1411-7.
3 Liu Y,Rajur K,Tolbert E,et al.Endogenous hepatocyte growth factor ameliorates chronic renal injury by activating matrix degradation pathways 〔J〕.Kidney Int,2000; 58(5) : 2028-43.
4 Williams E,Iredale J.Hepatic regeneration and TGFβ: growing to a prosperous perfection〔J〕.Gut,2000; 46(5) : 593-4.
5刘建华,张学义,孙辉,等.门奇断流术中门静脉血流动力学研究〔J〕.中华普通外科杂志,1997; 12(6) : 350-2.
6杨一林,段云友,迪丽,等.超声检测脾脏白发性血液分流对肝硬化患者:静脉血流动力学的影响〔J〕.中国医学影像技术,2010; 26 (1) : 96-8.
7谢倩,魏文芸,刘红春,等.血清肝细胞生长因子在慢性肝病中的意义〔J〕.中华消化杂志,2003; 23(6) : 348-51.
8 Friedman SL.Molecular regulation of hepatic fibrosis,an intergrated cellular response to tissue injury〔J〕.J Biol Chem,2003; 275: 2247-50.
9李兵顺,阎文昭,刘金星,等.肝组织与血清转化生长因子β1表达水平与病毒性肝炎患者肝纤维化的关系〔J〕.中华肝脏病杂志,2004; 12(5) : 271-3.
10 Philips N,Keller T,Gonzalez S.TGF-beta like regulation of matrix metallo-proteinases by anti-transforming growth factor beta,and anti-transforming growth factor beta 1 antibodies in dermal fibroblasts: implications for wound healing〔J〕.Wound Repair Regen,2004; 12(1) : 53-9.
11 Stockmann M,Lock JF,Malinowski M,et al.How to define initial poor graft function after liver transplantation? A new functional definition by the LiMAx test〔J〕.Transpl Int,2010; 23(10) : 1023-32.
〔2015-02-11修回〕
(编辑袁左鸣/滕欣航)
〔中图分类号〕R657.3+1
〔文献标识码〕A
〔文章编号〕1005-9202(2015) 16-4618-02;
doi:10.3969/j.issn.1005-9202.2015.16.093
