蛛网膜下腔出血后小鼠早期脑损伤海马区神经细胞凋亡
2015-03-05赵彦芬河南省中医院麻醉科河南郑州450002
赵 峰 赵彦芬 毛 轲(河南省中医院麻醉科,河南 郑州 450002)
蛛网膜下腔出血后小鼠早期脑损伤海马区神经细胞凋亡
赵峰赵彦芬毛轲
(河南省中医院麻醉科,河南郑州450002)
〔摘要〕目的探讨蛛网膜下腔出血(SAH)后小鼠早期脑损伤海马区神经细胞凋亡的变化。方法90只小鼠随机分为正常组12只、SAH 组48只和假手术组30只; SAH组与假手术组再随机分为6、12、24、48 h和3、7 d 6个亚组。应用枕大池内的自体动脉血二次注入法构建起大鼠SAH模型,应用免疫组织化学法检测3组海马区神经元内的caspase-3及bcl-2的表达。结果SAH组凋亡分子caspase-3和抗凋亡分子bcl-2的mRNA都不同程度地升高,caspase-3随着时间的不断延长而随之增多,在24 h后这种增多更明显,48 h后达高峰,24 h至7 d各时间段和假手术组、正常组相比差异显著(P<0.05)。正常组与假手术组在海马区内的表达量各时间点差异不明显(P>0.05)。Bcl-2在SAH后12 h变化最明显,Bcl-2表达量各时间点与假手术组、正常组差异明显(P<0.05)。结论SAH后早期脑损伤海马区神经细胞凋亡,凋亡及抗凋亡途径均在下丘脑内起作用。
〔关键词〕脑损伤;凋亡;神经细胞
第一作者:赵峰(1970-),男,主治医师,主要从事临床麻醉研究。
蛛网膜下腔出血(SAH)占急性脑卒中的10%左右〔1〕。据世界卫生组织调查结果表明,我国SAH发病率约为2.0/10万人年,也有学者调查认为是每年(6~20) /10万人〔2〕。另外,患者由于脑实质内,脑室出血,硬膜外及硬膜下血管破裂,进而导致血液穿破脑组织流入蛛网膜下腔,而引发的临床综合征,称之为继发性SAH。SAH典型临床表现为突然发生的剧烈头痛、恶心、呕吐和脑膜刺激征,伴或不伴局灶体征。剧烈活动中或活动后出现爆裂性局限性或全头部剧痛,难以忍受,呈持续性或持续进行性加重,有时上颈段也可出现疼痛。其始发部位常与动脉瘤破裂部位有关。常见伴随症状有呕吐、短暂意识障碍、项背部疼痛、畏光等。本实验分析SAH小鼠海马组织caspase-3和Bcl-2水平和早期脑损伤关系。
1 材料与方法
1.1实验动物分组90只健康成年雄性小鼠,体质量25~30 g,均由郑州大学实验动物中心提供。随机分为SAH组48只,假手术组30只,正常组12只,其中SAH组和假手术组分为6、12、24、48 h、3、7 d,共6个亚组,SAH亚组各8只。而假手术组每亚组5只。
1.2仪器和试剂石蜡包埋机(BMJ-III,中国,常州) ; 301-268型转轮式组织切片机Leica公司,德国;奥林巴斯生物显微镜BHS型,日本; SP9001免疫组化试剂盒;多克隆抗体〔(北京中杉金桥生物技术有限公司(分装SantaCruz公司)〕;链霉菌抗生物素蛋白-过氧化物酶,免疫组织化学检测试剂盒及3-二氨基联苯胺显色试剂盒(由北京中杉金桥公司提供)。
1.3SAH模型制作采用10%水合氯醛(规格为300 mg/kg)经腹腔注射麻醉后取仰卧位,将其固定在立体定向仪上,剪开腹部皮肤,将带0.5 ml注射器的套管针插入左心室直达主动脉,抽取新鲜的动脉血,同时使用止血钳牢牢夹紧,给予结扎止血处理,完成后再进行逐层缝合;然后取俯卧位,将其牢牢固定在脑立体定位仪,沿着颈背部中线直至切开皮肤皮下,用无菌光滑钝头针头刺破颅骨后,将0.3 ml左右新鲜动脉血缓慢注入蛛网膜下腔,头置低位使血液扩散,10 min后拔除针头,封闭骨孔,缝合切口。假手术组除向枕大池内注射0.9%氯化钠注射液0.3 ml,其余处理与上述方法相同。
1.4海马组织的提取及固定麻醉消毒后,SAH后不同时间段取仰卧位固定后慢慢剪开腹部皮肤,提起剑突,同时沿着胸骨左侧方向剪开肋骨,暴露出心脏部位,用无菌生理盐水(37℃)、4%多聚甲醛进行心脏灌注,先快后慢,灌注总量为400 ml左右。小鼠断头后在显微镜下取出脑组织迅速取出,根据鼠脑定位,仔细分离出海马组织后,置于4%多聚甲醛中固定,4℃过夜。石蜡包埋,修块,切片。
1.5神经功能检测评分记录各SAH组24 h死亡率,存活小鼠在实验完成后24 h根据Bederson〔3〕标准的相关内容来实施神经行为功能缺损评分,具体的标准主要包括:提鼠尾距离地面33 cm(1尺)左右处,如果前肢对称伸向地面,可判定为0分;手术对侧肩内旋,同时前肢发生内收,1分;手术对侧肩内旋,同时可见前肢内收,推动双肩过程中手术对侧的抵抗力开始出现下降,2分;手术对侧肩发生内旋,同时前肢出现内收;在推动双肩的过程中发现手术对侧的抵抗力开始下降;在空旷的平面上,小鼠开始进行绕圈行走,3分;前肢发生内收;推动双肩过程中手术对侧的抵抗力开始发生下降;没有出现任何自主活动,4分。
1.6统计学方法应用SPSS20.0统计学软件进行t检验。
2 结果
2.1各SAH组24 h死亡率和神经行为功能缺损情况SAH组后24 h,有少数动物(神经功能缺损评分4分14只,3分和2分各12只,1分6只,0分4只)出现神经功能障碍,表现为运动减少、反应淡漠和拒绝进食(P<0.05)。对照组和假手术组无明显神经行为异常表现。
2.23组海马区caspase-3表达水平SAH组海马区内caspase-3随着时间的不断延长而增多,24 h后其表达量的增多明显,48 h后达高峰,24 h至7 d各时间段和假手术组、正常组差异显著(P<0.05)。正常组与假手术组海马区内的caspase-3各时间点差异不显著(P>0.05)。见表1。SAH组caspase-3阳性显示细胞呈棕黄色,见图1。
表1 各组caspase-3海马区不同时间段平均光密度(±s)
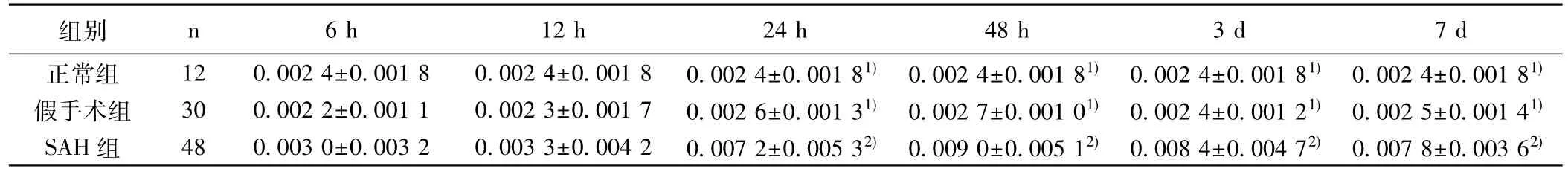
表1 各组caspase-3海马区不同时间段平均光密度(±s)
与SAH组比较: 1) P<0.05;与6、12 h比较: 2) P<005;下表同
组别 n 6 h 12 h 24 h 48 h 3 d 7 d正常组 12 0.002 4±0.001 8 0.002 4±0.001 8 0.002 4±0.001 81)0.002 4±0.001 81) 0.002 4±0.001 81)0.002 4±0.001 81)假手术组 30 0.002 2±0.001 1 0.002 3±0.001 7 0.002 6±0.001 31)0.002 7±0.001 01) 0.002 4±0.001 21)0.002 5±0.001 41)SAH组 48 0.003 0±0.003 2 0.003 3±0.004 2 0.007 2±0.005 32) 0.009 0±0.005 12) 0.008 4±0.004 72) 0.007 8±0.003 62)
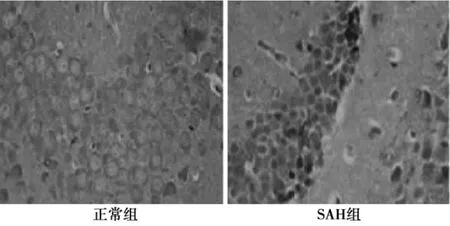
图1 正常组和SAH组海马区caspase-3阳性表达(×1 000)
2.33组Bcl-2蛋白表达SAH组12 h明显升高,第2天时达到最高峰,直到第7天一直处于高水平。24 h至7 d各时间段和假手术组及正常组差异显著(P<0.05)。正常组和假手术组海马区Bcl-2表达量各时间点差异不显著(P>0.05)。见表2。SAH组Bcl-2阳性染色位于细胞质内,胞质内出现棕黄色或棕褐色颗粒。见图2。
2.4SAH组2 d caspase-3及Bcl-2蛋白表达变化SAH组第2 天caspase-3及Bcl-2蛋白和假手术组比较,表现出了不同程度的升高现象。见图3。
表2 各组Bcl-2蛋白海马区表达(±s)
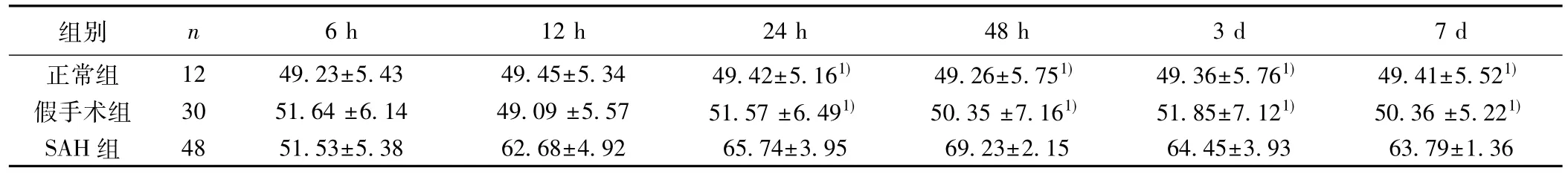
表2 各组Bcl-2蛋白海马区表达(±s)
组别 n 6 h 12 h 24 h 48 h 3 d 7 d正常组 12 49.23±5.43 49.45±5.34 49.42±5.161) 49.26±5.751) 49.36±5.761) 49.41±5.521)假手术组 30 51.64±6.14 49.09±5.57 51.57±6.491) 50.35±7.161) 51.85±7.121) 50.36±5.221)SAH组 48 51.53±5.38 62.68±4.92 65.74±3.95 69.23±2.15 64.45±3.93 63.79±1.36

图2 正常组和SAH组海马区Bcl-2蛋白表达(×1 000)
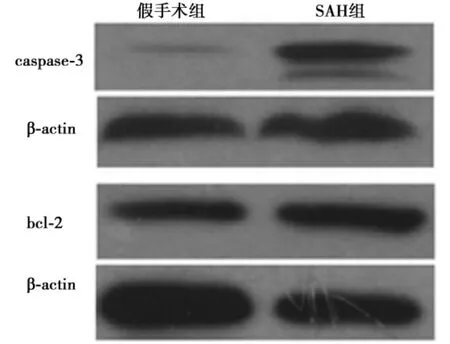
图3 SAH组48 h caspase-3和Bcl-2蛋白的变化
3 讨论
SAH最重要危险因素主要来自于导致颅内动脉瘤破裂的因素,包括高血压、吸烟、大量饮酒、既往有动脉瘤破裂病史、动脉瘤体积较大、多发性动脉瘤等〔4~6〕。与不吸烟者相比,吸烟者的动脉瘤体积更大,且更常出现多发性动脉瘤。任何年龄均可发病,青壮年更常见,动脉瘤破裂好发于30~60岁,女性多于男性,血管畸形多见于青少年〔7,8〕。SAH突然起病,数秒钟或数分钟发生头痛是最常见的起病方式。患者常能清楚地描述起病的时间和情景。发病前多有明显诱因,主要包括肢体剧烈运动或者情绪激动、用力较大等生理或者心理活动,其他还有咳嗽、饮酒等;部分情况下也可在安静情况下发病〔9~11〕。约1/3患者动脉瘤破裂前数日或数周有头痛、恶心、呕吐等症状〔12~14〕。确诊SAH之后,应尽早行脑血管造影或CT血管成像(CTA)检查,一旦证实为颅内动脉瘤破裂,尽快准备实施开颅夹闭手术或血管内介入栓塞治疗。SAH治疗目的主要是防治再出血、血管痉挛及脑积水等并发症,降低死亡率和致残率。
细胞凋亡具有复杂的分子调控机制,多种基因被证实在早期脑损伤和迟发性血管痉挛血管壁组织中参与凋亡的发生〔15,16〕,其中包括P53、Bcl-2及Caspases等。Bcl-2则被认为是抑制和促进细胞凋亡的最重要基因〔17~19〕,Bcl-2首次提出是在1984年,从滤泡性淋巴细胞瘤中分离得到的癌基因,研究显示〔20〕,Bcl-2基因对脑损伤后机体神经细胞的生存发挥积极作用,应用价值较高。caspase-3是现阶段学界一致认可的细胞凋亡过程中的关键酶,属于机体多种凋亡刺激信号传递的一个重要汇聚点,也是细胞凋亡时的一个必经之路,因而临床上普遍将其当作凋亡发生的一种标志酶〔21,22〕。
综上,SAH后存在着早期脑损伤问题,同时细胞凋亡也是导致早期脑损伤发生并进一步发展的关键因素之一,不排除与神经元凋亡有关,同时也可能存在其他细胞的凋亡。
4 参考文献
1 Qi JP,Wu AP,Wang DS,et al.Correlation between neuronal injury and Caspase-3 after focal ischemia in human hippocampus〔J〕.Chin Med J (Engl),2012; (10) : 1507-12.
2 Itoh T,Imano M,Nishida S,et al.Increased apoptotic neuronal cell death and cognitive impairment at early phase after traumatic brain injury in aged rats〔J〕.Brain Struct Function,2013; 218(1) : 209-20.
3 Mengozzi M,Cervellini I,Villa P,et al.Erythropoietin-induced changes in brain gene expression reveal induction of synaptic plasticity genes in experimental stroke〔J〕.Proceed Nat Acad Sci U S A,2012; 109(24) : 9617-22.
4 Marbacher S,Andereggen L,Neuschmelting V,et al.A new rabbit model for the study of early brain injury after subarachnoid hemorrhage〔J〕.J Neurosci Meth,2012; 208(2) : 138-45.
5 Jiang LG,Hu XY,Chen QH,et al.Neuronal apoptosis and interleukin 1-beta converting enzyme expression in the frontal cortex and hippocampus of mice with ischemia/reperfusion injury〔J〕.Neural Regener Res,2010; 5 (11) : 864-7.
6 Li Z,Cui G,Wang J,et al.Nemo-like kinase (NLK) involves in neuronal apoptosis after traumatic brain injury〔J〕.Cell Mol Neurobiol,2012; 32 (3) : 381-9.
7 Altay O,Hasegawa Y,Sherchan P,et al.Isoflurane delays the development of early brain injury after subarachnoid hemorrhage through sphingosine-related pathway activation in mice〔J〕.Crit Care Med,2012; 40(6) : 1908-13.
8 Su E,Bell MJ,Wisniewski SR,et al.α-Synuclein levels are elevated in cerebrospinal fluid following traumatic brain injury in infants and children: the effect of therapeutic hypothermia〔J〕.Dev Neurosci,2012; 23 (2) : 291-3.
9 Guo JR,Yue Y,Cui JJ,et al.Effects of propofol on amino acid neurotransmitter levels and neuronal apoptosis in the hippocampus in a rat model of ischemia/reperfusion injury〔J〕.Neural Regener Res,2011; 3(12) : 1338-41.
10 Atici A,Bozlu G,Turhan AH,et al.The role of trapidil on neuronal apoptosis in neonatal rat model of hypoxic ischemic brain injury〔J〕.Early Hum Develop,2012; 84(4) : 243-7.
11 Guo Z,Sun X,He Z,et al.Role of matrix metalloproteinase-9 in apoptosis of hippocampal neurons in rats during early brain injury after subarachnoid hemorrhage〔J〕.Neurol Sci,2010; 31(2) : 143-9.
12 Güresir E,Vasiliadis N,Dias S,et al.The effect of common carotid artery occlusion on delayed brain tissue damage in the rat double subarachnoid hemorrhage model〔J〕.Acta Neurochir (Wien),2012; 154(1) : 11-9.
13 Lee JY,Sagher O,Keep R,et al.Comparison of experimental rat models of early brain injury after subarachnoid hemorrhage〔J〕.Neurosurgery,2013; 65(2) : 331-43.
14 Prunell GF,Mathiesen T,Diemer NH,et al.Experimental subarachnoid hemorrhage: subarachnoid blood volume,mortality rate,neuronal death,cerebral blood flow and perfusion pressure in three different rat models 〔J〕.Neurosurgery,2013; 52(1) : 165-75.
15 Adamczak SE,de Rivero Vaccari JP,Dale G,et al.Pyroptotic neuronal cell death mediated by the AIM2 inflammasome〔J〕.J Cereb Blood Flow Metab,2014; 34(4) : 1038-40.
16 Sagulenko V,Thygesen SJ,Sester DP,et al.AIM2 and NLRP3 inflammasomes activate both apoptotic and pyroptotic death pathways via ASC 〔J〕.Cell Death Differ,2013; 20(9) : 1149-60.
17 Hanamsagar R,Aldrich A,Kielian T.Critical role for the AIM2 inflammasome during acute CNS bacterial infection〔J〕.J Neurochem,2014; 31 (2) : 11-2.
18 Hanamsagar R,Torres V,Kielian T.Inflammasome activation and IL-1β/ IL-18 processing are influenced by distinct pathways in microglia〔J〕.J Neurochem,2011; 119(4) : 736-48.
19 Budai MM,Varga A,Milesz S,et al.Aloe vera downregulates LPS-induced inflammatory cytokine production and expression of NLRP3 inflammasome in human macrophages〔J〕.Mol Immunol,2013; 56(4) : 471-9.
20 Elton TS,Selemon H,Elton SM.Regulation of the MIR155 host gene in physiological and pathological processes〔J〕.Gene,2013; 532(1) : 1-12.
21 Qu Y,Dang S,Hou P.Gene methylation in gastric cancer〔J〕.Clin Chim Acta,2013; 424: 53-65.
22 Xu XL,Yu J,Zhang HY,et al.Methylation profile of the promoter CpG islands of 31 genes that may contribute to colorectal carcinogenesis〔J〕.World J Gastroenterol,2012; 10(23) : 3441-54.
〔2014-07-09修回〕
(编辑苑云杰)
〔中图分类号〕R741.02
〔文献标识码〕A
〔文章编号〕1005-9202(2015) 16-4491-03;
doi:10.3969/j.issn.1005-9202.2015.16.031
