CDK2 shRNA慢病毒载体的构建及其基因沉默效应
2015-03-05晋佳路朱仁书谢育媛刘红春鹤壁职业技术学院医学院河南鹤壁458030
晋佳路 朱仁书 谢育媛 刘红春(鹤壁职业技术学院医学院,河南 鹤壁 458030)
CDK2 shRNA慢病毒载体的构建及其基因沉默效应
晋佳路朱仁书谢育媛1刘红春2
(鹤壁职业技术学院医学院,河南鹤壁458030)
〔摘要〕目的构建CDK2 shRNA慢病毒载体,并在黑色素瘤细胞B16-F1中鉴定其基因沉默效应。方法体外构建3个慢病毒重组目的质粒pUL-CDK2-shRNAs和1个阴性对照慢病毒重组质粒pUL-NC-shRNA,转化感受态细胞,PCR鉴定后进一步测序验证; 293T细胞中测定病毒滴度;用重组慢病毒感染B16-F1细胞测定其感染效率,RT-PCR和Western印迹检测其对B16-F1细胞中CDK2的基因沉默效应。结果PCR鉴定后进一步测序表明,成功构建了重组慢病毒质粒;病毒滴度为4.5×107~5.5×107TU/ml;用重组慢病毒感染B16-F1细胞,当感染复数(MOI)为10时,感染效率可达90%; RT-PCR和Western印迹结果表明,与未感染组和NC-shRNA感染组细胞相比,CDK2-shRNA1、CDK2-shRNA2、CDK2-shRNA3感染的细胞中CDK2 mRNA和蛋白表达均受到不同程度抑制(P<0.05),以CDK2-shRNA3感染组的抑制率最高,RT-PCR和Western Blot检测其抑制率分别为78.5%±4.23%和70.5%±3.54%。结论利用RNAi技术成功构建了3种CDK2-shRNA重组慢病毒载体,均可有效感染B16-F1细胞并具有一定的基因沉默效应,其中以针对靶位点1012-1020的pUL-CDK2-shRNA3基因沉默效应最强,为进一步研究CDK2基因沉默对黑色素瘤化疗敏感性的影响奠定了基础。
〔关键词〕CDK2;慢病毒载体; shRNA;基因沉默
1湖北省食品药品监督检验研究院2郑州大学第一附属医院
第一作者:晋佳路(1972-),女,副教授,博士,主要从事肿瘤的生物治疗与基因治疗研究。
周期素依赖性蛋白激酶(CDKs)对细胞分裂周期起关键作用,其中CDK2是CDK家族的重要成员,它通过与cyclin A、cyclin E结合形成复合物参与细胞周期,不仅控制S期DNA合成的起始,而且控制G1期进入S期〔1~3〕。研究发现多种肿瘤细胞高表达CDK2,黑色素瘤中CDK2的表达尤其活跃〔4,5〕。因此,下调CDK2基因表达水平有可能阻止或延缓细胞分裂增殖,从而达到抗肿瘤的目的,但目前针对小鼠的CDK2基因沉默研究文献鲜见报道。本研究拟构建CDK2 shRNA重组慢病毒载体,使用高表达CDK2的小鼠黑色素瘤细胞B16-F1检测CDK2 shRNA对基因的沉默效应,为后期研究黑色素瘤的基因治疗及其对黑色素瘤化疗敏感性的影响奠定基础。
1 材料和方法
1.1主要材料慢病毒质粒pRNAT-U6.2/Lenti(pUL,Gen-Script公司) ;包装质粒pLP1、pLP2和pLP/VSVG,Polybrene,LipofectineTM2000(Invitrogen公司) ;感受态大肠杆菌DH5α,293T细胞,B16-F1细胞(中国典型培养物保藏中心) ;限制性内切酶BamHⅠ和XhoⅠ,T4 DNA连接酶和质粒DNA小提试剂盒(TaKaRa公司) ; DMEM培养液、胰蛋白酶(Hycolone公司) ;胎牛血清(杭州四季青公司) ; Taq DNA聚合酶(Fementas公司) ;琼脂糖凝胶DNA回收试剂盒(Promega公司) ; Trizol、逆转录试剂盒、SYBR Green荧光定量PCR试剂盒(TaKaRa公司) ; PVDF膜和ECL试剂(Invitrogen),β-actin抗体、CDK2抗体(Santa Cruz公司) ;其他试剂均为国产或进口分析纯。
1.2CDK2 shRNA慢病毒重组质粒构建及鉴定
1.2.1shRNA oligo DNA序列的设计与合成根据GenBank小鼠cdk2基因信息(NM_016756.4),应用干扰序列设计软件,经NCBI BLAST同源性分析,选择3条含有19个核苷酸的特异性序列作为RNAi的靶序列: 382~400位(CTCTCCTTAAGGAACTTA)、482~500位(CCTCAAGAAATTCATGGA)、1 012~1 020位(CGGAGCTTGTTATCGCAAA)。同时选择1条无意义序列作为阴性对照: 5’TTCTCCGAACGTGTCACG3’。然后按照siRNA设计原则,设计并合成3对特异性shRNA oligo DNA(分别命名为CDK2-shRNA1,2,3)和1对阴性对照shRNA oligo DNA(命名为NC shRNA,即negative control shRNA),并在其5'-端和-3'端分别引入BamH I和Xho I酶切位点。每对shRNA oligo DNA中正义链序列为5'-BamH I (G/GATCC) +靶序列+loop (TTCAAGAGA) + (靶序列的反向互补序列) +终止信号(TTTTT) +Xho I(C/TCGAG) -3',由上海生工公司合成。
1.2.2慢病毒重组质粒的构建及鉴定将合成的正义和反义shRNA oligo DNA经退火形成4对含有黏性末端双链DNA片段。用BamHⅠ和XhoⅠ双酶切慢病毒质粒pRNAT-U6.2/Lenti(简称为pUL),纯化回收线性化片段,再用T4 DNA连接酶与双链DNA连接。连接产物(命名为pUL-CDK2-shRNAs)转化DH5α感受态细胞,挑选重组阳性克隆扩增,提取质粒,经PCR鉴定正确后进一步测序验证。PCR引物在载体多克隆位点两侧设计,正义: 5'-GGACTATCATATGCTTACCG-3';反义: 5'-ACCGAGGAGAGGGTTAGGGAT-3'。
1.3慢病毒重组质粒的包装及病毒滴度测定将4种慢病毒重组质粒分别与包装质粒混合物(pLP1、pLP2和pLP /VSVG) 按LipofectamineTM2000说明书共转染293T细胞。转染6 h后更换为新鲜培养基,培养48 h后,收集病毒上清,获得浓缩的病毒颗粒,按1ml/支分装,置-80℃长期保存。将浓缩的病毒颗粒10倍倍比稀释(1~10-7)后,分别感染293T细胞,培养24 h后,更换完全培养基继续培养48 h,荧光显微镜下观察细胞荧光表达情况并计算病毒滴度。
1.4重组慢病毒感染B16-F1细胞用重组慢病毒颗粒分别感染B16-F1细胞,感染前1 d将B16细胞接种于6孔板中,每孔接种105个细胞,于37℃、5% CO2培养箱培养,24 h后开始病毒感染,感染复数(MOI)为10,感染12 h后更换新鲜培养基继续培养60 h。在荧光显微镜下观察绿色荧光蛋白GFP的表达,以判断慢病毒感染效率。
1.5RT-PCR检测CDK2 mRNA的表达收集重组慢病毒感染72 h后的各组B16-F1细胞及空白对照组(CON组)细胞,按照TrIzol试剂说明书提取细胞总RNA,琼脂糖凝胶电泳检测总RNA质量,紫外分光光度法测定其浓度。取5 μg总RNA,使用反转录试剂盒合成cDNA,使用SYBR Green荧光定量PCR试剂进行RT-PCR检测。实验重复5次,每次每个样本做3个复孔。
1.6Western印迹检测CDK2蛋白的表达收集重组慢病毒感染后的各组B16-F1细胞及CON组细胞,提取细胞总蛋白,BCA法进行蛋白定量。各组取等量蛋白上样,SDS-PAGE凝胶电泳,电泳后将目的条带转移到PVDF膜上,在室温下用含5%脱脂奶粉的TBST封闭1 h,与一抗室温孵育2 h,洗去未结合的一抗,加二抗,再与二抗在室温下孵育1 h,最后用ECL使目的条带在X胶片上曝光。
1.7统计学分析采用SPSS14.0软件,计量资料组间均数比较采用单因素方差分析和LSD-t检验。
2 结果
2.1CDK2-shRNA慢病毒重组质粒的构建及鉴定CDK2-shRNAs重组阳性克隆的PCR产物约为276 bp;空载体克隆的PCR产物约为229 bp,与预期结果相符(图1)。进一步测序证明,CDK2-shRNA1、CDK2-shRNA2、CDK2-shRNA3、NC-shRNA序列插入正确(图2)。

图1 PCR对CDK2-shRNAs重组质粒的鉴定结果
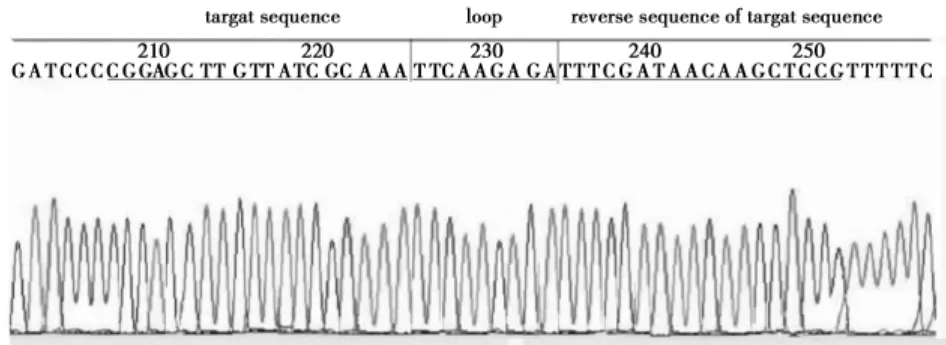
图2 慢病毒重组质粒插入序列测序结果(展示CDK2-shRNA3插入序列)
2.2慢病毒重组质粒的包装及病毒滴度测定结果表明,每种重组慢病毒滴度均达4.5×107~5.5×107TU/ml,符合后续试验要求。
2.3B16-F1细胞感染效率鉴定通过普通明光视野和绿色荧光视野对比可见,MOI为10时,约90%的细胞均可见绿色荧光(图3)。
2.4基因沉默效率检测
2.4.1RT-PCR检测各组抑制效率未感染病毒组(CON组,0.175±0.013)与NC-shRNA感染组(NC组,0.173±0.016)之间无统计学差异(P>0.05),3个阳性感染组(CDK2-shRNA1、2、3感染组分别为0.073±0.014、0.133±0.029、0.029±0.014)与前两组相比有统计学差异(P<0.05),均表现出不同程度的抑制,其抑制率分别为52.8%±6.35%、30.7%±7.54%、78.5%± 4.23%,其中以CDK2-shRNA3感染组的抑制率最高。
2.4.2Western印迹检测各组抑制效率CON组与NC组之间差异无统计学意义(P>0.05),CDK2-shRNA1、2、3感染组与前两组相比差异有统计学意义(P<0.05),均表现出不同程度的抑制,其抑制率分别为50.4%±7.21%、35.3%±4.33%、70.5%±3.54%,其中以CDK2-shRNA3感染组的抑制率最高(图4)。

图3 重组慢病毒感染B16-F1细胞72 h的感染效果(MOI=10) (×100)

图4 Western印迹检测CDK2蛋白的表达
3 讨论
RNA干扰(RNAi)是指由短双链RNA诱导的同源RNA特异性降解的过程,可使基因的表达受到抑制。发挥RNAi作用的短双链RNA被称作小干扰RNA(siRNA)〔6,7〕。短发夹状RNA(shRNA)是采用病毒载体或质粒表达的siRNA,即具有RNA聚合酶Ⅲ启动子U6或H1及其下游一小段特殊结构的重组病毒载体或重组质粒转染到宿主细胞后,转录出shRNA,shRNA在细胞内被Dicer复合酶剪切成siRNA而发挥作用〔8〕。目前,实现RNAi常用的载体有病毒载体或质粒载体,其中慢病毒载体越来越多地被选用作为运载外源基因的工具,因为慢病毒载体具有既可感染非分裂期细胞又可感染分裂期细胞、感染效率高、容纳外源性基因片段大、可长期表达且未见病理损害现象等显著优点。另外,在慢病毒载体中,可以整合标签序列如His、GFP等,通过检测标签可直观地观察感染效率,为基因功能的研究提供更强大的工具〔9,10〕。pRNAT-U6.2/Lenti(pUL)是专门在真核细胞内转录生成shRNA的表达载体。
本实验成功构建了针对CDK2基因的shRNA慢病毒重组载体。将CDK2-shRNA慢病毒重组载体转染293T细胞,包装产生了滴度高达4.5×107~5.5×107TU/ml的病毒颗粒,完全能够满足后续实验。用重组病毒颗粒感染小鼠黑色素瘤细胞B16-F1,感染效率可达90%,说明获得了高感染效率的慢病毒颗粒。RTPCR和Western blot检测基因沉默效应,结果表明靶基因干扰序列均能对CDK2的表达起到显著抑制作用,说明构建的针对CDK2基因的shRNA慢病毒重组载体进入细胞后表达了shRNA,shRNA在胞内Dicer酶的作用下将单链环状结构切除降解,剩下19~23 bp的短双链DNA即为siRNA,进入RNAi通道,形成RNAi沉默复合物,对CDK2 mRNA进行降解。构建的三个shRNA重组慢病毒以针对1012-1020位靶序列的基因沉默效应最为显著,本研究为进一步研究黑色素瘤的基因治疗及基因沉默对黑色素瘤化疗药物敏感性研究提供了理想的工具。
4 参考文献
1 Chohan TA,Qian H,Pan Y,et al.Cyclin-dependent kinase-2 as a target for cancer therapy: progress in the development of CDK2 inhibitors as anti-cancer agents〔J〕.Curr Med Chem,2015; 22(2) : 237-63.
2 Flores OI,Wang Z,Knudsen KE,et al.Nuclear targeting of cyclin-dependent kinase 2 reveals essential roles of cyclin-dependent kinase 2 localization and cyclin E in vitamin D-mediated growth inhibition〔J〕.Endocrinology,2010; 151(3) : 896-908.
3 Aleem E,Berthet C,Kaldis P.Cdk2 as a master of S phase entry: fact or fake〔J〕? Cell Cycle,2004; 3(1) : 35-7.
4 Rásó E,Barbai T,Gyõrffy B,et al.Prognostic and predictive markers of malignant melanoma〔J〕.Magy Oncol,2013; 57(2) : 79-83.
5 Abdullah C,Wang X,Becker D.Expression analysis and molecular targeting of cyclin-dependent kinases in advanced melanoma〔J〕.Cell Cycle,2011; 10(6) : 977-88.
6 Vento TJ,Prakash V,Murry CK,et al.Pneumonia in military trainess: a comparison study based on adenovirus serotype 14 infection〔J〕.J Infect Dis,2011; 203(10) : 1388-95.
7冯作化.医学分子生物学〔M〕.北京:人民卫生出版社,2005: 172-4.
8 Lipardi C,Wei Q,Paterson BM.RNAi as random degradative PCR: siRNA primers convert mRNA into dsRNAs that are degraded to generate new siRNAs〔J〕.Cell,200; 107(3) : 297-307.
9 Singer O,Verma IM.Applications of lentiviral vectors for shRNA delivery and transgenesis〔J〕.Curr Gene Ther,2008; 8(6) : 483-8.
10 Shearer RF,Saunders DN.Experimental design for stable genetic manipulation in mammalian cell lines: lentivirus and alternatives〔J〕.Genes Cells,2015; 20(1) : 1-10.
〔2015-06-10修回〕
(编辑曲莉)
通讯作者:刘红春(1963-),女,博士,教授,主任技师,主要从事肿瘤基因诊断研究。
基金项目:河南省科技计划项目(122300410193) ;河南省高等学校青年骨干教师资助计划项目(2011GGJS-262)
〔中图分类号〕R73-3
〔文献标识码〕A
〔文章编号〕1005-9202(2015) 16-4483-03;
doi:10.3969/j.issn.1005-9202.2015.16.028
