脑胶质瘤细胞MGMT甲基化状态与细胞对烷化剂耐药性的关系
2015-03-05李培栋王新军吴跃辉郑州大学第五附属医院神经外科河南郑州450052
李培栋 王新军 单 峤 吴跃辉 王 振(郑州大学第五附属医院神经外科,河南 郑州 450052)
脑胶质瘤细胞MGMT甲基化状态与细胞对烷化剂耐药性的关系
李培栋王新军单峤吴跃辉王振
(郑州大学第五附属医院神经外科,河南郑州450052)
〔摘要〕目的探讨脑胶质瘤细胞O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)基因启动子甲基化状态与细胞对烷化剂药物(TMZ)耐药性的相关性。方法取处于对数生长期的人脑胶质瘤细胞系U87-MG、T98G和U251,利用MTT法检测不同浓度TMZ对上述三种胶质瘤细胞系的作用。提取细胞基因组DNA,用甲基化特异性PCR(MS-PCR)检测胶质瘤细胞中MGMT基因甲基化状态。结果与对照组(0.1%DMSO)相比,TMZ仅能抑制U87-MG细胞的活性(P<0.05),而不能抑制T98G和U251细胞的活性(P>0.05) ;运用MS-PCR检测到U87-MG存在MGMT启动子甲基化,而T98G和U251均不存在MGMT启动子甲基化。结论U87-MG、T98G和U251人脑胶质瘤细胞系MGMT启动子甲基化状态与细胞对烷化剂的敏感性存在相关性。
〔关键词〕胶质瘤;替莫唑胺;耐药性; MGMT启动子甲基化
第一作者:李培栋(1971-),男,副主任医师,主要从事脑血管病、脑肿瘤的外科治疗研究。
脑胶质瘤的治疗包括手术治疗、化疗和放疗等,术后化疗是治疗脑胶质瘤重要的辅助手段。替莫唑胺(TMZ)是一类新型烷化剂,是脑胶质瘤术后化疗的重要药物,对脑胶质瘤的作用可能与O6-甲基鸟嘌呤-DNA-甲基转移酶(MGMT)启动子甲基化相关〔1〕。然而,脑胶质瘤对TMZ的耐药现象很常见〔2,3〕,而且胶质瘤的标本不易得到,因此应用人源性脑胶质瘤细胞系研究耐药机制受到关注。本实验旨在应用U87-MG、T98G和U251人脑胶质瘤细胞系研究脑胶质瘤细胞MGMT基因甲基化状态与细胞对烷化剂耐药性之间的关系,为提高脑胶质瘤患者化疗效果提供理论依据。
1 材料与方法
1.1实验材料人脑胶质瘤细胞株U87-MG、T98G和U251 (ATCC公司),DMEM、胎牛血清(FBS) (GIBCO公司),二甲基亚砜(DMSO)、替莫唑胺(Sigma公司),四甲基偶氮唑蓝(MTT,Sigma公司),基因组DNA提取试剂盒、DNA甲基化修饰试剂盒(美国ZMYO RESEARCH公司),DNA聚合酶(日本Takara公司)。
1.2细胞培养冻存的胶质瘤细胞系U87-MG、T98G和U251从液氮罐中取出,迅速投入37℃水浴至融化,离心后小心弃上清,取配制好的含10%FBS的DMEM培养液轻轻吹打混匀,置于37℃5%CO2的培养箱中进行培养,待细胞达70%~80%汇合时用于实验。
1.3MTT法检测TMZ对胶质瘤细胞系的作用将TMZ溶于DMSO中配制成终浓度为10 mM,放置于-20℃保存,用时倍比稀释至所需浓度。取脑胶质瘤U87-MG、T98G和U251细胞,将细胞浓度为2×104/ml的悬液接种于96孔板中,每孔100 μl,放入细胞培养箱中培养24 h后弃去上清,分别加入0.4、4、40 μmol/L TMZ(0.4、4、40 μmol/L)作用48 h后加入20 μl的MTT,37℃孵育4 h后,弃上清,然后加入DMSO 150 μl,15 min后用酶标仪(Tacan,Switzerland)在570 nm处测定各孔吸光度。根据吸光度值计算细胞存活率。药物敏感性的判断标准为: 1× PPC浓度(4 μmol/L)的TMZ能抑制胶质瘤细胞活性为敏感,1×PPC浓度(4 μmol/L)的TMZ不能抑制胶质瘤细胞活性为耐药。
1.4细胞DNA的提取用DNA提取试剂盒对U87-MG、T98G 和U251细胞进行DNA提取,具体操作步骤按照试剂盒的说明书进行,提取后用紫外分光光度计进行DNA浓度的检测。
1.5MGMT基因扩增用DNA甲基化修饰试剂盒进行亚硫酸氢盐的修饰,步骤参照所用试剂盒的说明书。甲基化和未甲基化引物的设计参照文献〔3〕,引物序列MGMT甲基化上游: TTTCGACGTTCGTAGGTTTTCGC,下游: GCACTCTTCCGAAAACGAAACG,81 bp; MGMT非甲基化上游: TTTGTGTTTTGATGTTTGTAGGTTTTTGT,下游: AACTCCACACTCTTCCAAAAACAAAACA,93 bp。引物由日本Takara生物技术有限公司进行合成。
采用甲基化特异性PCR(MS-PCR)方法,以修饰所得的基因组DNA作为标本,选用Taq DNA聚合酶对MGMT启动子序列进行扩增。扩增的循环参数: 95℃5 min; 95℃45 s,引物退火温度30 s,72℃60 s,共35个循环; 72℃延伸5 min。待反应结束后,对扩增产物用2%琼脂糖凝胶进行电泳,用溴乙啶染色,在凝胶成像系统下进行结果观察。结果判定:出现非甲基化条带而且没有出现甲基化条带则判定为MGMT启动子非甲基化;出现甲基化条带时则判定为MGMT启动子甲基化状态。1.6统计学方法应用SPSS13.0软件行t检验。
2 结果
2.1TMZ对胶质瘤细胞系的活性影响与对照组(0.1%DMSO)相比,4 μmol/L的TMZ能降低U87-MG细胞存活率至89.7%(P<0.05),40 μmol/L的TMZ使细胞存活率降至67.3% (P<0.05)。对于T98G和U251细胞系,0.4、4 μmol/L和40 μmol/L的TMZ均不能抑制细胞的细胞活性(P>0.05)。因此,在所检测的胶质瘤细胞系中,U87-MG对TMZ敏感,而T98G和U251细胞系对TMZ不敏感。见图1。
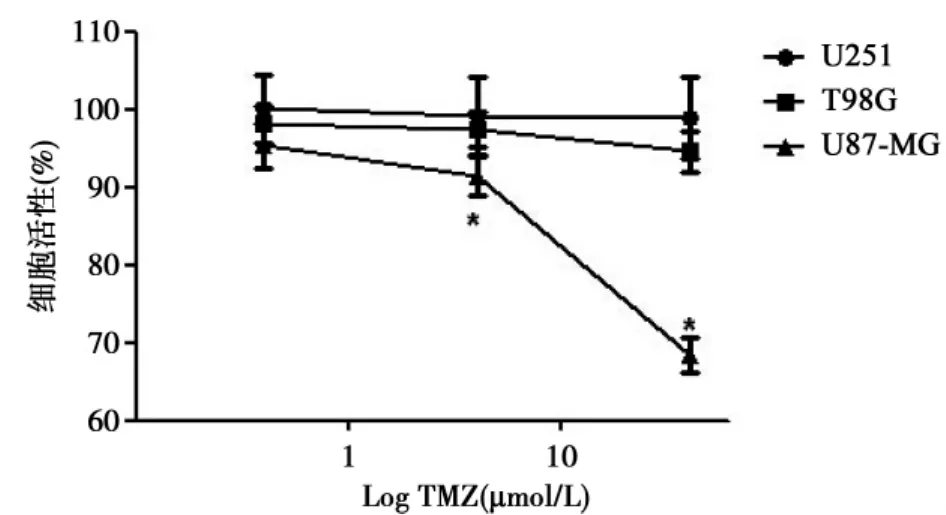
图1 TMZ对三种胶质瘤细胞的作用
2.2三种胶质瘤细胞中MGMT启动子甲基化状态检测U87-MG细胞出现甲基化条带(M),表明U87-MG细胞存在MGMT启动子呈甲基化状态;而T98G和U251细胞出现非甲基化条带(U),且没有出现甲基化条带(M),表明T98G和U251细胞MGMT启动子为非甲基化状态。见图2。

图2 MGMT基因启动子的MS-PCR扩增
3 讨论
脑胶质瘤是最常见的恶性的原发性颅内肿瘤,化疗是脑胶质瘤综合治疗措施中重要组成部分。TMZ是一种咪唑四嗪类衍生物,为新型烷化剂,具有口服后吸收率高,脂溶性强,易透过血脑屏障,并且不良作用小等优势药理特性,已成为脑胶质瘤的一线化疗药物〔4〕。研究表明胶质瘤细胞对TMZ敏感性可能与MGMT的表达水平相关。MGMT是DNA修复酶中的一种,可以对烷化剂等药物造成的DNA损伤进行修复,进而使肿瘤细胞产生耐药,并且其蛋白表达受MGMT基因启动子甲基化状态调节。MGMT基因启动子甲基化导致MGMT蛋白表达降低,反之,MGMT基因启动子非甲基化导致MGMT蛋白表达增高。大量文献研究数据表明,肿瘤组织对烷化剂产生耐药性的主要原因是MGMT蛋白在脑胶质瘤组织中的表达〔5,6〕。一项临床随机对照试验〔7〕指出胶质瘤患者MGMT启动子甲基化与TMZ的治疗相关: MGMT启动子甲基化的患者受益于TMZ的治疗,而非甲基化的患者则没有显示出对TMZ的获益。
本研究证实U87-MG、T98G和U251人胶质瘤细胞系对TMZ的敏感性与其MGMT启动子甲基化状态相关,提示胶质瘤细胞系对烷化剂TMZ的敏感性与其MGMT启动子甲基化状态。这一研究结果与之前的研究结果一致〔7~9〕。
综上所述,本研究证实胶质瘤细胞MGMT启动子甲基化与胶质瘤对烷化剂耐药有密切关系,为临床化疗药物的选择提供了理论依据。
4 参考文献
1 Villano JL,Seery TE,Bressler LR.Temozolomide in malignant gliomas: current use and future targets〔J〕.Cancer Chemother Pharmacol,2009; 64 (4) : 647-55.
2 Rosso L,Brock CS,Gallo JM,et al.A new model for prediction of drug distribution in tumor and normal tissues: pharmacokinetics of temozolomide in glioma patients〔J〕.Cancer Res,2009; 69(1) : 120-7.
3 Lee S,Kim WH,Jung HY,et al.Aberrant CpG island methylation of multiple genes in intrahepatic cholangiocarcinoma〔J〕.Am J Pathol,2002; 161(3) : 1015-22.
4潘强,杨学军,高松,等.替莫唑胺改变人胶质瘤细胞系U251耐药机制的体外研究〔J〕.中国现代神经疾病杂志,2009; 9(6) : 583-8.
5卢圣奎,王苑宇,王帅,等.不同种类药物对肿瘤细胞增殖的抑制作用〔J〕.中华实验外科杂志,2014; 31(2) : 405-7.
6Sabharwal A,Middleton MR.Exploiting the role of O6-methylguanine-DNA-methyltransferase(MGMT) in cancer therapy〔J〕.Curr Opin Pharmacol,2006; 6(4) : 355-63.
7 Hegi ME,Diserens AC,Gorlia T,et al.MGMT gene silencing and benefit from temozolomide in glioblastoma〔J〕.N Engl J Med,2005; 352(10) : 997-1003.
8陈晋,程远,汪峰,等.DNA甲基化与人神经胶质瘤细胞株SHG-44多药耐药的相关性〔J〕.中国老年学杂志,2013; 33(24) : 6200-6.
9 Ueda S,Mineta T,Nakahara Y,et al.Induction of the DNA repair gene O6-methylguanine-DNA methyltransferase by dexamethasone in glioblastomas〔J〕.J Neurosurg,2004; 101(4) : 659-63.
〔2015-01-13修回〕
(编辑袁左鸣)
〔中图分类号〕R73
〔文献标识码〕A
〔文章编号〕1005-9202(2015) 16-4463-02;
doi:10.3969/j.issn.1005-9202.2015.16.019
