骨髓间充质干细胞归巢促小鼠骨折愈合的实验研究
2015-03-04苟文隆徐小龙李丙岩汪爱媛刘舒云许文静卢世璧
王 鑫 苟文隆 徐小龙 李丙岩 王 程 汪爱媛 王 玉 刘舒云 许文静 卢 强 彭 江 卢世璧
干细胞具有多向分化潜能及自我更新能力,在组织损伤时可归巢至损伤组织处促进组织修复,目前在心肌、肺、胰、神经及骨等组织有较多报道[1-5],其归巢修复能力已逐渐达成共识,但损伤后全身干细胞的动员、迁移机制以及迁移到损伤处后的具体作用机制仍不清楚。体内干细胞来源有限,骨髓中仅有0.001%~0.01%的单核细胞是间充质干细胞(MSC)[6]。损伤较严重时,通常可采用体外扩增培养后再回输体内的方法应对自体MSC不足。本研究通过尾静脉向闭合性股骨骨折内固定小鼠模型注射红色荧光蛋白标记的骨髓间充质干细胞(RFP-BMSC),观察骨髓间充质干细胞(BMSC)在骨折愈合中的作用,同时通过注射基质细胞衍生因子(SDF)-1受体CXCR4的特异性阻断剂桥联1,4,8,11-四氮杂环十四烷(AMD3100),探讨 SDF-1/CXCR4通路在这一过程中的意义。
1 材料与方法
1.1 实验动物与实验成品细胞
6周龄健康成年雄性清洁级C57/BL小鼠65只,体重17~25 g,由军事医学科学院实验动物中心提供。实验内容、方法及小动物福利等均已经中国人民解放军总医院医学伦理委员会审核批准。RFP-BMSC由赛业(广州)生物科技有限公司提供。
1.2 小鼠闭合性股骨骨折内固定模型建立
1.2.1 造模支架设计制作
参照文献[7]设计制作造模支架,该支架可根据小鼠体型调整支架的载物台及置腿台;增加了力学传导系统及弹簧装置,使砝码下落形成的冲量能更加稳定准确地传导至小鼠大腿,并防止重锤反弹导致二次损伤(图1)。

图1 小鼠闭合性股骨骨折模型造模支架示意图 a.正面观 b.侧面观 c.支架结构示意图 d.载物台、置腿台及重锤
1.2.2 小鼠模型制造
小鼠予1%水合氯醛3 mL/kg腹腔注射麻醉,仰卧位屈膝90°固定,右膝术区备皮,常规消毒铺巾,于右膝关节髌骨水平作一1 cm纵行正中切口,沿髌骨内侧缘切开关节囊和股四头肌肌腱,将髌骨翻向外侧,充分暴露股骨内外髁间沟,于此处将直径0.45 mm不锈钢针刺入骨髓至约股骨转子间窝水平以起到髓内钉固定的作用。剪断钢针针柄,将针尾埋于股骨髁间窝内,使其不影响膝关节活动,关闭创口。术毕将小鼠转移至载物台,置其右大腿于冲击台上。从17~20 cm高处落下200 g砝码(根据小鼠体重适度调整),使该侧股骨骨折并立即采用美国Faxitron公司MX-20型放射检测系统确定骨折情况。造模成功的小鼠饲养于25℃室温笼中,自由活动,常规食水。
1.3 实验步骤
65只小鼠造模成功后7 d分为3组,给予不同干预:MSC组(35只)尾静脉注射0.5 mL生理盐水,0.5 h后注射内含1×106个 RFP-BMSC 溶液0.5 mL;AMD3100 组 (15 只 )尾 静 脉 注 射1 mmol/L AMD3100 0.5 mL,0.5 h后注射内含1×106个RFP-BMSC溶液0.5 mL;对照组(CON)组(15只):尾静脉注射生理盐水0.5 mL,0.5 h后再次注射生理盐水0.5 mL。造模成功后14、28、42 d取右侧股骨干,抽出内固定针后分别制备冰冻切片标本、免疫荧光标本冻存于-80℃冰箱,组织切片标本则以10%中性甲醛固定。其中各组14、42 d后均分别取5只小鼠制备组织切片标本,且42 d后再各取5只小鼠进行生物力学检测;MSC组术后14、28、42 d均各取5只制备冰冻切片,采用荧光示踪法观察小鼠RFP-BMSC归巢情况,并在28 d后取5只小鼠采用免疫荧光法观察BMSC位置和骨桥蛋白(OPN)、骨钙素(OCN)的表达。
1.4 实验方法
1.4.1 冰冻切片荧光示踪法
将MSC组标本用最佳切片温度(OCT)冰冻包埋剂包埋并切取厚约7μm切片,采用美国Sigma公司Hochest33258染色试剂盒对细胞核进行染色,使未经红色荧光蛋白标记的细胞在荧光激发下发出蓝光,而RFP-BMSC则发出红色荧光,进行叠加后可对干细胞进行示踪,进而可在荧光显微镜下观察RFP-BMSC归巢情况。
1.4.2 免疫荧光法
骨折后28 d是骨折愈合过程中骨性骨痂生成并进行塑形改造的关键期,许多促进骨折愈合的骨形成因子表达均在此时达到高峰。本实验选择造模成功后28 d通过免疫荧光法检测小鼠股骨骨折区RFP-BMSC骨标志蛋白表达情况。取 MSC组标本用OCT冰冻包埋剂包埋并切取厚约7μm切片,晾干30 min,丙酮内固定10 min,过蒸馏水后以3% 过氧化氢浸泡5 min去抗原,磷酸盐缓冲液内浸润3次,再依次滴加SDF-1、OPN、OCN 一抗及二抗,采用Hochest33258染色试剂盒染色后在共聚焦显微镜下进行观察。其中未经红色荧光蛋白标记的细胞发出蓝色荧光,RFP-BMSC发出红色荧光,而目的因子的一抗与二抗结合后发出绿色荧光,进行叠加后可观察归巢的干细胞位置及是否表达OCN、OPN。
1.4.3 组织学观察
取各组造模成功后14、42 d标本在10%中性甲醛中固定,10% 乙二胺四乙酸(EDTA)脱钙液中脱钙,石蜡包埋,连续切取厚5μm切片,60℃烤片过夜,制备组织切片标本;进行HE染色和Masson三色染色,常规脱水后中性树脂封片,在显微镜下进行观察。HE染色可显示骨折基本形态及骨痂形成情况,Masson染色中呈绿色的为钙化骨性骨痂成分。
1.4.4 生物力学检测
取各组造模成功后42 d小鼠5只,去除右侧股骨内固定针后使用美国Bose公司Electro Force5100生物力学机进行三点弯曲力学检测,并以各自健侧股骨干作为正常对照组。置标本于载物台,使负荷加载点位于股骨骨折线处,跨距1 cm,加载速度5 mm/min(图2),直至骨断裂。实验过程保持标本湿润。计算机自动绘制载荷-形变曲线,并计算最大载荷、最大桡度、弹性桡度及刚度。结果以均数±标准差表示,采用SPSS 17.0进行统计学F检验及组间SNK检验。

图2 三点弯曲力学检测示意图
2 结果
2.1 RFP-BMSC归巢定位观察结果
MSC组造模成功后14、28、42 d均可见小鼠股骨骨折区骨痂内有RFP-BMSC归巢,而周围软组织及正常骨组织内未见大量该类细胞聚集(图3)。
2.2 免疫荧光观察结果
MSC组造模成功后28 d,小鼠右侧股骨部位可见大量RFP-BMSC表达,并可见OCN和OPN表达(图4)。
2.3 病理组织切片观察结果
造模成功后14 d CON组与AMD3100组 HE染色可见骨折断端清晰,周围呈梭形膨大骨痂,Masson三色染色示骨痂以软骨成分为主,少量钙化成为骨性骨痂;MSC组骨折线不明显,骨痂已多为骨性骨痂。3组42 d后骨折线均消失,编织骨向板层骨转化,CON组与AMD3100组处于骨痂塑形期,皮质骨质量差,MSC组骨痂已基本塑形完成(下页图5)。
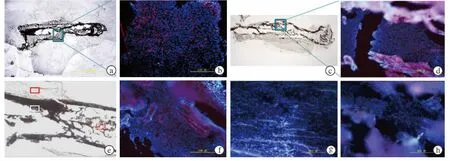
图3 冰冻切片荧光示踪显微观察示MSC组骨折后14、28、42 d骨折断端骨痂区可见RFP-BMSC归巢 a.骨折后14 d冰冻切片大体观(×12.5),蓝色框表示图b观察区域 b.骨折后14 d冰冻切片荧光示踪观察结果(×200) c.骨折后28 d冰冻切片大体观(×12.5),蓝色框表示图d观察区域 d.骨折后28 d冰冻切片荧光示踪观察结果(×200) e.骨折后42 d冰冻切片大体观(×40),骨痂区(白实线框内)可见RFP-BMSC,而肌肉区(红实线框内)及正常骨髓区(红虚线框内)均未见 f.骨折后42 d骨痂区荧光示踪观察结果(×200) g.骨折后42 d肌肉区荧光示踪观察结果(×200) h.骨折后42 d骨髓区荧光示踪观察结果(×200)
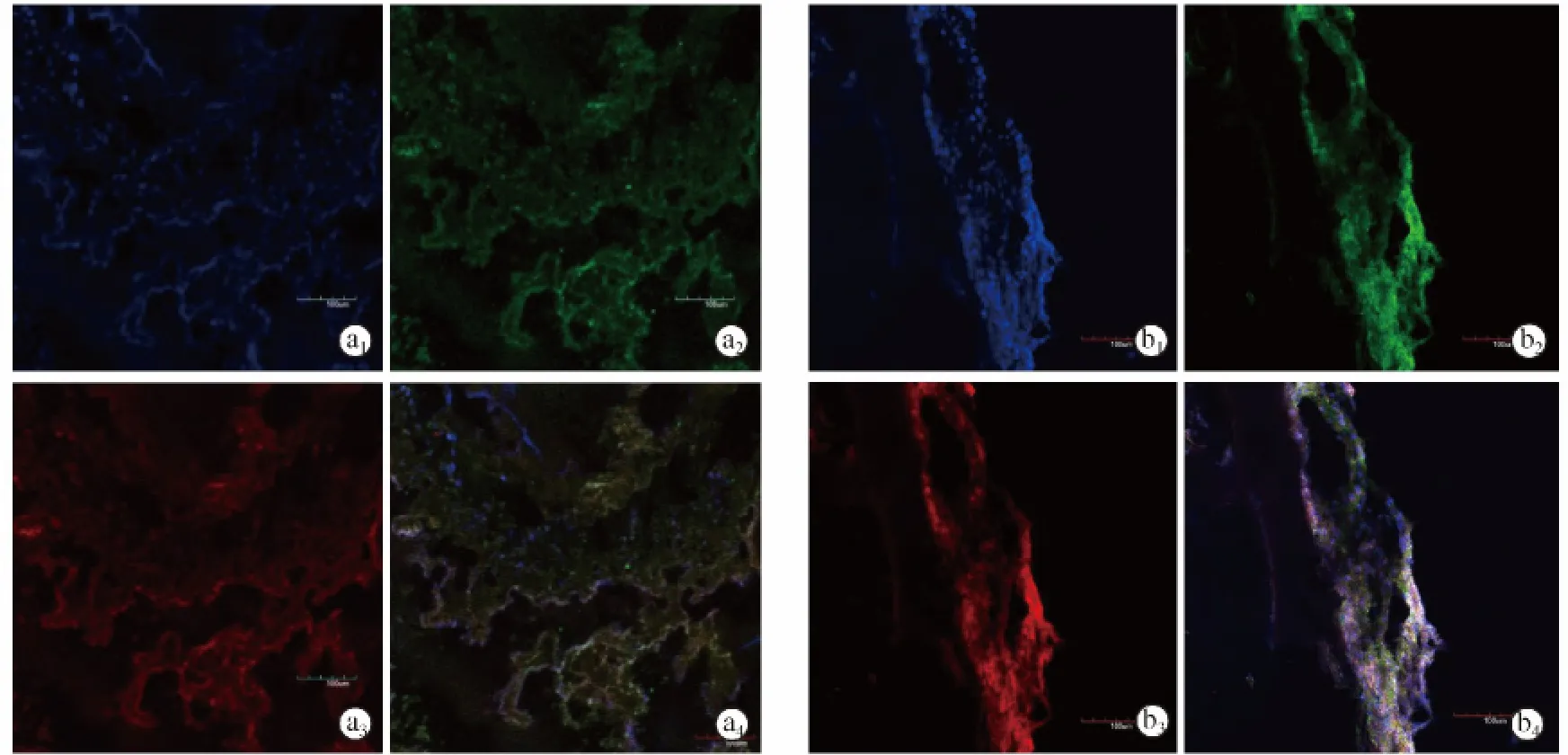
图4 MSC组免疫荧光观察结果(×100),红色为RFP-BMSC,绿色为目标蛋白,蓝色为细胞核染色,重合图即为表达目标蛋白的BMSC a1~a4.OCN表达情况 b1~b4.OPN表达情况
2.4 生物力学检测结果
三点弯曲力学检测显示,造模成功后42 d MSC组最大载荷、最大桡度、弹性桡度及刚度均显著高于AMD3100组及CON组,与正常骨接近(表1)。

表1 各组造模成功后42 d生物力学检测结果

图5 3组术后14 d(a1、a2、b1、b2、c1、c2)及42 d(d1、d2、e1、e2、f1、f2)病理组织切片观察结果
3 讨论
骨折愈合包括两种机制,即软骨内成骨和骨膜成骨,长骨愈合以前者多见。软骨内成骨过程中包括MSC的招募、迁移、增殖、分化这一归巢过程,及随后的软骨生成、钙化成骨。但MSC是如何动员并迁移到骨损伤处的机制目前仍不清楚。有研究[8-9]认为损伤后可能有某种分子上调并释放入血,从而刺激全身MSC进入外周血并迁移至损伤处。细胞因子和趋化因子很可能在这一过程中有着重要作用。白细胞靶向迁移至感染及损伤处的分子机制是趋化因子及其受体结合[10],而MSC被发现可表达许多趋化因子受体[11-12],推测 MSC归巢机制可能与白细胞迁移相似。体内外实验[13-14]均已证实MSC可在趋化因子诱导下发生迁移,其中以与SDF-1/CXCR4相关研究最为广泛。大量研究[15-16]显示SDF-1/CXCR4通路在 MSC归巢机制中具有关键作用,如肝、心、皮肤等损伤时SDF-1表达上调可招募并诱导外周血中表达相应受体CXCR4的MSC向损伤处迁移[17-18]。近年关于这一通路在骨修复中的作用报道[19-20]也逐渐增多。
有研究[21]报道对大鼠注射的外源性BMSC 90%在3 d内发生凋亡,且绝大部分停留在其肺部,这可能是由于肺毛细血管的孔径小于干细胞直径(30μm)所致[22]。但小动物实验中经尾静脉注射的MSC第1天聚集于肺部,3 d后则到达骨损伤处[19]。而体外实验[23-24]中,Transwell小室下室内的SDF-1仍能诱导上室内直径30μm的BMSC穿过直径8μm的滤膜孔到达下室,肺泡屏障应该不是阻止BMSC迁移的主要原因。损伤处的高浓度趋化因子可能是动员全身干细胞向损伤处迁移的驱动力,其中SDF-1起到重要作用,其受体CXCR4的阻断剂可明显抑制这一过程[20,23]。本实验通过制备骨折处标本的冰冻切片、Hochest33258染色后经荧光显微镜下观察到RFP-BMSC经尾静脉注射后第3天到达骨折端,聚集于骨膜旁,并持续表达至第42天。这与文献[23]报道骨损伤后SDF-1主要由骨膜分泌一致。本实验中,AMD3100这一表达于细胞表面的CXCR4阻断剂能明显抑制BMSC向骨损伤处迁移,证明SDF-1/CXCR4通路在促BMSC归巢过程中起到重要作用。
病理学组织切片染色结果及生物力学检测结果证实,BMSC可明显加速骨折愈合过程,提高了新生骨的质量及生物力学性能。冰冻切片荧光示踪观察结果表明BMSC可归巢到骨折端并存活、增殖。研究提示,SDF-1/CXCR4通路可从多个层面调动MSC促进骨折愈合:利用粒细胞集落刺激因子(G-CSF)或巨细胞集落刺激因子(M-CSF)等动员骨髓中表达CXCR4的干细胞进入循环血;采集骨髓血体外扩增培养并对干细胞进行缺氧预处理使其表面CXCR4表达水平上调;增加骨折局部SDF-1水平,促进外周MSC归巢等。
骨折后14、28、42 d,骨折区可见RFP-BMSC且定位于骨膜区域骨痂内,证明BMSC可通过归巢、增殖及促进骨形成明显加速骨折愈合,且新生骨具有更好的生物力学性能,SDF-1/CXCR4通路在归巢过程中起到重要作用。
[1] Gao F,Kar S,Zhang J,et al.MRI of intravenously injected bone marrow cells homing to the site of injured arteries[J].NMR Biomed,2007,20(7):673-681.
[2] Deng J, Zou ZM, Zhou TL,et al. Bone marrow mesenchymal stem cells can be mobilized into peripheral blood by G-CSF in vivo and integrate into traumatically injured cerebral tissue[J].Neurol Sci,2011,32(4):641-651.
[3] Shi XL,Gu JY, Han B,et al. Magnetically labeled mesenchymal stem cells after autologous transplantation into acutely injured liver[J].World J Gastroenterol,2010,16(29):3674-3679.
[4] Tang J,Wang J,Yang J,et al.Mesenchymal stem cells over-expressing SDF-1 promote angiogenesis and improve heart function in experimental myocardial infarction in rats[J].Eur J Cardiothorac Surg,2009,36(4):644-650.
[5] Zhao Z,Wang Y,Peng J,et al.Repair of nerve defect with acellular nerve graft supplemented by bone marrow stromal cells in mice[J].Microsurgery,2011,31(5):388-394.
[6] D’lppolito G,Schiller PC,Ricordi C,et al.Age-related osteogenic potential of mesenchymal stromal stem cells from human vertebral bone marrow[J].J Bone Miner Res,1999,14(7):1115-1122.
[7] Marturano JE,Cleveland BC,Byrne MA,et al. An improved murine femur fracture device for bone healing studies[J].J Biomech,2008,41(6):1222-1228.
[8] Liu ZJ, Zhuge Y, Velazquez OC. Trafficking and differentiation of mesenchymal stem cells[J].J Cell Biochem,2009,106(6):984-991.
[9] Fox JM,Chamberlain G,Ashton BA,et al.Recent advances into the understanding of mesenchymal stem cell trafficking[J].Br J Haematol,2007,137(6):491-502.
[10] Miyasaka M,Tanaka T.Lymphocyte trafficking across high endothelial venules:dogmas and enigmas[J].Nat Rev Immunol,2004,4(5):360-370.
[11] Honczarenko M,Le Y,Swierkowski M,et al.Human bone marrow stromal cells express a distinct set of biologically functional chemokine receptors[J].Stem Cells,2006,24(4):1030-1041.
[12] Chamberlain G, Wright K, Rot A, et al. Murine mesenchymal stem cells exhibit a restricted repertoire of functional chemokine receptors:comparison with human[J].PLoS One,2008,3(8):e2934.
[13] Burger JA,Kipps TJ.CXCR4:a key receptor in the crosstalk between tumor cells and their microenvironment[J].Blood,2006,107(5):1761-1767.
[14] Lataillade JJ,Clay D,Dupuy C,et al.Chemokine SDF-1 enhances circulating CD34(+)cell proliferation in synergy with cytokines:possible role in progenitor survival[J].Blood,2000,95(3):756-768.
[15] Wynn RF,Hart CA,Corradi-Perini C,et al.A small proportion of mesenchymal stem cells strongly expresses functionally active CXCR4 receptor capable of promoting migration to bone marrow[J].Blood,2004,104(9):2643-2645.
[16] Dar A,Goichberg P,Shinder V,et al.Chemokine receptor CXCR4-dependent internalization and resecretion of functional chemokine SDF-1 by bone marrow endothelial and stromal cells[J].Nat Immunol,2005,6(10):1038-1046.
[17] Abbott JD,Huang Y,Liu D,et al.Stromal cell-derived factor-1alpha plays a critical role in stem cell recruitment to the heart after myocardial infarction but is not sufficient to induce homing in the absence of injury[J].Circulation,2004,110(21):3300-3305.
[18] Ji JF,He BP,Dheen ST,et al.Interactions of chemokines and chemokine receptors mediate the migration of mesenchymal stem cells to the impaired site in the brain after hypoglossal nerve injury[J].Stem Cells,2004,22(3):415-427.
[19] Granero-Molto F,Weis JA,Miga MI,et al.Regenerative effects of transplanted mesenchymal stem cells in fracture healing[J].Stem Cells,2009,27(8):1887-1898.
[20] Wang X,Wang Y,Gou W,et al.Role of mesenchymal stem cells in bone regeneration and fracture repair:a review[J].Int Orthop,2013,37(12):2491-2498.
[21] Hogan C,Wilkins E.Neurological complications in HIV[J].Clin Med,2011,11(6):571-575.
[22] Schrepfer S,Deuse T,Reichenspurner H,et al.Stem cell transplantation:the lung barrier[J].Transplant Proc,2007,39(2):573-576.
[23] Kitaori T,Ito H,Schwarz EM,et al.Stromal cell-derived factor 1/CXCR4 signaling is critical for the recruitment of mesenchymal stem cells to the fracture site during skeletal repair in a mouse model[J].Arthritis Rheum,2009,60(3):813-823.
[24] 曹阳,吕刚,于洋,等.SDF-1/CXCR4促进骨髓基质细胞迁移的作用[J].辽宁医学院学报,2009,30(6):484-487.
