江西地区猪源致病性大肠杆菌的耐药性试验
2015-03-04矫薇薇徐国锋王宏栋张秀英东北农业大学动物医学学院黑龙江哈尔滨150030
矫薇薇,徐国锋,王宏栋,张秀英(东北农业大学动物医学学院,黑龙江哈尔滨150030)
江西地区猪源致病性大肠杆菌的耐药性试验
矫薇薇,徐国锋,王宏栋,张秀英
(东北农业大学动物医学学院,黑龙江哈尔滨150030)
摘要:对采自江苏周边地区规模化猪场的137株大肠杆菌耐药情况进行调查研究。通过分离纯化、生化鉴定以及致病性试验,得到67株致病性大肠杆菌。采用微量稀释法测定了8种药物对67株致病性大肠杆菌的最低抑菌浓度。结果显示,细菌对8种临床常用药物表现出较高的耐药性,多数细菌对5种药物耐药,甚至有些细菌对其中7种药物产生耐药性,其中细菌对头孢曲松、头孢曲松-舒巴坦和庆大霉素的耐药率最高,分别为100%、100%和97.01%。说明该地区采集的养殖场细菌耐药现象较为严重。
关键词:猪源;致病性大肠杆菌;血清型;多重耐药性
Corresponding author:ZHANG Xiu-ying
大肠杆菌主要存在于人和动物的肠道内,正常情况下为非致病性共栖菌,特殊条件下(如畜禽虚弱、免疫力降低或胃肠受损)具有致病性,会导致大肠杆菌病的发生。并引起患畜禽生长发育迟缓,生产能力低下,甚至造成死亡,给养殖业带来严重损失。
抗菌药物在有效遏制猪类各种大肠杆菌感染的同时,由于不合理使用和滥用也造成了大肠杆菌的严重耐药状况,耐药菌株增加,耐药机制趋于复杂。菌株耐药谱逐年变宽,甚至某些地区出现耐24种药物的菌株[1]。因而在临床用药中应以细菌耐药性调查作为科学依据,这样不仅能减少了耐药性的扩散,对公共卫生意义也很重大[2]。
江苏省为养猪大省,故本文在对采自江苏地区大肠杆菌病猪群的样本进行分离鉴定,获得致病性大肠杆菌的基础上,对这些大肠杆菌的耐药性进行分析,探讨该地区致病性大肠杆菌耐药性现状,目的是为临床用药提供参考。
1 材料
1.1菌株大肠杆菌标准菌株(ATCC25922),购自中国兽医药品监察所。大肠杆菌临床分离株:137株分离自江苏省周边地区规模化猪场患大肠杆菌病猪的肛门拭子及鼻腔黏液。
1.2药品庆大霉素(CN)、阿米卡星(AMK)、恩诺沙星(ENR)、环丙沙星(CIP)、多西环素(DOX)、头孢曲松(CRO)、舒巴坦(SCF)、氟苯尼考(FLO)。上述8种药物纯度均为98%。头孢曲松-舒巴坦联合用药,药物浓度比例为2∶1。
1.3主要试剂试验用麦康凯琼脂、水解酪蛋白琼脂(MH琼脂)、胰蛋白胨、酵母提取物等各种常规培养基以及葡萄糖等微量生化反应管(生产批号:20120315),均购自杭州天和微生物试剂有限公司。O抗原,购自中国兽医药品监察所。LB液体培养基配制参考文献[3]。
1.4实验动物试验用昆明系小鼠,购自中国农业科学院哈尔滨兽医研究所实验动物中心。
2 方法
2.1分离纯化将所采集的137株菌株加入肉汤培养基,37℃培养12~24 h,取少量菌液于麦康凯培养基画板,37℃培养24 h,挑取圆润粉红色菌落进行纯培养。
2.2镜检和生化鉴定取少量纯培养的菌液进行革兰染色,镜检,进行初步判断。并根据陆承平[4]的方法,采用生化反应管对分离株进行鉴定。
2.3致病性试验分离株摇床培养12 h,将培养液以生理盐水稀释至5×108CFU/mL,并以0.01 mL/g体重的接种量接种小鼠腹腔,每株菌株接种5只小鼠,观察小鼠发病时间及死亡情况,对分离株致病性进行判定。
2.4血清型试验参考宋立等[5]的O抗原鉴定方法,测定致病性大肠杆菌在O血清型中的分布。
2.5药敏试验取一定量的已灭菌的LB培养基,加入适量的菌液,37℃培养8~12 h。按照参考文献[5]的活力计数法调节菌液浓度至108CFU /mL。
取96孔板,每孔加入等量的已灭菌的水解蛋白琼脂(MH)培养基,将药物配制成512 μg/mL,加入96孔板中,再将药物进行倍比稀释,使其浓度分别为256 μg/mL、128 μg/mL、64 μg/mL、32 μg/ mL、16 μg/mL、8 μg/mL、4 μg/mL、2 μg/mL、1 μg/ mL、0.5 μg/mL和0.25 μg/mL。96孔板最后一列不加药物作为空白对照。分别在96孔板中加入等量的大肠杆菌。将该96孔板放入37℃培养12~18 h,观察结果并记录。其他的致病菌株均按上述操作进行。每个菌株针对每一种药物测试3次。每次试验前用标准菌株ATCC25922进行质控,药敏试验结果参照CLSI(2007)[6]判定标准进行。见表1。
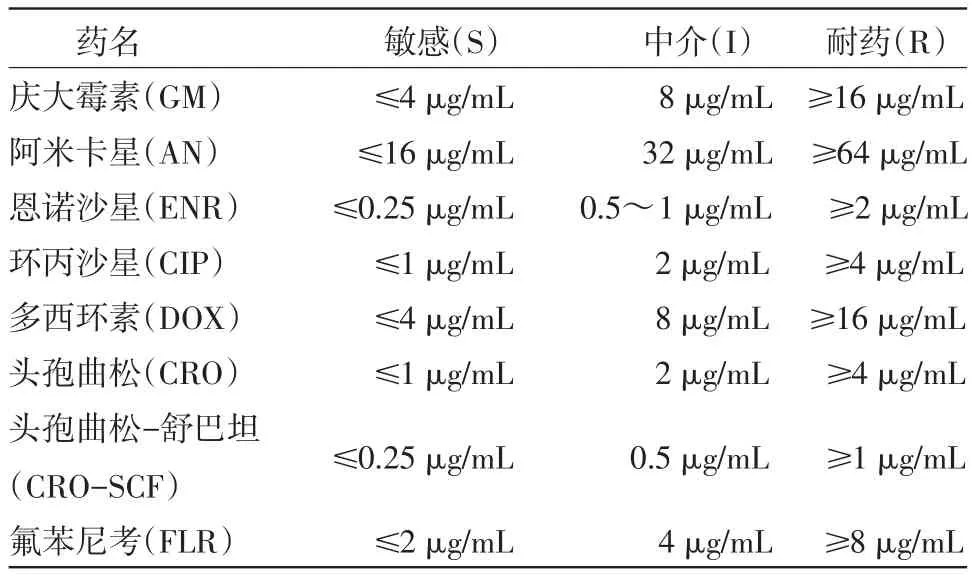
表1 药敏试验判定标准
3 结果与分析
3.1分离纯化及鉴定其中78株细菌在麦康凯培养基上呈粉红色菌落。显微镜下菌体呈两端钝圆,革兰染色为阴性。经过形态学以及生化特性检查鉴定[1]为埃希大肠杆菌。
3.2致病性试验结果对接种78株大肠杆菌培养物的小鼠进行观察,其中67株菌株在注射6 h内出现腹泻症状,在注射后36 h内全部死亡。
3.3血清型鉴定凝集试验显示,67株致病性大肠杆菌分离株中,其中能够确定血清型的菌株有63株,分别属于19个不同的血清型,包括血清型:O2,O4,O5,O6,O14,O26,O38,O42,O49,O57,O92,O93,O95,O101,O121,O131,O143,O158和O161,其中O4为主要流行的血清型。定型的血清型分布见图1。其余的菌株为混合血清型,主要的混合型见表2。

图1 定型的血清型分布

表2 混合血清型分布
3.4致病性大肠杆菌耐药性67株致病性大肠杆菌的MIC分布情况,见表3。

表3 致病性大肠杆菌MIC值
67株致病性大肠杆菌对庆大霉素、阿米卡星、头孢曲松、对头孢曲松-舒巴坦以及氟苯尼考耐药;对恩诺沙星处于中介状态;对环丙沙星以及多西环素敏感。对头孢曲松、头孢曲松-舒巴坦和庆大霉素高度耐药,耐药率分别达100%、100%和97.01%;其次为氟苯尼考。见表4。
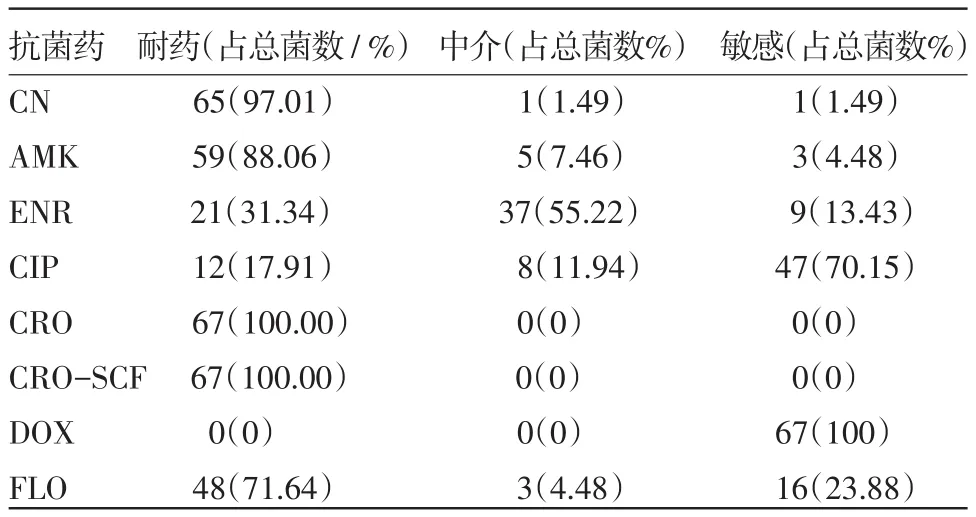
表4 猪源大肠杆菌对8种抗生素的体外药敏试验结果
3.5大肠杆菌的多重耐药性67株受试大肠杆菌对8种抗菌药物均表现为多重耐药。其中耐5种药物的细菌占的比例最大,为40.3%;其次为对4种药物耐菌株,所占比例为26.87%,最多耐7种抗菌药物,最少耐2种。耐药菌株的耐药谱数见图2。
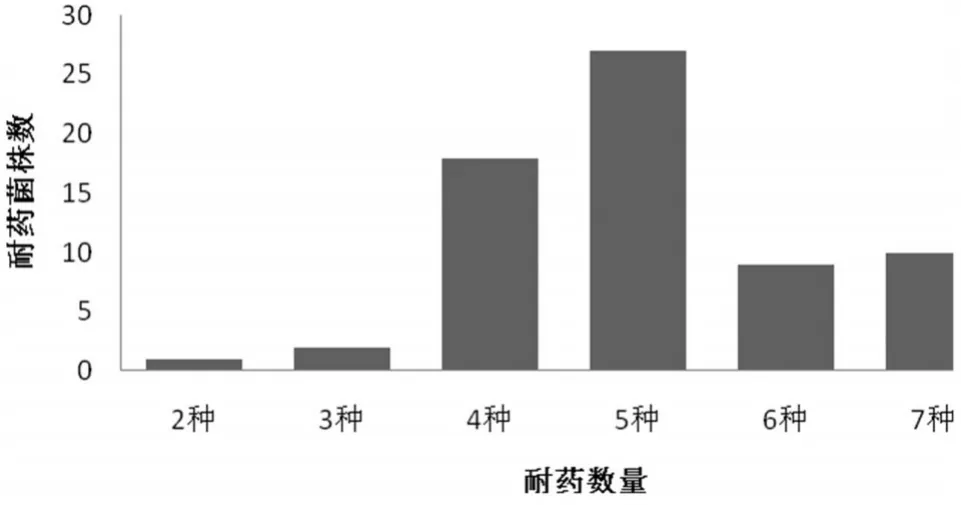
图2 耐药菌株的耐药谱数
4 分析
本试验对78株大肠杆菌进行了致病性试验,其中有67株表现出致病性。接种67株致病菌的小鼠发病时间均在6 h内,接种其余11株大肠杆菌的小鼠无明显发病症状。67株致病菌的血清型主要为O4,O49,O92和O101,均为国内主要流行的致病性血清型。
本试验进一步分析了从江苏周边地区规模化猪场分离的67株猪源致病性大肠杆菌对8种兽医临床常用的抗菌药物的敏感性。结果显示,猪源大肠杆菌分离菌株耐药水平不断提高,多重耐药现象严重。除对多西环素和环丙沙星敏感率较高外,对目前常用和应用时间较长的抗菌药物,产生了非常严重的耐药性;所有菌株均呈多重耐药,其中最少的耐药2种,最多的耐药7种。产生这种多重耐药现象的原因可能是:致病性大肠杆菌在药物的选择性压力下耐药基因发生突变,适用了环境压力而产生耐药性[7];临床上滥用抗生素,大肠杆菌可通过质粒、转座子、整合子等可移动元件获得耐药性[8]。另外,细菌对环丙沙星耐药率较低,敏感率较高,可为临床用药提供一定的指导作用。
5 讨论
大肠杆菌作为肠道常在菌,在条件变化及其他病原感染后易继发致病,并且其血清型众多、抗原复杂、容易形成耐药性,在实际生产中疫苗预防和药物防治效果不理想[9]。目前由于我国畜禽的大量药物的乱用导致大肠杆菌耐药性严重并且复杂,对大多数抗菌药物都已经产生了严重的耐药性。因此,定期对菌株进行抗生素敏感性的监测十分的必要。临床用药或在饲料中添加药物时,尽量不要长期大量使用同几种药物,以免影响临床治疗效果,同时可以采取联合用药的方式提高药效。研究发现[10-13],多重耐药菌株的大量出现,可能是菌体细胞膜通透性的改变与主动外排系统的超量表达共同作用的结果。因此,寻找有效的外输泵抑制剂是目前解决大肠杆菌多重耐药性产生的有效途径。
参考文献:
[1]陈雅莉.四川省食品动物源性大肠杆菌耐药性监测及整合子-基因盒检测[D].雅安:四川农业大学,2010.
[2]赖婧,刘洋,汪宇,等.800株不同动物源大肠杆菌的耐药性监测[J].中国兽医杂志,2011,47(4):12-14.
[3]颜颖,王海林.精编分子生物学实验南指[M].北京:北京科学出版社,1998.
[4]陆承平.兽医微生物学[M].北京:中国农业出版社,2007:215-223.
[5]宋立,宁宜宝,张秀英,等.中国不同地区家禽大肠杆菌血清型分布和耐药性比较研究[J].中国农业科学,2005,38(7):1466-1473.
[6] Clinical and Laboratory Standards Institute . Performance stan⁃dards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals[J] . Approved Standard-third Edi⁃tion,2005,M100-S15.
[7] Hongxia Jiang,Zhangliu Chen,Xiumei Wang,et al . High preva⁃lence and widespread distribution of multi-resistant Escherichia coli isolates in pigs and poultry in China[J] .The Veterinary Jour⁃nal,2011,187:99-103.
[8] Liming Lu,Lei Dai,Yang Wang,et al.Characterization of antimi⁃crobial resistance and integrons among Escherichia coli isolated from animal farms in Eastern China[J] . ActaTropica,2010,113:20-25.
[9]颜军,漆兴桂,马云,等.禽大肠杆菌病的流行特点[J].上海畜牧兽医通讯,2007,6:64-65.
[10] Su C,Long F,McDermott G,et al.Crystallization and preliminary X- ray diffraction analysis of the multidrug efflux transporter NorM from Neisseria gonorrhoeae[J].ActaCrystallogr Sect F Struct⁃BiolCrystCommun,2008,64:289-292.
[11] Hasdemir U . The role of cell wall organization and active efflux pump systems in multidrug resistance of bacteria[J] . Mikrobiyol Bul,2007,41(2):309-327.
[12] Stieger B,Meier Y,Meier P J . The bile salt export pump[J] . Pflugers Arch,2007,453(5):611-660.
[13]刁有祥,李久芹,陈庆普.山东省鸡大肠杆菌的分离鉴定[J].中国预防兽医学报,2002,24(1):21-23.
Research of Multidrug Resistencein pathogenic Escherichiacoli Isolates
JIAO Wei-wei,XU Guo-feng,WANG Hong-dong,ZHANG Xiu-ying (College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
Abstract:137 strains of Escherichia coli isolates from pigs in Jiangsu Province were studied.In the present study,67 strains of Escherichia coli in samples were isolated from invasive pigs.The resistance phenotypes to 8 antimicrobial agents were tested us⁃ing MIC.The result showed that all isolates had obvious resistance.Most of them were resistant to at least 5 antimicrobial agents,and some were resistant to 7 agents.The resistance rate to ceftriaxone,ceftriaxone-sulbactamh and gentamicin were 100%,100%,and 97.01%,respetively.These data suggested that the antimicrobial resistance is severe in this area.
Key words:Pigs;Pathogenic Escherichia coli;Serotype;Multidrug Resistence
通讯作者:张秀英,E-mail:zxy0451@hotmail.com
作者简介:矫薇薇(1988-),女,硕士生,研究方向为兽医药理学与毒理学,E-mail:172218958@qq.com
收稿日期:2014-05-15
中图分类号:S858.28
文献标志码:A
文章编号:0529- 6005(2015)10- 0077- 03
