雷公藤内酯醇诱导人脉络膜黑色素瘤株OCM-1凋亡的机制研究
2015-03-02李潮刘晓溪付海燕杜红阳
李潮,刘晓溪,付海燕,杜红阳
脉络膜黑色素瘤(choroidal melanoma,CM)是成人最常见的眼内恶性肿瘤之一,在全球的发病率占眼内恶性肿瘤的首位,在我国占第二位[1]。CM恶性程度高,转移早且广泛,如不经治疗,一般在出现症状后4~6个月内死亡。CM最常用的两种治疗方法是眼球摘除和放射性敷贴治疗[2],其中以手术切除为首选。但大多数患者确诊时已为中晚期,身体状况较差,故寻求高效的抗肿瘤药物是目前的研究热点。本研究探讨了雷公藤内酯醇(TPL)诱导人CM株OCM-1凋亡的机制。
1 材料与方法
1.1 主要材料、试剂及仪器 OCM-1(青岛大学医学院提供),胎牛血清(中国医学科学院血液学研究所),TPL(广州药业公司),碘化丙锭(PI)、核糖核酸酶(RNase)、RPM I 1640培养基(法国赛墨菲公司),四甲基偶氮唑蓝(MTT)、辣根过氧化物酶标记的羊抗兔二抗(碧云天生物技术研究所),兔抗人caspase-3、β-actin、survivin、Bcl-2及Bax抗体(北京博奥森有限公司),S-II倒置显微镜(日本O lympus公司),流式细胞仪(FACScalibur,美国BD公司)。
1.2 方法
1.2.1 MTT法检测TPL对OCM-1细胞增殖的影响
将TPL用二甲基亚砜(DMSO)配制成10mmol/L储存液,DMSO终浓度<0.01%(V/V),–20℃贮存,实验前用PBS稀释。收集对数生长期OCM-1细胞,置于10%胎牛血清中,调整细胞浓度为4×104个/m l,每孔180μl,接种于96孔细胞培养板,于37℃、5%CO2、饱和湿度培养箱中培养。细胞分为对照组和实验组。实验组于培养24h后加入20μl不同浓度的TPL,使其终浓度分别为5、10、20、40、80、160nmol/L,对照组加入等量的无血清RPM I 1640培养液,每组3个复孔,分别作用24、48、72h。每孔加入20μl MTT(5mg/m l)作用4h,弃上清,加入150μl DMSO,振荡溶解结晶后,以空白对照校正零点,在酶标仪上测定不同浓度各孔在490nm波长处的吸光度(A)值,计算细胞增殖抑制率。增殖抑制率(%)=1–(实验组A值-空白对照A值)/(对照组A值-空白对照A值)×100%。分别计算不同浓度TPL对OCM-1细胞的半数抑制浓度(IC50),并绘制相应的增殖抑制曲线。
1.2.2 瑞氏-吉姆萨染色观察细胞形态 取80nmol/L TPL作用OCM-1细胞48h,胰酶消化并收集细胞,1000r/m in离心3m in,制成细胞涂片,用瑞氏-吉姆萨染液染色,光学显微镜下观察细胞形态学变化。
1.2.3 流式细胞仪检测TPL诱导的OCM-1细胞凋亡
取20、40、80nmol/L TPL作用OCM-1细胞72h,5%胰酶消化后收集细胞,1000g/m in离心5m in,弃上清,冷PBS洗涤,加入70%冷乙醇4℃过夜,冷PBS洗涤,再次离心,加入10μg/m l RNase,37℃孵育30min,加入终浓度10μg/m l PI,轻轻混匀,避光反应30min后,应用流式细胞仪检测凋亡细胞百分率。
1.2.4 Western blotting检测OCM-1细胞凋亡相关蛋白的表达 分别采用20、40、80nmol/L TPL诱导OCM-1细胞,24h后以RIPA裂解细胞,采用Low ry法进行蛋白定量。将蛋白样品在凝胶中电泳,电转至PVDF膜上,5%奶粉封闭后,分别加入Bax抗体(1:300)、survivin抗体(1:300)、Bcl-2抗体(1:300)、caspase-3抗体(1:1000)及β-actin抗体(1:5000),过夜;TBST洗3次,加入辣根过氧化物酶标记的二抗(1:3000)作用90m in。ECL法显色,GIS凝胶图像系统分析数据,以对照组蛋白表达量为1,计算OCM-1细胞Bax、Bcl-2、survivin、caspase-3蛋白的表达量。实验重复3次。
1.3 统计学处理 采用SPSS 13.0软件进行统计学分析,计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 TPL对OCM-1细胞增殖的影响 MTT结果显示,TPL可抑制OCM-1细胞增殖,且呈时间剂量依赖关系(图1)。OCM-1细胞经TPL作用24、48、72h的IC50值分别为98.52、56.14、15.57nmol/L。
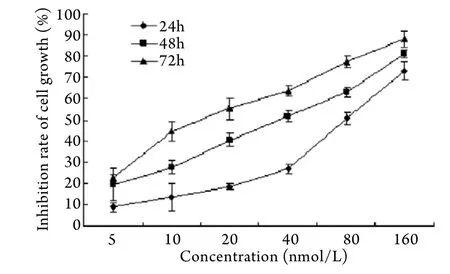
图1 OCM-1细胞增殖曲线Fig.1 Proliferation curve of OCM-1 cells
2.2 瑞氏-吉姆萨染色观察OCM-1细胞凋亡 在倒置显微镜下OCM-1细胞呈现梭形、多角形等多种形态,核可为双核或多核,呈圆形或椭圆形。随TPL浓度增加及作用时间延长,细胞增殖逐渐受到抑制,细胞逐渐变圆,脱壁,接触松散,胞质中颗粒增大,细胞周围出现碎片,部分细胞死亡后悬浮在培养液中,而空白对照组细胞贴壁生长,轮廓清楚,胞质中无异常颗粒出现,增殖旺盛。80nmol/L TPL作用于OCM-1细胞48h后,瑞氏-吉姆萨染色光镜观察可见典型细胞核碎裂现象(图2)。
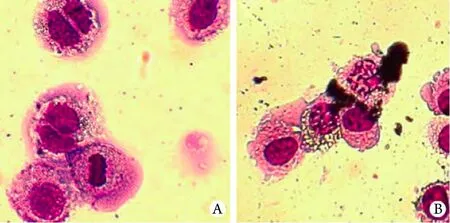
图2 TPL对OCM-1细胞凋亡的影响(瑞氏-吉姆萨染色×200)Fig.2 OCM-1 cells apoptosis by TPL treatment (Wright-Giemsa's staining ×200)A. Control group;B. 80nmol/L TPL group
2.3 流式细胞术检测OCM-1细胞凋亡率 检测结果显示,随TPL浓度增加,sub-G1百分比由对照组的0.46%±0.23%分别增至2.59%±3.79%(20nmol/L TPL)、18.43%±2.63%(40nm o l/L TPL)及24.62%±5.71%(80nmol/L TPL),与对照组比较差异有统计学意义(P<0.01,图3)。
2.4 Western blotting检测OCM-1细胞凋亡相关蛋白表达 经20、40、80nmol/L TPL诱导后,OCM-1细胞Bc l-2蛋白表达量分别为89.32%±6.51%、68.30%±5.19%、57.23%±1.61%,survivin蛋白表达量分别为81.73%±3.67%、69.31%±2.28%、4 9.8 0%±6.1 1%,Ba x蛋白表达量分别为56.61%±4.21%、78.35±7.38%、87.21%±3.62%,与对照组比较差异均有统计学意义(P<0.01)。20nmol/L TPL作用OCM-1细胞未检测到caspase-3蛋白活化,40nmol/L及80nmol/L作用后检测到大小17kD的活性亚基(图4)。
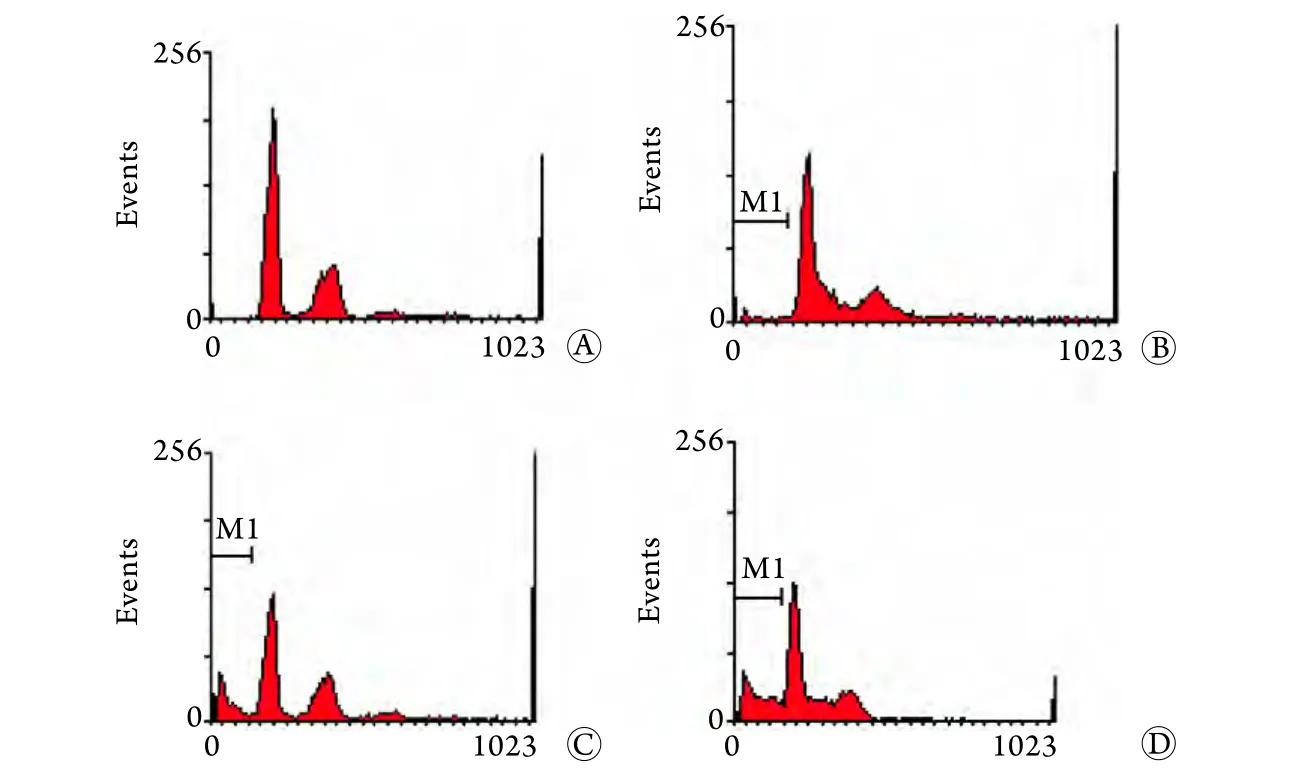
图3 流式细胞术检测OCM-1细胞凋亡率Fig.3 The apoptosis rate of OCM-1 cells (FCM)A. Control group; B. 20nmol/L TPL group; C. 40nmol/L TPL group; D. 80nmol/L TPL group
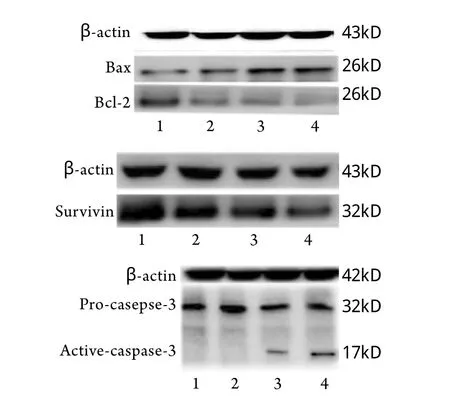
图4 Western blotting检测OCM-1细胞凋亡相关蛋白表达Fig.4 Expression of apoptosis related protein in OCM-1cells(Western blotting)Bax/Bcl-2; B. Survivin; C. caspase-3; 1. Contro l group; 2.20nmol/L TPL; 3. 40nmol/L TPL; 4. 80nmol/L TPL
3 讨 论
TPL是雷公藤的主要有效成分之一,其相关效价比雷公藤总甙高100~200倍,临床上已广泛应用于自身免疫性疾病的治疗[3]。近来研究发现TPL具有广泛且高效的抗肿瘤作用,对人白血病、淋巴瘤等60多种肿瘤细胞均具有很好的抑制作用[4-7]。TPL对黑色素瘤细胞同样具有抑制作用,但有关TPL对CM的作用仍需进一步研究。
Bcl-2蛋白家族以Bcl-2和Bax为代表,该家族成员可通过线粒体内外膜上的蛋白间接或直接影响线粒体途径凋亡的发生[8]。当细胞受到凋亡因子的诱导时,Bcl-2家族蛋白发生转位,调节线粒体中促凋亡因子的释放。相关研究表明,Bax/Bcl-2比值决定了细胞对凋亡信号的反应[9-10]。本研究中,不同浓度TPL作用于人CM株OCM-1 24h,可使Bax蛋白表达上调,Bcl-2蛋白表达下调,表明TPL诱导人CM细胞株OCM-1凋亡可能与调节Bax及Bcl-2的表达水平有关。Survivin是凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)家族的抗凋亡蛋白,在人CM细胞株OCM-1中表达率较高,与人CM的发生、进展以及原发性、继发性耐药的产生存在直接关联[11]。Survivin可抑制caspases级联激活,抑制细胞凋亡,其中对caspase-3的活化抑制最为重要。本研究发现,TPL可使OCM-1细胞survivin蛋白表达水平下调,且呈浓度依赖性关系。
细胞凋亡主要通过死亡受体途径和线粒体途径,caspases家族为最终执行者,在细胞凋亡过程中通过对骨架蛋白的剪切,引起细胞核固缩、碎裂等复杂的形态学变化,其中caspase-3是以上两种途径的共同交汇点,是caspase级联反应中的终末执行分子[12-13]。研究证实,caspase-3的活性表达与细胞凋亡途径关系密切[14]。本研究中20nmol/L TPL作用于OCM-1细胞后,检测到的caspase-3为非活化状态,但浓度升高至40nmol/L及80nmol/L时则可检测到caspase-3的活性亚基,且随着浓度升高,caspase-3活化增强,提示caspase-3可能参与了TPL诱导OCM-1细胞凋亡。caspase-3的活化受多方面因素的调控,本研究结果表明,TPL在诱导OCM-1细胞凋亡的过程中通过调节Bax与Bcl-2蛋白的表达水平,影响线粒体内细胞色素C、Smac/DIABLO、survivin等凋亡蛋白及凋亡抑制蛋白的释放,其中凋亡抑制蛋白survivin表达下调,促进凋亡发生,导致caspase-3活化,促使凋亡相关事件的发生,从而间接证实了TPL在诱导OCM-1凋亡中的作用可能是通过线粒体凋亡途径所引发。
总之,凋亡途径异常复杂,凋亡与否取决于促凋亡蛋白及相关凋亡蛋白的动态平衡。本实验结果证实TPL可通过调节凋亡蛋白与促凋亡蛋白的表达而诱导OCM-1细胞凋亡,为进一步开展相关实验提供了理论基础。
[1] Zhao GQ. Ophthalmology subjects[M]. Beijing: Peop le's Medical Publishing House, 2006. 318-319. [赵桂秋主译. 眼科学总论[M]. 北京:人民卫生出版社, 2006. 318-319.]
[2] Finger PT, Zhou D, Kalach N,et al. 103Pd versus 125I ophthalm ic plaque brachytherapy: preoperative comparative radiation dosimetry for 319 uveal melanomas[J]. J Radiat Oncol,2014, 3(4): 409-416.
[3] Zhou HY, Li BM, Yin P,et al. Effect of triptolide on protection of neurons in the hippocampus of epileptic rats induced by lithium chloride-pilocarpine[J]. J Shandong Univ (Health Sci), 2012,50(5): 20-24, 31. [周海燕, 李保敏, 尹苹, 等. 雷公藤内酯醇对匹罗卡品致痫大鼠海马神经元的保护性研究[J]. 山东大学学报(医学版), 2012, 50(5): 20-24, 31.]
[4] Shi JR, Zhao JX, Zhang H,et al. Effect of triptolide on the proliferation and apoptosis of gallbladder carcinoma cell line GBC-SDin vitro[J]. Med J Chin PLA, 2010, 35(12): 1462-1464.[史继荣, 赵建勋, 张寰, 等. 雷公藤内酯醇对胆囊癌GBCSD细胞株增殖与凋亡的影响[J]. 解放军医学杂志, 2010,35(12): 1462-1464.]
[5] Liu L, Jiang Z, Liu J,et al. Sex differences in subacute toxicity and hepatic m icrosomal metabo lism of triptolide in rats[J].Toxicology, 2010, 271(1-2): 57-63.
[6] Liang X, Zhou H, Liu X,et al. Effect of local hypertherm ia on lym phangiogenic factors VEGF-C and -D in a nude m ouse xenograft model of tongue squamous cell carcinoma[J]. O ral Oncol, 2010, 46(2): 111-115.
[7] Ning WX, Zhou Y, Gu JH,et al. Effects of triptolide on human cervical cancer CaSki cells: anin vitrostudy[J]. Med J Chin PLA, 2011, 36(3): 225-227. [宁维翾, 周英, 顾江红, 等. 雷公藤内酯醇对人宫颈癌 CaSki细胞株的体外作用研究[J]. 解放军医学杂志, 2011, 36(3): 225-227.]
[8] Fang M, Wang XD. M itochondrial apop tosis pathway[J]. J Peking Univ (Health Sci), 2002, 34(1):1-10. [方敏, 王晓东.细胞凋亡的线粒体通路[J]. 北京大学学报(医学版), 2002,34(1): 1-10.]
[9] Takahashi M, Elbarbary RA, Nakashima A,et al. A naked RNA heptamer targeting the human Bcl-2 mRNA induces apoptosis of HL60 leukem ia cells[J]. Cancer Lett, 2013, 328(2): 362-368.
[10] Zhang W, Ju J. Odontob last-targeted Bcl-2 overexpression p romotes dentine damage repair[J]. Arch O ral Bio l, 2012,57(3): 285-292.
[11] Ku JH, Seo SY, Kwak C,et al. The role of survivin and Bcl-2 in zinc-induced apoptosis in prostate cancer cells[J]. Urol Oncol,2012, 30(5): 562-568.
[12] Wang HL, Li Y, Tian J,et al. Effects of exhaustive exercise on renal tubular apoptosis and HIF-1α expression in rats and result of total ginsenoside intervention[J]. Med J Chin PLA, 2014,39(2): 161-166. [王会玲, 李燕, 田军, 等. 力竭运动对大鼠肾小管凋亡和缺氧诱导因子-1α表达的影响及人参总皂苷干预研究[J]. 解放军医学杂志, 2014, 39(2): 161-166.]
[13] Yu GY, Song XF, Zhao SH,et al. Induction effect of benzene on apoptosis of mouse bone marrow cells through m itochondrialdependent apoptosis pathway and its mechanism[J]. J Jilin Univ(Med Ed), 2014, 40(5): 943-946, 1128. [于光艳, 宋祥福, 赵淑华, 等. 苯通过激活线粒体凋亡通路对小鼠骨髓细胞凋亡的诱导作用及其机制[J]. 吉林大学学报(医学版), 2014, 40(5):943-946, 1128.]
[14] Rubio N, Garcia-Segura LM, Arevalo MA. Survivin prevents apoptosis by binding to caspase-3 in astrocytes infected with the BeAn strain of Theiler's murine encephalomyelitis virus[J]. J Neurovirol, 2012, 18(5): 354-363.
