miRNA-200a调控缺血缺氧后新生大鼠海马神经干细胞的增殖*
2015-03-02骆健明欧楚耿庄泽锐
骆健明 欧楚耿 庄泽锐 陈 彬 刘 斌
(汕头大学医学院第二附属医院神经外科,广东 汕头 515031)
miRNA-200a调控缺血缺氧后新生大鼠海马神经干细胞的增殖*
骆健明欧楚耿庄泽锐陈彬刘斌
(汕头大学医学院第二附属医院神经外科,广东 汕头515031)
摘要:目的研究miRNA-200a对缺血缺氧后新生大鼠海马神经干细胞增殖的调控作用。方法建立新生7天SD大鼠缺血缺氧性脑病(HIE)模型,利用免疫组化方法检测缺血缺氧后新生大鼠海马CA1区内源性神经干细胞的增殖情况;利用real-time PCR技术同步检测miRNA-200a 的表达;分析miRNA-200a与缺血缺氧诱导的内源性神经干细胞增殖之间的关系;结果模型动物大脑行HE染色提示颈动脉结扎侧枕顶叶皮层和海马的CA1、CA3区存在明显坏死区域,提示模型动物建立成功。免疫组化结果显示Brdu阳性的神经干细胞分布于脑内各个区域,缺血缺氧组海马CA1区阳性细胞数比正常组明显增多。real-time PCR结果提示缺血缺氧组大鼠海马miRNA-200a的表达量比正常组明显增高。结论miRNA-200a能促进缺血缺氧后新生大鼠海马神经干细胞的增殖。
关键词:缺血缺氧性脑病;神经干细胞;miRNA
以往的研究表明缺血缺氧能促进新生动物脑内神经干细胞的增殖、分化,但具体调控机制尚未明确。近年来许多研究显示,miRNA在调控胚胎和成体NSCS增殖分化过程中起非常重要的作用[1]。有研究表明缺氧能促进动物脑内miRNA-200a的表达[2],而miRNA-200a是否可影响缺血缺氧后内源性神经干细胞的发育目前还未见报道。本研究对miRNA-200a和缺血缺氧后神经干细胞增殖之间的关系进行分析。
1材料与方法
1.1实验动物
健康新生7天SD大鼠共20只,体重(12~14 g),雌雄不拘。
1.2实验方法
1.2.1 动物分组
随机分为缺血缺氧组10只、正常对照组10只。缺血缺氧组实施颈总动脉结扎及缺氧处理。正常对照组动物不作缺血缺氧处理。
1.2.2 缺血缺氧动物模型制作过程
采用改良的HIE建模方法:7天龄SD乳鼠分离并结扎左颈总动脉,充以浓度为8%氧+92%氮的混合气体,气流量1L/ min,缺氧处理2h。模型建立后回笼母鼠喂养。
1.2.3Brdu用于标记新生的神经干细胞
Brdu溶于消毒生理盐水,浓度为10 mg/ml,所有实验动物每天腹腔注射Brdu两次,间隔8h,每次50 mg/kg。给药到取材当天结束。
1.2.4免疫组化方法检测内源性神经干细胞的增殖。
脑组织切片标本按免疫组化常规程序处理(一抗为小鼠抗Brdu,二抗为山羊抗小鼠),显微镜下观察Brdu阳性细胞的大小形态及分布特点。
1.3real-time PCR 检测miRNA-200a的表达水平
1.3.1标本准备:各时间点处死大鼠,500 ml 无菌生理盐水心脏灌注后游离出完整海马组织,-20 ℃下放置30 min 后,用去RNA 酶处理的刀片切取各组海马区组织约100 mg,存于去RNA酶的EP管中,于-80 °C冰箱保存备用。
1.3.2采用trizol 试剂盒(Invitrogen)按步骤提取海马miRNA,RNA 逆转录获得cDNA(根据Promega 公司M-MLV 操作说明书进行),两步法进行Real-Time PCR,并制作熔解曲线,U6 为内参。反应条件:95℃,10min;95℃,10s,60℃, 1min,共45个循环。计算各组样品原始Ct值、采用2-ΔΔCt法进行数据分析。
1.4统计学方法
2结果
2.1模型鼠脑部HE染色结果
模型动物脑部可见明显坏死,病变主要集中在左侧枕顶叶皮层和海马的CA1、CA3区。表现为病变局部细胞数目稀少,体积缩小, 细胞间质结构模糊或消失,嗜伊红染色变淡,坏死细胞核固缩、裂解。
2.2免疫组化结果显示Brdu阳性细胞胞核呈棕褐色深染,胞核较小、多为实性,呈小圆形、梭形或杆状。正常组动物脑内见阳性细胞弥散分布于各脑区:大脑皮层、侧脑室周围的室管膜下层(SVZ)、海马、胼胝体、尾状核、内囊、侧脑室脉络丛和第三脑室脉络丛等可见阳性细胞。在海马的齿状回、脑室下区等部位有Brdu阳性细胞密集分布。皮层阳性细胞分布较稀疏、弥散。
缺血缺氧组动物免疫组化结果显示左侧海马CA1区(图1)Brdu阳性细胞呈灶状增生,细胞数目比正常组的相同部位明显增多,P<0.05。
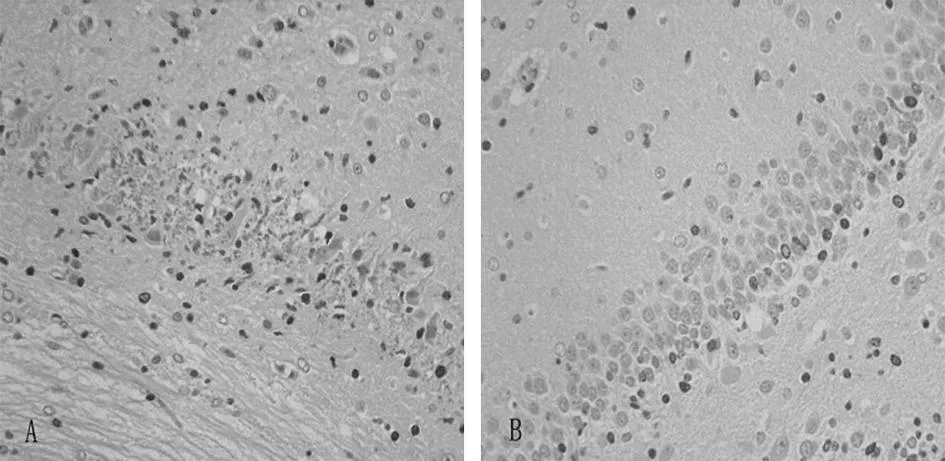
图1A.缺血缺氧组动物免疫组化结果显示左侧海马CA1区Brdu阳性细胞呈灶状增生,阳性细胞数目明显比正常组多.B.正常组动物免疫组化结果显示左侧海马CA1区Brdu阳性细胞呈散在分布。
2.3Real-Time PCR结果提示,目的基因扩增曲线良好,溶解曲线单峰,无非特异性扩增产物和引物二聚体等因素干扰实验结果。缺血缺氧后,miR-200a的表达量比正常大鼠明显增高,差异有统计学意义,P<0.01。

图2缺血缺氧组动物免疫组化结果显示左侧海马CA1区Brdu阳性细胞数目比正常组的相同部位明显增多,P<0.05。

图3Real-Time PCR结果显示,缺血缺氧组miRNA-200a的表达量比正常组大鼠明显增高,差异有统计学意义,P<0.01。
3讨论
新生儿缺血缺氧性脑病(hypoxic-ischemic encephalopathy ,HIE) 可损伤中枢神经系统多个部位,皮质损伤最为多见,其他如基底节、丘脑、白质、海马等均可受累,其病理变化最终将导致中枢神经元的变性、坏死,以及直接或间接造成神经系统内环境的紊乱[3]。神经干细胞(neural stem cells,NSCs)具有自我更新能力,能分化成神经元和/或神经胶质细胞。以往的实验研究已经证实,缺氧能调节神经干细胞的增殖、分化[4],新生大鼠遭受缺血缺氧损害后,脑室下区、海马齿状回及受损伤大脑皮质周围等部位有内源性NSCs的增殖、分化[5],并且可分化成星形胶质细胞和神经元,参与脑组织损伤后的修复。但对于这种由缺血缺氧诱导的NSCs增殖、分化的具体调控机制,目前尚知之甚少。
microRNA(miRNA)是一类内源性非编码单链RNA分子,几乎参与了所有的生物学调控过程。研究显示,miRNA在调控神经干细胞的增殖、分化过程中起非常重要的作用[6]。miRNA-200家族成员包括miRNA-200a、miRNA-200b、miRNA-200c、miRNA-141及miRNA-429[7]。miRNA-200家族参与肿瘤的发生及演变的调节,同时也能调控干细胞的增殖分化,虽然这类证据目前还为数较少。有研究表明miRNA-200家族功能的缺失可导致嗅球神经前体细胞分化能力的缺陷[8]。另一方面,缺氧能促进miRNA-200 的表达增加,调控缺氧诱导因子1(HIF-1α)水平。而HIF-1α直接参与缺氧调节过程,在缺氧后细胞凋亡、血管再生、线粒体代谢等多个方面发挥作用,说明miRNA-200是重要的缺氧调节因子,参与缺氧后肌体的修复过程。
本研究结果发现,缺血缺氧后新生大鼠海马区miRNA-200a的表达量比正常组明显升高,神经干细胞的数目比正常组增多,提示缺血缺氧后miRNA-200a能促进神经干细胞的增殖,表明缺血缺氧后神经干细胞的增殖分化受miRNA-200的调控。目前尚无关于miRNA-200调控缺血缺氧后神经干细胞增殖、分化的文献报道,因此,miRNA-200a作为缺血缺氧诱导神经干细胞增殖、分化的调控因子,为新生儿缺血缺氧性脑病的干细胞治疗提供了新的思路。
参考文献:
[1]杨艳红,白文涛,张亮,等.小鼠着床前胚胎miRNA表达的实验研究[J].生殖医学杂志,2008,17(2):123-129.
[2]Cheng LC, Tavazoie M, Doetsch F. Stem cells: from epigenetics to microRNAs[J]. Neuron,2005,46(3):363-7.
[3]贾飞勇,郝云鹏,姜慧轶,等.组胺H3受体拮抗剂对缺血缺氧性脑病新生大鼠神经保护作用及其机制研究[J].中国实验诊断学,2011,15(6):954-956.
[4]祁存芳,张军峰,陈新林,等.缺氧对成年大鼠SVZ组织分离培养神经干细胞的影响[J].西安交通大学学报(医学版),2013,34(6):758-763,772.
[5]Ming GL, Song H.Adult neurogenesis in the mammalian brain: significant answers and significant questions. Neuron,2011,70(4):687-702.
[6]郝宁,吕广明.miRNA在中枢神经系统功能与疾病中的作用研究进展[J].神经解剖学杂志,2014,30(6):715-719.
[7]常靓.miRNA-200家族在人类肿瘤中的研究进展[J].肿瘤防治研究,2012,39(4):474-476.
[8]Philip S. Choi, Lisa Zakhary, Wen-Yee Choi, et al.Members of the miRNA-200 Family Regulate Olfactory Neurogenesis.Neuron,2008,57(l):41-55.
miRNA-200a regulation after ischemia hypoxia with the newborn rat hippocampal neural stem cell proliferation
LUOJian-mingOUChu-gengZHUANGZe-ruiCHENShanLIUBin
(Shantou university medical college second affiliated hospital,Shantou 515031,China)
Abstract:Objective: To study the miRNA-200a of newborn rat hippocampal neural stem cells after ischemia anoxic proliferation regulation function. Methods: to establish a newborn SD rats 7 days of hypoxic ischemia encephalopathy (HIE) model, by using immunohistochemical method to detect ischemia hypoxia newborn rat hippocampal CA1 region after the proliferation of endogenous neural stem cells; Using real - time PCR technology synchronous detection of micrornas -200a expression; Analysis the miRNA - 200 - a induced by ischemia and hypoxia of the relationship between endogenous neural stem cell proliferation, Results: the model of the animal's brain line HE dyeing prompt carotid artery ligation side pillow parietal cortex and hippocampus CA1, CA3 area exists obvious necrosis area, suggests to establish animal models with success. Immunohistochemical results show that the Brdu positive neural stem cells in the brain regions, ischemia hypoxia group of hippocampal CA1 area of positive cells was increased significantly than the normal group. Real - time PCR results suggest ischemia hypoxia group rats hippocampal micrornas-200a expression quantity is significantly higher than the normal group. Conclusion: the miRNA -200a can promote the blood anoxic after newborn rat hippocampal neural stem cell proliferation.
Key words:ischemia anoxic encephalopathy; neural stem cells; micrornas
(收稿日期2015-9-8)
doi:10.3969/j.issn.1004-7115.2015.12.002
中图分类号:R651
文献标识码:A
文章编号:1004-7115(2015)12-1324-03
作者简介:骆健明(1978—),男,广东河源人,副主任医师,博士,主要从事临床神经外科工作。
基金项目:广东省医学科研基金(编号:A2013404)。
