循环肿瘤细胞检测在不同转移灶晚期乳腺癌中的应用研究
2015-03-02解继平赵子伟姚永强
解继平,张 岷,方 红,赵子伟,万 毅,姚永强
(大连大学附属中山医院 乳腺甲状腺外科,辽宁 大连116000)
据统计,乳腺癌是女性最常见的恶性肿瘤,全球范围内乳腺癌患者的发生率和死亡数量逐年升高[1]。乳腺癌远处复发、转移,是该病最主要的致死原因,恶性肿瘤细胞进入血液循环,并在远处器官组织粘附、定植、形成微转移灶是其中的关键环节[2]。
循环肿瘤细胞(circulating tumor cell,CTC)检测技术是一种新兴的恶性肿瘤检查方法,通过采取患者的外周血便可实现对血液循环中由病变部位脱落的恶性肿瘤细胞进行筛查、计数。在临床上,目前CTC 检测主要应用于预后评价、疗效评估、病理活检及指导个体化治疗。
作为当前的研究热点,越来越多的研究报道了CTC 与乳腺癌不同分期、分型、发病年龄、免疫组化特点的相关性[3],但不同转移灶晚期乳腺癌患者CTC 检测结果的差异鲜有相关报道。本研究通过分析CTC 在不同转移灶晚期乳腺癌患者中的检出率及阳性率,评价不同复发部位乳腺癌对CTC 检测的敏感性。
1 资料与方法
1.1 一般资料
1.1.1 病例及分组:收集119 例2014年9月至2015年4月于大连大学附属中山医院住院的复发转移晚期乳腺癌患者的临床资料,年龄49 ~70 岁(中位年龄59.5 岁),女性。入组患者均曾接受手术治疗及术后辅助化疗(AC -T 或者TC 方案),术后复发时间4 ~11年,平均7.8年,经影像学检查或组织细胞学病理明确有且仅有单器官(肝、骨、肺)转移灶,分别记为肺转移组、肝转移组及骨转移组。其中肝转移组31 例,肺转移组40 例,骨转移组48例。
1.1.2 仪器与器材:cellsearch 系统(强生公司;该系统已通过美国FDA 批准,是目前国际认可的应用于乳腺癌循环肿瘤细胞检测的有效方法),本院中心实验室提供;cellsave 储存管(北京佰乐良成科技有限公司);细胞分选免疫磁珠(天津灏洋生物制品有限公司),鼠抗人细胞角蛋白单克隆抗体(美国CST 公司)。
1.1.3 标本采集:所有确诊复发转移的患者均于接受治疗前空腹抽取外周血7.5 mL 置于cellsave 储存管并立刻送检。
1.2 循环肿瘤细胞检测方法
7.5 mL 血样中加6.5 mL 缓冲液稀释,4000 r/min 离心20 min。吸出上清液,加入可与上皮细胞特异性结合的免疫磁珠,接入磁场进行磁孵育15 min,吸出液体和未结合的磁珠颗粒,加入鼠抗人细胞角蛋白单克隆抗体进行染色标记。将所得的染色细胞放入MagNet 样本盒中进行捕获,最后人工完成CTC细胞的判读、计数。
CTC 判读标准:对富集的细胞进行染色处理,空白对照组作为阴性的比色标准,白细胞抗原CD45荧光抗体用于排除白细胞的干扰,检出CD45 阴性且肿瘤特异性细胞核抗原DAPI、细胞质抗原CK 均为阳性的细胞,判定为CTC[4]。
1.3 结果判断标准
以7.5 mL 血中检测出的CTC 个数为单位,分别定为未检出(CTC 0 个),检出(CTC≥1 个)和阳性(CTC≥5 个)[4],并以此计算CTC 的检出率及阳性率。
1.4 统计学方法
应用SPSS17.0 分析软件进行统计学处理,临床资料的描述采用百分比,频数资料组间分析采用χ2检验,取P <0.05 为差异有统计学意义。
2 结 果
2.1 CTC 荧光图像
根据前文所述的判读标准,转移患者血清细胞中,CD45 阴性,DAPI 与CK 均为阳性,且两者整合后荧光染色区域示细胞形态完整的,即为CTC。见图1。
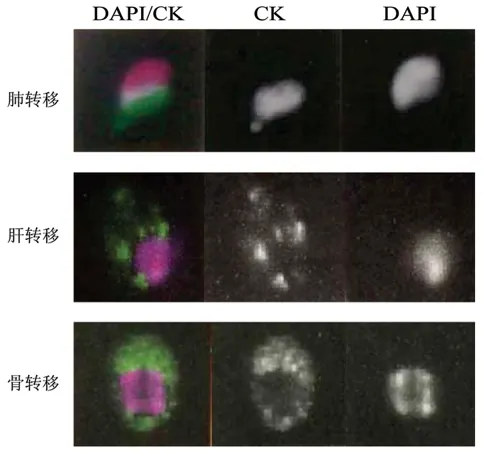
图1 不同转移部乳腺癌位患者血清CTC 荧光图片Fig 1 CTC fluorescence images of advanced breast cancer patients with different metastases
2.2 CTC 检出率
不同转移部位乳腺癌患者与CTC 检出率的相关性不同,肝转移组外周血中35.5%(11/31)可检出循环肿瘤细胞,肺转移组外周血中47.5%(19/40)可检出循环肿瘤细胞,骨转移组为68.8%(33/48),骨转移组明显高于肺及肝转移组(P <0.05)。肝转移组与肺转移组比较差异无显著性意义(P >0.05)。见表1。
2.3 CTC 阳性率
不同组别的CTC 阳性率不同,其中肝转移组外周血中循环肿瘤细胞阳性率为32.3%(10/31),肺转移组为12. 5%(5/40),骨转移组为12. 5% (6/48)。其中肝转移组的阳性率最高,与肺及骨转移组比较有明显差异(P <0.05)。骨转移组与肺转移组间比较差异无显著性意义(P >0.05)。见表1。

表1 乳腺癌不同转移部位患者的CTC 检出率及阳性率Tab 1 CTC detection in patients of advanced breast cancer with different metastases n(%)
3 讨 论
目前临床上针对不同乳腺癌患者制定的一系列包括手术,辅助化疗,放射治疗,基因靶向,内分泌治疗在内的综合及个体化治疗方案[5],使乳腺癌成为发病率虽高,但预后相对较好的恶性肿瘤。乳腺癌复发转移是影响其预后最重要的因素。根据肿瘤的病理分型,分期,淋巴结转移情况,免疫组化特点等,可对其远期复发转移风险做大体的评估[6],但缺少对患者病情的实时监测。通过定期随诊,做肿瘤标记物检测及影像学检查,可了解患者的病情进展,但很难早期发现微小转移灶且对长期预后没有预测作用。循环肿瘤细胞(CTC)检测克服了以上传统诊疗方法的不足。检测外周血液中的恶性肿瘤细胞,不但可实时把握患者循环系统中隐藏的癌负荷,早期推测其肿瘤存在血行转移的可能性[7],还能通过血液中CTC 的计数,对患者的远期预后进行评价。2004年由Cristofanilli 等[8]进行的多中心、前瞻性研究表明,在晚期乳腺癌患者中,每7.5 mL 血CTC≥5个的患者无进展生存期(Progression -free survival,PFS)及总生存期(overall survival,OS)均明显短于CTC <5 个的患者。此研究结果目前已成为共识,临床上把晚期复发转移乳腺癌患者的CTC 检测结果≥5 个定为阳性,提示患者预后相对较差。此外,根据比较治疗前后患者CTC 变化,可对此种治疗方法的疗效进行评价[9]。
本研究在前期预实验中,共选取20 例经术后病理确诊为乳腺纤维腺瘤的患者进行CTC 检测,仅在1 例患者的血液标本中检出了1 个CTC,检出率5%,阳性率0%,符合国内外文献报道的正常人CTC 检测结果[10],可排除因检测技术水平导致假检出率、假阳性率所致的结果偏移。
分析本研究结果可知,在不同转移灶晚期乳腺癌患者中,骨转移患者的CTC 检出率明显高于其他两组,肺及肝转移组的检出率无明显差别。可能提示骨转移时,患者外周循环血中存在恶性肿瘤细胞的机率相对较大,亦或现今采用cellsearch 系统的CTC 检测方法,对于乳腺癌骨转移的敏感性较高,或许更应推荐此类患者进行该项检测。CTC 检测的阳性率分析,则是肝转移组的明显高于肺及骨转移组,表明乳腺癌发生肝转移的预后可能较其他器官单发转移差,此外肝转移患者CTC 检测结果阳性率较高,其在接受治疗前后CTC 计数的变化可能较为明显,所以CTC 检测可能更适用于肝转移患者的疗效评价。
综上所述,本结果显示了不同转移灶晚期乳腺癌患者外周血CTC 检测的敏感性及阳性率,希望对晚期乳腺癌的临床治疗有启示及指导作用。由于本研究的入组样本量有限,且CTC 的检测技术和阳性标准尚无统一的国际规范,本结果有待于继续进行大样本量研究,多中心实验来进一步验证。
[1] Jemal A,Bray F,Center MM,et al. Global cancer statistics[J].GA Cancer J Clin,2011,61(2):69 -90.
[2] Chambers AF,Groom AC,Macdonald IC. Dissemination and growth of cancer cells in metastatic sites[J]. Nat Rev Cancer,2002,2(8):563 -575.
[3] 李蕾,江泽飞.循环肿瘤细胞检测在不同阶段不同类型乳腺癌中的应用[J].中国癌症杂志,2013,23(8):570 -575.
[4] Mostert B,Sleijfer S,Foekens JA,et al. Circulating tumor cells(ctcs):detection methods and their clinical relevance in breast cancer[J]. Cancer Treat Rev,2009,35(5):463 -474.
[5] 杨春明.早期乳腺癌的诊断和治疗[J].大连医科大学学报,2013,35(1):1 -6.
[6] 黄波,臧玉华.乳腺癌预后相关因素的研究进展[J].大连医科大学学报,2001,23(1):69 -71.
[7] Hayes DF,Cristofanilli M,Budd GT,et al.Circulating tumor cells at earch follow-up time point during therapy of metastatic breast cancer patients predict progression -free and overall survival[J].Clin Cancer Res,2006,129 (14Pt1):4218 -4224.
[8] Cristofanilli M,Budd GT,Ellis M,et al. Circulating tumor cells,disease progression and survival in metastatic breast cancer[J].N England J Med,2004,351(8):781 -791.
[9] Camara O,Rengsberger M,Egbe A,et al. The relevance of circulating epithelial tumor cells(CETC)for therpy monitoring during neoadvant(primary systemic)chemotherapy in breast cancer[J].Ann Oncol,2007,18(9):1484 -1492.
[10] Jiang ZF,Cristofanilli M,Shao ZM,et al.Circulating tumor cells predict progression-free and overall survival in Chinese patients with metastatic breast cancer,HER2 -positive or triple - negative (CBCSG004):a multicenter,double-blind,prospective trial.[J]. Ann Oncol,2013,24(11):2766 -2772.
