节肢动物中PGI蛋白编码序列的结构分析
2015-03-01王露甘苏国连李正跃和淑琪
王露甘,苏国连,李正跃,和淑琪
(云南农业大学植物保护学院农业生物多样性与病虫害控制教育部重点实验室,云南省农业生物多样性利用与保护重点实验室,云南昆明 650201)
节肢动物中PGI蛋白编码序列的结构分析
王露甘,苏国连,李正跃,和淑琪*
(云南农业大学植物保护学院农业生物多样性与病虫害控制教育部重点实验室,云南省农业生物多样性利用与保护重点实验室,云南昆明 650201)
[目的]探究节肢动物中PGI蛋白编码序列的相关规律。[方法]对Genbank中已报道的节肢动物PGI蛋白编码序列进行初步分析。[结果]节肢动物中PGI蛋白编码序列均以ATG作为起始密码子,终止密码子有3种类型,主要以TAA为主;膜翅目、同翅目、虱目的人体虱、直翅目的维特勒蟋及甲壳纲的大型蚤与鲑疮痂鱼虱等序列中AT含量较高,达54.3%~69.6%,鞘翅目的赤拟谷盗与中欧山松大小蠹的序列中GC含量较高,为50.6%~51.9%;PGI蛋白编码序列长度存在较大差异,介于255~1 800 bp;组成Pgi基因的外显子数目从甲壳纲大型蚤到昆虫纲各目呈减少趋势,且各外显子大小在同一目中具有一定的相似性;蛋白质结构域分析显示,节肢动物PGI蛋白质中普遍含有2个糖异构酶结构域,且各结构域的长度范围在不同种类中相近。[结论] 为进一步探究PGI作为节肢动物适应性分子标记的机制提供理论基础。
节肢动物;PGI蛋白编码序列;结构分析
6-磷酸葡萄糖异构酶(Phosphoglucose isomerase,PGI),是一种重要的多功能酶,在糖酵解途径中起着重要的催化作用[1]。编码该蛋白的基因型具有普遍的多态性,在原核生物及真核生物中普遍存在,且其多态性变化通常具有显著的基因型功能及适应性差异[2-3]。该基因型的多态性同时受到自然选择的强烈影响,可作为反映环境条件影响昆虫种群动态以及昆虫对环境条件适应能力的重要遗传标记之一[4-5]。Rank等[6]研究表明,不同纬度采集到的叶甲Chrysomelaaeneicollis种群,其PGI的基因型存在较大差异,高纬度种群以等位基因1为主,而地位低种群以等位基因4为主。Karl等[7]在灰蝶Lycaenatityrus的研究中也发现,不同海拔下L.tityrus的PGI基因型表现显著差异性,其中高山种群以Pgi2-2基因型为主,同时具有较强的抗寒能力,需要相对较长的发育时间;而低海拔种群主要以Pgi1-1、1-2、1-3等基因型为主,抗寒能力较弱。研究还表明,PGI基因的多态性表达与昆虫种群的适生性密切相关,这在蝶类研究中也得到了证实。具有不同PGI基因型的苜蓿黄蝶个体,其产卵力[8]、雄虫交配成功率[9]等具有显著差异;不同PGI基因型的灰蝶个体具有不同的生活史特征,如幼虫和蛹的发育时间,受寒过后的恢复时间,蛹的重量[7,10],生长速率,以及对幼虫其食物压力的反应能力[11]等都随PGI基因型的不同而存在显著性差异。
笔者以PGI蛋白编码序列作为分子标记,对节肢动物中已报道的PGI蛋白编码序列进行比较分析,从而找出PGI蛋白编码序列在节肢动物中的相关规律,为进一步探究PGI作为节肢动物适应性分子标记的机制提供理论基础。
1 材料与方法
1.1 节肢动物PGI蛋白编码序列的构建从Genbank中下载已报道全长的所有节肢动物PGI编码序列,共236条序列。其中,甲壳纲动物3条;蜱螨目2条;昆虫纲鳞翅目188条,双翅目25条,膜翅目12条,同翅目2条,虱目1条,直翅目1条,鞘翅目2条。所有序列的信息见表 1。
1.2 序列比对及分析将Pgi基因mRNA全序列导入MEGA5.0软件中,进行排列比对,比较Pgi基因编码序列的长度及外显子个数等信息;利用NCBI Blast程序分析蛋白序列的结构特征。
2 结果与分析
2.1 节肢动物PGI蛋白编码序列的比较
2.1.1密码子类型。PGI蛋白质的起始密码子都为ATG,终止密码子主要以TAA为主,以TGA和TAG作为终止密码子的种类较少。仅鳞翅目的家蚕Bombyxmori、直翅目的维特勒蟋Gryllusveletis、虱目人体虱Pediculushumanuscorporis以TGA为终止密码,而肩突硬蜱Ixodesscapularis、转基因捕食螨Metaseiulusoccidentalis、中欧山松大小蠹Dendroctonusponderosae、冈比亚按蚊Anophelesgambiae、果蝇属的拟暗果蝇Drosophilapseudoobscura、Drosophilapseudoobscura、Drosophilamojavensis、Drosophilapersimilis以TAG为终止密码。
2.1.2PGI蛋白质编码序列碱基含量。节肢动物中PGI蛋白质编码序列碱基组成含量存在较大差异。AT碱基偏好性(AT含量大于50%)以膜翅目、同翅目、虱目的人体虱Pediculushumanuscorporis、直翅目的维特勒蟋G.veletis及甲壳纲的大型蚤Daphniamagna与鲑疮痂鱼虱Lepeophtheirussalmonis等表现明显,含量为54.3%~69.6%,而鳞翅目、双翅目及蜱螨目中AT与GC含量在不同种类间高低无序,而鞘翅目的赤拟谷盗Triboliumcastaneum与中欧山松大小蠹D.ponderosae则表现出较强的GC碱基偏好性,达到50.6%~51.9%。

表1 节肢动物PGI蛋白编码序列碱基含量
2.1.3编码序列长度比较。目前已知的236条Pgi基因mRNA全序中,PGI蛋白编码序列长度存在较大差异,其中,最长的为鞘翅目的赤拟谷盗T.castaneum1 800 bp(包含终止密码子,下同),编码599 aa;最短的为甲壳动物亚门桡足纲的鲑疮痂鱼虱L.salmonis,仅有255 bp,编码84 aa。最长序列与最短序列之间相差1 545 bp。在研究最多的昆虫纲种类中,序列长度主要分布在1 632~1 686 bp,最短的是鳞翅目的柑橘凤蝶PapilioxuthusPGI蛋白序列,为810 bp。
2.1.4PGI蛋白编码序列结构比较。对节肢动物各种类PGI蛋白编码序列结构进行比较,结果发现,组成Pgi基因的外显子数目在不同目之间存在较大差异,且从甲壳纲大型蚤Daphniamagna到昆虫纲各目,外显子的数目呈减少趋势,而各外显子大小在同一目中具有一定的相似性(表 2)。在甲壳纲大型蚤D.magna中,Pgi基因的外显子数目最多,为14个;其次为昆虫纲的鳞翅目昆虫,由12个外显子组成;膜翅目昆虫为11个外显子;同翅目(豌豆长管蚜Acyrthosiphonepisum)和虱目(人体虱Pediculushumanuscorporis)各为10个外显子;鞘翅目赤拟谷盗的外显子数目为6个;双翅目的果蝇类由5个外显子组成,而蚊类则包含4个外显子。昆虫纲各目中多数昆虫的Pgi基因全长差异不大,因此外显子的个数不同导致其各个外显子的长度差异较显著。
2.2 蛋白质结构组成分析PGI氨基酸组成分析表明,大多数节肢动物PGI蛋白的主要组成氨基酸有Ala、Cys、Asp、Glu、Phe、Gly、His、Ile、Lys、Leu、Met、Asn、Pro、Gln、Arg、Ser 、Thr、Val、Trp、Tyr 20种,而丽蝇蛹金小蜂Nasoniavitripennis、赤拟谷盗T.castaneum及中欧山松大小蠹D.ponderosae不含有半胱氨酸Cys,鲑疮痂鱼虱D.magna不含有组氨酸His与色氨酸Trp。
此外,节肢动物PGI蛋白质中普遍含有2个糖异构酶结构域(Sugar isomerase ,SIS),分别标记为SIS-1和SIS-2,而甲壳纲的鲑疮痂鱼虱L.salmonis只含有一个SIS。各个物种间,SIS-1和SIS-2在蛋白质及核苷酸序列中的位置在不同目间存在一定差异,但各结构域的长度均较相近(表 3)。
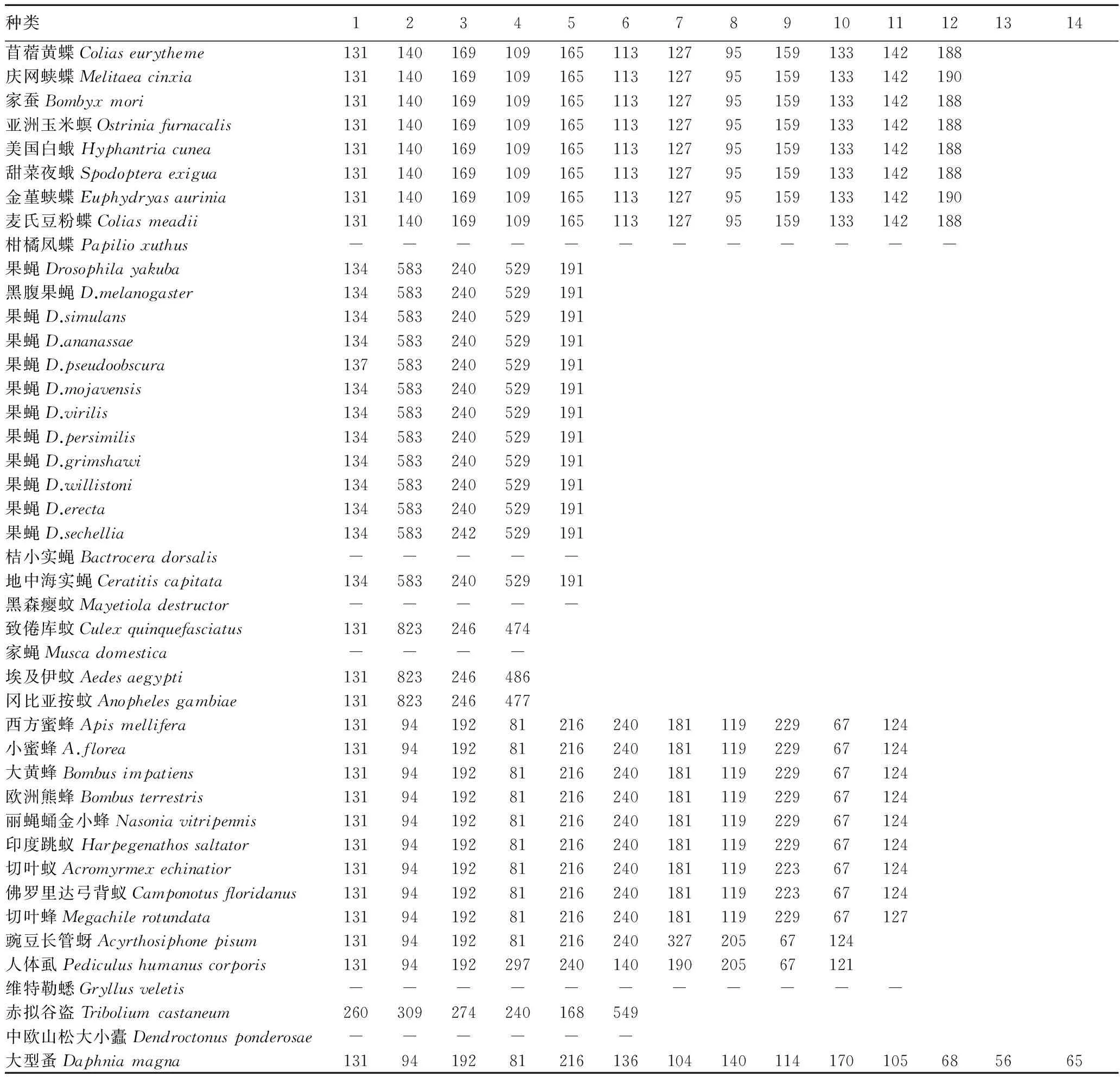
表2 节肢动物各种类外显子数目及大小
注:“-”表示外显子长度未知。

表3 节肢动物中各种类PGI蛋白结构域的信息
3 讨论
Pgi基因作为表明“环境-节肢动物适应性特征”之间关系的分子标记,在保护基因组学研究中起着重要作用[12]。该研究对Genbank上报道的节肢动物门PGI蛋白编码序列进行分析,选取其中9目49种共236条PGI蛋白编码序列作为研究对象,结果发现,PGI蛋白编码序列在节肢动物中普遍以ATG作为起始密码子,终止密码子类型有3种,其中主要以TAA为主。节肢动物中PGI蛋白编码序列终止密码子使用上偏好TAA,这可能是由于TAA终止翻译具有较低的误读率[13-14]。
节肢动物不同种类的PGI蛋白编码序列长度在255~1 800 bp,具有显著的长度多态性。研究表明,编码序列长度的大小对基因的表达水平具有一定影响[15]。编码序列的长短与基因的表达量在一定条件下成反比关系,编码序列较短的基因具有较高的表达水平,在物种进化水平上处于更有利的地位[16],反之,编码序列较长的基因在表达翻译过程中耗能较大且需要较多的调控因子进行协助,从而导致表达水平较低[17]。
在节肢动物Pgi基因中外显子数目从甲壳纲到昆虫纲各目呈减少趋势,从甲壳纲大型蚤14个到双翅目蚊类的4个,相差3倍多。同一基因在不同目间在结构上存在一定差异。这在杜周和等[18]的研究中也有表现,他们发现α-淀粉酶基因外显子数目在双翅目与鳞翅目之间存在较大差异,并分析引起基因结构发生变化的原因可能是由于这2个目昆虫在分开后各自经历了不同的进化历程。
节肢动物中除甲壳纲的鲑疮痂鱼虱外都具有2个糖异构酶结构域SIS,这与Ekman等[19]的研究结果相同,大约2/3的真核生物蛋白质中都含有2个或更多的结构域。在不同目间各结构域SIS在蛋白质及核苷酸序列的位置存在显著差异。Sandhya等[20]认为蛋白结构域长度变化是普遍存在的,而在节肢动物中PGI蛋白糖异构酶结构域的长度非常相近,这可能与不同种类及个体间PGI蛋白发生调整有关。在进化过程中,蛋白质结构域会在序列及结构上进行多次修饰调整,以完善性能上的多功能化。
4 结论
对节肢动物PGI蛋白编码序列的遗传多样性分析,结果表明,PGI蛋白编码序列在节肢动物中存在显著的长度多态性,而组成该基因的外显子数目从甲壳纲到双翅目呈逐渐减少趋势;该蛋白普遍含有2个糖异构酶结构域,各结构域的长度相近,且在不同目间的位置存在一定差异。
[1] LUO J,CHENG X Y,YAN X,et al.Characterizaiton and polymorphism analysis of phosphoglucose isomerase gene in the fall webworm (Hyphantriacunea)[J].Bulletin of Entomological Research,2012,102(4):477-488.
[2] GILLESPIE J H.The causes of molecular evolution[M].New York:Oxford University Press,1991.
[3] WATT WB,DEAN AM.Molecular-functional studies of adaptive genetic variation in prokaryotes and eukaryotes[J].Ann Rev Genet,2000,34:593-622.
[4] KATZ L A,HARRISON R G.Balancing selection on electrophoretic variation of phosphoglucose isomerase in two species of field cricket:GryllusveletisandG.pennsylvanicus[J].Genetics,1997,147(2):609-621.
[5] ZHENG C,OVASKAINEN O,HANSKI I.Modelling single nucleotide effects in phosphoglucose isomerase on dispersal in the Glanville fritillary butterfly:coupling of ecological and evolutionary dynamics[J].Phil Trans R Soc B,2009,364:1519-1532.
[6] RANK N E,BRUCE D A,MCMILLAN D M,et al.Phosphoglucose isomerase genotype affects running speed and heat shock protein expression after exposure to extreme temperatures in a montane willow beetle[J].Journal of Experimental Biology,2007,210(5):750-764.
[7] KARL I,SCHMITT T,FISCHER K.Genetic differentiation between alpine and lowland populations of a butterfly is related to PGI enzyme genotype[J].Ecogrphy,2009,32:488-496.
[8] WATT WB.Eggs,enzymes,and evlution:natural genetic variants change insect fecundity[J].Proc Natl Acad Sci,1992,89:10608-10612.
[9] WATT WB,CARTER P A,DONOHUE K.Females’-choice of “good genotypes” as mates is promoted by an insect mating system[J].Science.1986,233:1187-1190.
[10] KARL I,SCHMITT T,FISCHER K.Phosphoglucose isomerase genotype affects life-history traits and cold stress resitstance in a Copper butterfly[J].Functional Ecology,2008,22(5):887-894.
[11] KAR I HOFFMANN K H,FISCHER K.Food stress sensitivity and flight performance across phosphoglucose isomerase enzyme genotypes in the sooty copper butterfly[J].Popul Ecol,2010,52:307-315.
[12] WHEAT C W.Phosphoglucose isomerase (Pgi) performance and fitness effects among Arthropods and its potential role as an adaptive marker in conservation genetics[J].Conserv Genet,2010,11:387-397.
[13] CASSAN M,ROUSSET J P.UAG readthrough in mammalian cells:Effect of upstream and downstream stop codon contexts reveal different signals [J].BMC Mol Biol,2001,2(1):3.
[14] NAMY O,HATIN I,ROUSSETS J P .Impact of the six nucleotides downstream of the stop codon on translation termination [J].EMBO Rep,2001,2(9):787-793.
[15] 张乐,金龙国,罗玲,等.大豆基因组和转录组的核基因密码子使用偏好性分析[J].作物学报.2011,37(6):965-974.
[16] MORIYAMA E N,POWELL J R.Codon usage bias and tRNA abundance in Drosophila[J].J Mol Evol,1997,45:514-523.
[17] HOLMQUIST G P,FILIPSKI J.Organization of mutmions along the genome:a prime determinant of genome evolution[J].Trends Ecol Evol,1994,9:65-69.
[18] 杜周和,刘俊凤,刘彬斌,等.家蚕淀粉酶基因系统发育及遗传多样性[J].西南农业学报,2014,27(1):442-449.
[19] EKMAN D,BJORKLUND A K,FREY-SKTT J,et al.Multi-domain proteins in the three kingdoms of like - orphan domains and other unassigned regions[J].J Mol Biol,2005,348:231-243.
[20] SANDHYA S,PANKAJ B,GOVIND MK,et al.CUSP:an algorithm to distinguish structurally conserved and unconserved regions in protein domain alignments and its application in the study of large length variations[J]. BMC Struct Biol,2008,8:28.
Structural Analysis of PGI Protein Coding Sequence from Arthropoda
WANG Lu-gan,SU Guo-lian,LI Zheng-Yue,He Shu-qi*
(Key Laboratory for Agricultural Biodiversity and Pest Management of Ministry of Education,College of Plant Protection,Yunnan Agricultural University,Kunming, Yunnan 650201)
Abtract [Objective] In order to explore the relative rules about PGI protein coding sequence of Arthropoda.[Method] the PGI protein coding sequence of Arthropoda had reported in Genbank were primary analyzed.[Result]The results showed that ATG was the start codon in all sequences,the type of the stop codon was three,and mainly based-TAA.The content of AT in the Hymenoptera,Homoptera,Pediculushumanuscorporis,Gryllusveletis(Orthoptera) andDaphniamagna,Lepeophtheirussalmonis(Crustacea) was higher,as 54.3%~69.6%,while the content of GC in theTriboliumcastaneumandDendroctonusponderosae(Coleoptera) was higher,as 50.6%~51.9% .The length of PGI protein coding sequence was largly different,between 255-1 800 bp.The number of exon ofPgigene gradually reduced fromDaphniamagnato each order of insecta,the size of each exon was similar in the order.Protein domain analysis showed that there were two sugar isomerase in the PGI protein coding sequence of Arthropoda except forDaphniamagna,and the size of each domain was similar in different species.[Conclusion] The study provided theoretical basis for further exploring the PGI as arthropods adaptive mechanism of molecular markers.
Arthropoda;PGI protein coding sequence;Structural analysis
国家“973”计划(2011CB100404);云南省科技创新团队计划(2011HC005);云南省高校科技创新团队支持计划(云教科[2011]14号)。
王露甘(1993- ),男,云南嵩明人,本科生,专业:植物保护,*通讯作者。
2014-12-17
S 181.3
A
0517-6611(2015)04-022-04
