基于传统君臣佐使组方配伍理论的组合中药分子化学研究策略
2015-02-27郑晓晖白亚军
郑晓晖,贾 璞,白亚军
(西北大学 生命科学学院, 陕西 西安 710069)
·生命科学(特约稿件)·
基于传统君臣佐使组方配伍理论的组合中药分子化学研究策略
郑晓晖,贾 璞,白亚军
(西北大学 生命科学学院, 陕西 西安 710069)
笔者基于对现代新药研究模式的认识和研究,综述了当代新药研究难点与现代中西药研究模式与新观点。针对病证,遵循君臣佐使配伍理论,整合君、臣、佐、使分子库,引入现代药物分子拼合手段,实现药物之间深入联合,将宏观传统理论与微观分子设计相融合统一,辅以体内代谢研究,发掘代表组方功效之核心有效成分,提出并构建了基于传统君臣佐使配伍特色的组合中药分子化学研究策略。此研究策略集传统君臣佐使宏观指导原则与组合化学微观构建手段于一体,使新药研究不脱离中医药传统又融合现代组合化学方法,适合作为一种中药研发新策略从而推动中药现代化乃至新药创制发展。
君臣佐使;组合化学;组合中药分子化学;新药研究策略
随着科技发展与社会的不断进步,人类的生活质量、健康状况及社会总体医疗条件等,均得到了不同程度的提高与改善,平均寿命呈逐年增长趋势。据欧洲制药工业协会联合会2012年统计[1],2000—2009年,人类平均寿命增长了1.74岁,其中来自药物的贡献占到73%,由此可见,药物在影响人类寿命的诸多因素中地位显著。近20年来,新药研发投入的经费与其他行业相比也一直居于首位,约占全球各行业总研发经费的14.4%[1]。
然而,新药的研究与开发是一项涉及多领域、多学科的复杂系统工程,其研发过程具有高投入、高风险、低成功率、高回报等特点。2011—2012年《Nature Biotechnology》杂志[2, 3]与2014年欧洲制药工业协会联合会[1]统计了美国FDA近25年来新药研发的数量与研发费用情况(图1)。由图1可知,1990—2013年,每年新增的新分子实体数量总体呈下降趋势,而1996—2013年中,每年的研发经费则呈上升趋势。一个新药的上市,研究费用约10亿美元,开发周期约10年,而成功率仅有约10%。尤其近10年,全球平均每年投入新药研发的资金约为850亿美元,按新药产出率计算,约有600亿美元“不作为”[4]。随着监管力度、时间成本及研究费用逐年上升,加之近年,全球各大制药公司对新药投入的资金预算比例呈现下降趋势,均使新药研发愈加困难,“重磅炸弹”似的新药产出愈发缓慢。
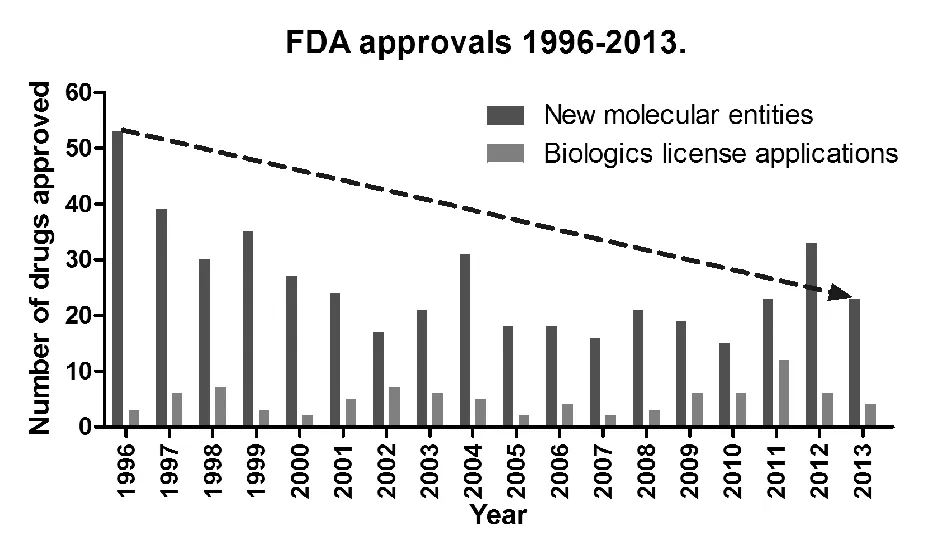
图1 FDA 每年批准的药品Fig.1 Drugs approved by FDA between 1996 and 2013
面对上述问题,2011年《Lancet》[4]撰文“Where will new drugs come from?(未来新药源自何方?)”提到:“在资金短缺之时,推进药物革新与突破药物研发,关键也许不是投资预算的多少,而是通过避免浪费和失败来提高研发效率”。作者认为可通过大公司研发中心间的融合、产研的有效结合及政府资金有力支持等措施来实现。笔者认为避免浪费和失败的因素除上述几点外,最重要的还在于药物本身研究前期的药物先导化合物或新化学实体的筛选及其有效性与安全性的保障。目前,先导化合物的发现已经成为新药开发关键节点与焦点[5]。其发现的途径可归纳为[6]:①从老药新用途或者临床药物的副作用启发;②以体内内源性活性物质为先导化合物;③由代谢产物中发现;④由天然产物活性成分中发现;⑤随机方式发现;⑥由药物合成的中间体发现;⑦合成生物大分子结合计算机辅助设计方法发现;⑧采用组合化学方法合成进而高通量筛选发现。
我国是传统中医药文化的发源地,新药的研发最不应忽视中药的重要作用。几千年来,众多医者留下了数以万计的经方、验方,均经历了人们长期临床实践的验证,因此,从已被实践证明安全、有效的中药及方剂中去寻找更有效、更优效的新药,要比多数西方国家广筛发现新药的机率要大的多。这一过程,不仅可为新药研发出现的“痼疾”开出一味良药,更肩负着中药现代化腾飞的历史重任。
1 现代新药研发模式与观念
1.1 西药研发模式
西药的研发主要由微观入手,以具体的病为核心,通过靶标的发现与确证、活性评价模型的建立、先导化合物的发现及其结构优化来实现新药创制的目的。围绕着这四部分,分别研究基因、蛋白质化学及结构生物学,利用X射线晶体衍射技术、二维核磁共振波谱技术及各种质谱分析技术等强化对药物靶标的结构与功能的认识;对药物分子物理化学性质的研究,着重调整药代动力学行为和安全性,多方位的展开药物分子的活性评价;利用计算机技术,模拟、解析、设计药物小分子,从而使得先导化合物的发现历程缩短;利用组合化学手段结合高通量筛选等方法优化先导化合物;注重生物学、化学、计算机科学及信息学等相关学科领域的交叉融汇[7]。
1.2 融入中西药结合元素的现代中药新药研发新模式、新观点
基础理论的发展对于中药的发展至关重要,而基础理论发展的核心是方法和观念的创新。为此,不少学者提出了具有中药研究的新理论和观念:
1.2.1 西药中药化 1982年,岳凤先[8]认为,所谓西药与中药是传入我国后人为地依据地域来源划分的,西药学本身具备中医药学理论体系的药物特性及功用,能按中医药理论使用,故提出“西药中药化”的观点,主张将西药放入中医药体系中去研究,赋予它中药的属性,用中医药术语去描述它的功效,按中医药配伍组成规律完成药物的配合使用而施治于人,以期增加中药品种,实现中西医联合用药。
1.2.2 中药配位化学学说 1993年,曹志权[9]提出“中药配位化学学说”,认为:中药有效成分有可能是其中的几种有机物成分,也有可能是中药中的微量元素,但更为可能是有机成分与微量元素结合成的缔合物或者配合物,此类物质更能作为其活性中心发挥药效,从而为中药起效成分的发现提出了一种新的可能性。
1.2.3 中药基因组学与中药化学组学 2000年,王升启[10]提出“中药基因组学”及“中药化学组学”,即引入现代基因组学手段,将中药的自身特性(如药性、功效及主治)与其对应一定疾病的相关基因表达与调控的影响联系起来, 用基因组学方法来阐释中药理论及作用机制;运用现代科学技术手段来揭示与中药本身药性、功效及主治等相关的物质基础,包括药效成分的组成、结构、性质、含量及相互作用等。
1.2.4 中药分子方剂 2001年,刘德麟[11]提出“中药分子方剂”的方剂研究观点,认为中药分子组合能够表示方剂的药效,称之为“分子方剂”,采用归经分析简化中药方剂成分,从分子配伍-效应关系寻求最佳组合,运用方剂配伍设计中药方剂分子,使得方剂高度简化而特色疗效增强,可以用中药分子方剂取代中药方剂。
1.2.5 组合中药学 2002年,吴凤锷[12]提出“组合中药学”的概念,主张运用组合分子方法从分子水平研究中药及其药效物质,以揭示其药效活性成分及作用机制,即将中药及复方复杂成分按化学结构或者药效作用分为不同群体,依据已确证功效分子族的性质及相互作用等来组成新形式的复方。
1.2.6 分子中药 2002年,王四旺[13]提出“分子中药”研究观点,认为中药及其组方皆由诸多拥有一定结构和药理作用的分子构成,确定单味中药及其组方中的有效成分或有效部位,并分析其对“证”发挥疗效的主与次,从而将源于单味中药或方剂中具有一定药理活性的有效成分或部位定义为“中药分子”。进一步,将中药分子群按传统君臣佐使组方原则定义为“君药”、“臣药”、“佐药”及“使药”;将依照此思想组方并研制而成的中药新药称为“分子中药”。
1.2.7 组分中药 2005年,张伯礼、王永炎[14]联合提出,研究复杂系统,应在复杂性科学理论指导下,遵循“复杂—简单—复杂”的原则,即将其中非线性规律部分进行降阶、降维处理后去研究;同时借助现代化学的研究手段,发挥中药方剂的配伍优势,研制创新中药,从而构建以组分配伍的现代中药。
1.2.8 本草物质组学 2007年,梁鑫淼[15]提出“本草物质组学”计划,拟建立高效高通量的样品制备方法及相应的表征方法(定性、定量研究),构建本草物质资源库;依据组分的组成、结构和功能,数字化物质资源库;全面展开组分配伍、成分配伍及组效关系等中药特色研究,构建创新中药体系,以期为中药新药开发提供支撑,加快新药研发的步骤。
1.2.9 化学中药 2007年,邓家刚[16]将中医药理论指导下的化学药物称之为“化学中药”,系统地将化学物质进行中药特性和应用规律的研究与归属,并将其按中医辩证论治原则应用于临床,使其具有中药的身份;并于2008年出版了《中药新家族——化学中药》一书,载入428种常用化学药物,对其进行了中医特征性的诠释与功效种类划分。
无疑,这些理论的提出对于促进中药现代化的开展及创新药物的研制起到了积极的作用。组分中药为复杂复方的研究提出了“复杂-简单-复杂”的研究思路,分子中药将微观分子化思路引入中药物质功效研究中,化学中药借鉴中药药性理论为中西药联合用药及其新药研发提供了可能性。基于此,笔者提出“基于君臣佐使配伍的组合中药分子化学研究策略”。
2 我们的研究探索
基于以上研究发展思路,笔者项目组先后提出了“君-使对药”、“君-使化合物”、“君臣佐使化合物”及“组合中药分子化学”等概念,并展开了相关研究。

图2 组合中药分子化学的研究历程Fig.2 The study history and progress of CTCMMC
2.1 君-使对药研究
复方中,君臣佐使配伍往往与“对药”的“七情”组成融合一体,形成一种有机的、多层次的组合关系。复方中,君药是针对病证的核心主药,使药既协调诸药,又引君药直达病所,这种特殊的对药组合又反映了“七情”配伍中增强药效的“相使”关系,故称之为君-使对药。君-使对药对中药复方整体疗效的发挥,往往起到“画龙点睛”的关键作用,能反映中药复方综合用药、对证治疗、核心有效,直达病所的运用特点。所以,在经方、效方中寻找君-使对药关系,研究其体内效应物质及其分布特征是丰富中药理论及开发创新药物的有效途径。
为了易于开展君-使对药及其体内效应物质的研究,笔者选择满足以下条件的君-使对药为对象:①复方为中医临床广泛应用,所含药味数应尽可能少;②系列复方中君药或使药一者相同,有利于对比研究;③方中使药味数宜少,且与君药归经相同为好。在此3个条件的限定下,对传统经方和效方中的君使药物作了筛选分析,选择了丹参系列君-使对药(丹参-冰片、丹参-檀香和丹参-降香)、广枣系列君-使对药(广枣-冰片、广枣-檀香)、远志系列君-使对药(远志-石菖蒲)等为研究切入点,运用代谢组学技术和数理模型辨识技术展开研究[17-20],发现了丹参系列君使对药特征代谢产物丹参素异丙酯[17,20],并对其进行了合成,研究表明其具有舒张血管,抗心肌纤维化,抗脑缺血,对D-半乳糖致衰大鼠大脑、小脑均有保护作用[21-23]。
2.2 君-使化合物研究
笔者项目组运用现代化学拼合手段,设计并合成了可体现君-使对药特点的君-使化合物丹参素冰片酯[24],已获得40余个国家和地区专利授权[25]。研究表明,丹参素冰片酯具有显著的抗心、脑缺血及抗动脉粥样硬化作用[26-28],进而依从君-使对药提出君-使化合物概念,即以君药、使药中分别起主要作用的化合物为药效团,通过适当的化学键将其连为一体所形成的一类新的代表君-使对药部分功效的化合物。据此,设计并合成了咖啡酸冰片酯[29]、没食子酸冰片酯[30]、原儿茶酸冰片酯[31]、3,4,5-三甲氧基肉桂酸细辛醇酯[32]等一系列君-使化合物并对其体内代谢及药效进行了相关研究。
2.3 基于君臣佐使组方配伍和组合化学手段的组合中药分子化学
在君-使对药、君-使化合物的研究基础上,笔者以君臣佐使配伍为指导,增加“臣”“佐”的分子贡献,拓展君-使化合物的研究方式,提出君臣佐使化合物的概念,为创新药物研发注入新的内容;增加组合化学的研究手段与研究方法,进而形成一种新的药物设计方法,这种方法融合了中药的宏观设计思路,也借鉴了组合化学的微观设计研究方法,体现出中西药相结合、宏观与微观相统一药物设计理念。因此,将这种研究方法称之为组合中药分子化学策略。下面,着重阐述组合中药分子化学的含义、研究方法与研究实例。
2.3.1 组合中药分子化学的含义 组合中药分子化学是指:遵循君臣佐使配伍指导思想的多组分协调作用的宏观设计思路,引入组合化学的微观药物设计、研究方式,将中药或西药中不同功能的小分子(或经结构修饰后的分子)或基团依据功能和作用定义为“君”“臣”“佐”“使”分子或基团,综合考虑可能出现的药代动力学结果、化学合成的难易程度、计算机辅助模拟结果等多种因素,以适当的化学键将各个分子或基团连接在一起,形成一系列新分子实体,从而改变原有君、臣、佐、使分子或基团各个单一小分子的功能性质,使新的分子实体不仅有效,而且易于吸收利用、降低毒副作用,从而实现安全、优效、可控的药物功能。
2.3.2 组合中药分子化学的研究方法 组合中药分子化学的研究方法,具体而言可分为两个部分:①君、臣、佐、使分子库的建立;②君、臣、佐、使分子的结构改造与相互连接方式的建立与优化。前者为宏观设计,后者为微观修饰。具体设计思路参见下图3。

图3 运用组合中药分子化学研究方法进行君臣佐使化合物的设计思路Fig.3 Molecular design of ‘Jun-Chen-Zuo-Shi’ compounds by the method of CTCMMC
1)君、臣、佐、使分子库概念的提出
首先,针对某种病与证,确定可能的君、臣、佐、使分子库。所谓君、臣、佐、使分子库,是借用君臣佐使的中药组方原则提出的,指:对于病因靶点起主要作用的分子骨架集合为君分子库;对君分子骨架起协同或增强作用的分子集合称为臣分子库;对稳定君分子或臣分子骨架,且兼具治疗次症的分子基团的集合称为佐分子库;对君分子或君-臣分子或君-臣-佐分子起保护作用或诱导至相应部位的分子基团的集合称为使分子库。
其次,关于君、臣、佐、使分子库的概念需要做出两点解释:一,该类分子库指的是药物分子的功能属性,而非中药中某一单味药的属性。不能简单的将君、臣、佐、使分子库等同于中药中单味药化学成分的集合;二,该分子库的概念源于中药组方宏观设计思想,并非囿于中药化学成分本身,库中所含分子并不局限于中药分子领域范畴,可涵盖西药分子或其分子片段。因此,君、臣、佐、使分子库的建立,依据分子的功能属性,只要对疾病治疗有益的,都可以依据其功能入选至相应的库中。
2)君、臣、佐、使分子的结构改造与相互拼合方式的建立与优化
君、臣、佐、使分子库中分子的组合方式与连接方式多种多样,君分子始终为决定性分子骨架,必须存在,其他3类分子或基团根据需要可分别与君分子键合。具体连接方式,需考虑拼接前后的分子或分子基团的化学稳定性、实现拼接的难易程度、与相应靶点或受体的空间结构的适配性、药物代谢的稳定性等因素(必要时,需对各库分子进行修饰、改造后再进行相应的连接),并通过计算机辅助模拟设计、组合化学等手段得到相应的潜在药物分子库。
2.3.3 运用组合中药分子化学开发新化学实体 2013—2015年,笔者项目组运用组合中药分子化学这一策略,设计、合成了一类旨在降低血压、改善现有血管紧张素转化酶抑制剂副作用,代号为221s的新分子实体。初步药效学实验表明,部分化合物相对于阳性药卡托普利具有明显的降压效果,这对组合中药分子化学策略的有效性做出了实例验证。现简述如下:
血管紧张素转化酶抑制剂(Angiotensin-Converting Enzyme Inhibitor,ACEI)是一类可以抑制血管紧张素转化酶(ACE, EC 3.4.15.1)的小分子化合物。然而,近年来,现有ACEI类药物的副作用(干咳、肾衰竭、血管性水肿等[33-34])越来越突出明显,已成为其销量下降的主要原因之一。如何降低ACEI类药物的副作用,成为该类药物开发面临的首要课题。
依据血管紧张素转化酶活性位点的空间结构,总结现有血管紧张素转化酶抑制剂类药物分子结构,发现脯氨酸结构为关键药物活性骨架,将之作为ACEI分子的基本结构,称之为君分子基团。同时,研究表明单独的氨基酸几乎不能抑制血管紧张素转化酶的活性,与脯氨酸N端相连的脂肪氨基酸具有稳定药物分子的作用[35],故将这部分氨基酸残基作为佐分子基团。(如图6所示)
其次,现代研究表明,许多酚酸类化合物例如丹参素[36]、芹菜素[37]、阿魏酸[38]等都具有降低体内血压的作用。从这些酚酸类化合物的结构分析可以看出,其结构中具有邻苯二酚基团,易于与ACE酶活性中心的锌离子配位[39]。因此,选取多酚类苯甲基、苯乙基、苯丙基类化合物作为臣分子库的构成(图4)。

图4 基于组合中药分子化学策略的新型ACEI分子设计分析Fig.4 Molecule design of ACEI base on strategy for CTCMMC
再次,人和动物体内存有两套各自独立的肾素-血管紧张素系统,一个在外周系统,主要是肾脏;另一个在中枢,存在于脑内不同部分[40]。由此,我们设计辛香走窜、开窍醒神的中药分子,如冰片、薄荷醇、α-细辛醇[41]等作为使分子以增加药物分子的脂溶性以便于透过血脑屏障抵达脑部;同时可增加水溶性基团,如甲基哌嗪、N,N-二甲基乙基胺、吗啡啉等以促进整体药物分子易于抵达外周肾素-血管紧张素系统。因此,选取以上分子作为使分子库构成(图4)。
综上分析,结合各分子库分子结构,我们认为以酰胺键或酯键相互连接各库分子更易实现,故优先得到药物分子221s结构通式,图5。依据相关文献[42-43],提出该类化合物的合成路线,见图6。
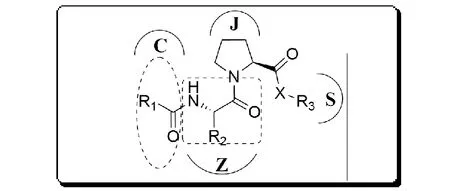
图5 221s (J, C, Z, S)结构通式Fig.5 The general structural formula of 221s
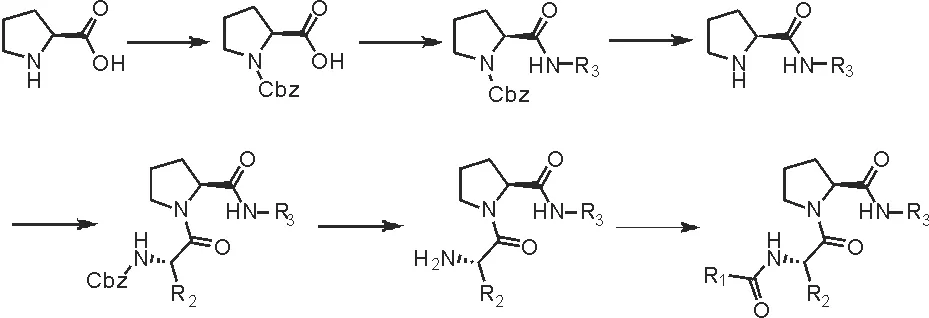
图6 221s系列化合物合成路线Fig.6 Synthetic route of 221s series compounds
按照上述设计方案,初步合成了40个新化合物,经体外、体内活性测试,80%以上的化合物具有抑制ACE的作用(尚未公开数据),其活性结果初步肯定了基于君臣佐使配伍的组合中药分子的设计思路在药物设计过程中的合理性、有效性与省时性。
2.4 基于君臣佐使配伍理论的组合中药分子化学研究策略
药性理论与君臣佐使组方配伍原则是方剂组成的基本原则,清《医学源流论》提出“方药离合论”曰:“方之既成,能使药各全其性,亦能使药各失其性。操纵之法,有大权焉。此方之妙也。”[44]即方成则无药。由此可见,君臣佐使配伍能够统筹各药药性,使之配合极致发挥,亦应为中药新药研发所遵循的原则和指导思想。
据此,笔者提出基于君臣佐使配伍理论的组合中药分子化学研究策略,即秉承传统文化精髓,遵循君臣佐使配伍理论原则,引入现代组合分子设计手段,将宏观与微观相融合,结合体内代谢,辅以药效验证,发掘代表组方功效之核心有效成分,构建组合中药分子;简而概之,以中药“方证组方”的整体观念统领药物分子的设计方式,将治疗主证的中药分子定为君分子、协同或增强君药疗效者定为臣分子、治疗次证者为佐分子、引经或调和诸药者为使分子,再以组合化学方法将之以共价键的形式拼合、化合起来(而非混合),形成一种新的药物分子设计方法[45-46]。
3 展 望
2015年,习近平提出[47]“要切实加强食品药品安全监管,用最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责,加快建立科学完善的食品药品安全治理体系”,此四个“最严”将迎来自有知识产权药物研发重大战略机遇期的到来,将促进中国特色创新药物的战略大发展。
笔者认为以中药为源泉的新药研究只有遵循复方配伍组成指导原则,才能真正使方剂的精髓运用得当,体现方成无药之真谛,避免偏离传统医药轨道而导致的研究与认识之片面性。因此,创新中药研发应秉承君臣佐使传统理论,基于临床有效性,由代谢入手,以核心有效成分的发掘为立足点,运用组合化学现代拼合方法等设计新型中药分子,将开启中药组方为核心的创新药物的研发新时代。
[1] The European Federation of Pharmaceutical Industries and Associations. The Pharmaceutical Industry in Figures[EB/OL]. www. efpia. eu, 2014.
[2] KLING J. Fresh from the biologic pipeline-2010[J]. Nature Biotechnology, 2011, 29: 197-200.
[3] MALORYE A. Reinventing clinical trials[J].Nature Biotechnology, 2012, 30: 41-49.
[4] The Lancet. Where will new drugs come from? [J]. Lancet, 2011, 377(9760): 97.
[5] 赵爱国, 韩宇萍. 从植物药中筛选先导化合物的策略[J]. 中国药房, 2002, 13(9):516-518.
[6] 王丹妮, 刘冠男. 先导化合物的发现与活性筛选[J]. 企业导报, 2012, 20:278.
[7] 郭宗儒. 药物分子设计[M]. 北京:科学出版社, 2005:1-2.
[8] 岳凤先.试论中药西药化[J]. 医学与哲学, 1982, 1:33-36.
[9] 曹志权. 微量元素与中医药[M].北京:中国中医药出版社,1993:82.
[10] 王升启. 试论“中药基因组学”与“中药化学组学”[J].世界科学技术-中药现代化, 2000, 2(1): 28-33.
[11] 刘德麟, 梁菊生. 广义证候与分子方剂——关于证候与方剂现代化——方证学研究的思考[C]. 中国中西医结合学会成立20周年纪念大会论文集,2001, 10:145-146.
[12] 吴凤锷. 从单方成药到“分子中药学”和“组合中药学”[J]. 中草药, 2002, 33(9):769-771.
[13] 王四旺. “中药分子”与“分子中药”[J]. 第四军医大学学报, 2008, 29(18):1633-1636.
[14] 张伯礼, 王永炎. 方剂关键科学问题的基础研究——以组分配伍研制现代中药[J]. 中国天然药物, 2005, 3(5): 258-261.
[15] 梁鑫淼, 钱旭红, 惠永正. 《本草物质组计划》的设想与建议[J]. 世界科学技术——中医药现代化, 2007, 9(5): 1-6.
[16] 邓家刚. 关于化学中药研究的若干思考[J]. 广西中医药, 2007, 30(3):1-3.
[17] 郑晓晖. 三组君——使对药及其体内效应物质的研究[D]. 西安:西北大学,2007.
[18] 桑柏.“广枣——檀香”君——使对药的效应物质研究[D]. 西安:西北大学,2010.
[19] 孟雪. 基于P-糖蛋白调控的远志——石菖蒲配伍“良”关系研究[D]. 西安:西北大学,2014.
[20] ZHENG Xiao-hui, ZHAO Xin-feng, ZHAO Xin, et al. Determination of the main bioactive metabolites of Radix Salvia miltiorrhizaein compound Danshen Dripping Pills and the tissue distribution of danshensu in rabbit by SPE-HPLC-MSn[J]. Journal of SeparationScience, 2007, 30(6): 851-857.
[21] WANG Sheng-peng, ZANG Wei-jin, KONG Shan-shan, et al. Vasorelaxant effect of isopropyl 3-(3, 4-dihydroxyphenyl)-2-hydroxypropanoate, a novel metabolite from Salvia miltiorrhizae, on isolated rat mesenteric artery[J]. European Journal of Pharmacology, 2008, 579(1): 283-288.
[22] 程亮星. 丹参素异丙酯的药效学研究[D]. 郑州:郑州大学, 2008.
[23] YIN Qian,LU Hai-yan, BAI Ya-jun, et al.A metabolite of Danshenformulae attenuates cardiacfibrosis induced byisoprenaline, via aNOX2/ROS/p38 pathway[J]. British Journal of Pharmacolog, Accepted, 2015,DOI: 10.1111/bph.13133.
[24] 张群正, 董岩, 南叶飞,等.β-(3,4-二羟基苯基)-α-羟基丙酸异丙酯/冰片酯合成研究[J]. 有机化学, 2009, 29(9): 1466-1469.
[25] 郑晓晖, 张群正, 王世祥,等. 取代β-苯基-α-羟基丙酸衍生物、其合成方法及其用途:WO 2007/131446[P]: 2007-11-22.
[26] XIE Xin-ni, WANG Shi-xiang, XIAO Lei, et al. DBZ blocks LPS-induced monocyte activation and foam cell formation via inhibiting nuclear factor-κB[J]. Cellular Physiology and Biochemistry, 2011, 28: 649-662.
[27] LIU Duan, GAO Yi-wen, WANG Hui-juan, et al. Evaluation of the effects of cytochrome P450 non-synonymous single-nucleotide polymorphisms on DBZ metabolism and inhibition potential[J]. Drug Metabolism and Disposition, 2010, 38(12):2259-2265.
[28] 刘亚荣.丹参素冰片酯干预TLR4信号通路抗动脉粥样硬化的机制研究[D].西安:西安交通大学,2010.
[29] 南叶飞. 君-使化合物用于君-使药对体内作用机制研究[D]. 西安:西北大学,2010.
[30] 申旭霁. 原儿茶酸冰片酯的设计、合成及代谢研究[D]. 西安:西北大学,2012.
[31] 兰薇. 基于“广枣-冰片”配伍设计的没食子酸冰片酯体内外代谢研究[D].西安:西北大学,2013.
[32] 秦方刚.α-细辛醇及其衍生物的设计、合成与抗癫痫活性研究[D]. 西安:西北大学,2015.
[33] NADIN A S, JOHN V C, GONZALES G B, et al. Angiotensin-converting enzyme inhibitory effects by plant phenolic compounds: astudy of structure activity relationships[J]. Journal of Agricultural and Food Chemistry, 2013, 61(48), 11832-11839.
[34] HACKL L P, CUTTLE G, DOVICHI S S, et al. Inhibition of angiotensin-converting enzyme by quercetin alters the vascular response to bradykinin and angiotensin I[J]. Pharmacology, 2002, 65: 182-186.
[35] PETRILLO E W Jr, ONDETTI M A. Angiotensin-converting enzyme inhibitors: medicinal chemistry and biological actions[J]. Medicinal Research Reviews, 1982, 2(1): 1-41.
[36] TANG Yi-qun, WANG Min-hui, CHEN Chun-lin, et al. Cardiovascular protection with Danshensu in spontaneously hypertensive rats[J]. Biological & Pharmaceutical Bulletin, 2011, 34(10): 1596-1601.
[37] 隋海霞, 严卫星, 耿桂英,等. 芹菜素对自发性高血压大鼠血压的影响及其机制初步研究[J]. 环境与健康杂志, 2009, 26(2):112-113.
[38] ALAM M A, SERNIA C, BROWN L. Ferulicacid improves cardiovascular and kidney structure and function in hypertensive rats[J]. Journal of Cardiovascular Pharmacology, 2013, 61: 240-249.
[39] 王锡森, 宋玉梅, 叶琼, 等.手性及非中心对称配位聚合物的组装[J].科学通报,2005,50(21): 2317-2340.
[40] 嵇汝运. 抗高血压药物[M].济南:山东科学技术出版社,1995:125.
[41] 郑晓晖, 秦方刚, 白亚军, 等.α-细辛醇酯及其制备方法与应用:中国专利, 201410699506.6[P]: 2014-11-26.
[42] RASHEED A M, NAMALA R, MANNE N, et al. Concise and efficient synthesis of highly potent and selective dipeptidyl peptidase II inhibitors[J]. Synthetic Communications, 2008, 38(2): 162-169.
[43] RAO K S, SO S, KUMAR A. Vesicles and reverse vesicles of an ionic liquid in ionic liquids[J]. Chemical Communications (Cambridge, United Kingdom), 2013, 49(73): 8111-8113.
[44] 徐灵胎. 医学源流论[M].刘洋校注.北京:中国中医出版社,2008:27.
[45] 白亚军. 基于“君臣佐使”配伍理论的药物分子设计、合成与活性研究[D]. 西安:西北大学. 2015.
[46] ZHAO Xin-feng, ZHENG Xiao-hui, FAN Tai-ping, et al. A novel drug discovery strategy inspired by traditional medicine philosophies[J]. Science, 2015, 347 (6219 Suppl): S38-S40.
[47] 张朝华. 习近平:“4个最严”监管食品药品安全把好每道防线. 新华网 [EB/OL]. http://news.xinhuanet.com/fortune/2015-05/31/c-127860707.htm, 2015.
(编 辑陈镱文)

郑晓晖,陕西长安人,教授,博士生导师。西北大学中草药现代化工程研究中心主任、深圳清华大学研究院-西北大学共建“创新中药及天然药物研究”联合实验室主任,陕西省重点科技创新团队——“基于秦巴优势中草药资源的新药创制创新团队”负责人,陕西省九三学社教育文化专门委员会副主任。主要从事中药复方成分分析、代谢和应答,创新药物研发等。主持国家“重大新药创制”科技重大专项、国家自然科学基金项目、教育部科学研究重点项目、高等学校博士学科点专项科研基金、深圳市科技工贸和信息化委员会项目等50余项国家及省部、市项目课题。获得中国、美国、俄罗斯、加拿大、澳大利亚、新西兰、韩国、新加坡、欧洲等近50余国家、地区发明专利授权。获得陕西省青年科技奖、陕西省高等学校科学技术一等奖、陕西省科学技术奖一等奖等省部级奖项4项。在国内外学术期刊发表研究论文200余篇。
Research strategy for Combination of Traditional Chinese Medicine Molecular Chemistry based on the traditional theory of ′Jun-Chen-Zuo-Shi′
ZHENG Xiao-hui, JIA Pu, BAI Ya-jun
(College of Life Sciences, Northwest University, Xi′an 710069, China)
On the basis of research and understanding of new drug design, we summarized the problems, research approaches and new ideas in new drug research and discoveries,and then following the principle of ‘Jun-Chen-Zuo-Shi’, the strategy of Combination of Traditional Chinese Medicine Molecular Chemistry (CTCMMC) based on the traditional theory of ‘Jun-Chen-Zuo-Shi’ was proposed and established. This strategy, which fuses molecular designing and medicine philosophies, needs to integrate molecular databases of Jun, Chen, Zuo and Shi, achieve the drugs’ combination by the method of molecular merging, and then supplement by metabolism studiesinvivo, aiming to exploring the key active ingredients in formulation of Traditional Chinese Medicine(TCM). This above-mentioned strategy makes new drug innovation keep on track of TCM and then integrate with modern molecular merging method, which can promoting the modernization of traditional Chinese medicine and innovation of new drugs as a strategy of modern TCM research.
Jun-Chen-Zuo-Shi; Combinatorial Chemistry; Combination of Traditional Chinese Medicine Molecular Chemistry; research strategy of new drug
2015-06-10
国家重大科学仪器设备开发专项基金资助项目(2013YQ170525);长江学者和创新团队发展计划基金资助项目(IRT1174);陕西省重点科技创新团队计划基金资助项目(2013KCT-24)
R914
:ADOI:10.16152/j.cnki.xdxbzr.2015-03-012
