加拿大一枝黄花繁殖性状对其入侵性的影响
2015-02-27张海亮李干金
张海亮,朱 敏,李干金
(中国计量学院 生命科学学院,浙江 杭州 310018)

加拿大一枝黄花繁殖性状对其入侵性的影响
张海亮,朱 敏,李干金
(中国计量学院 生命科学学院,浙江 杭州 310018)
加拿大一枝黄花(SolidagocanadensisL.)是一种危害严重的外来入侵植物.为探究其强入侵性,明确繁殖特征在种群迅速扩散蔓延过程中的作用机理,测定了加拿大一枝黄花的开花动态与杂交指数、花粉胚珠比、花粉活力、结实率、单花花期以及访花昆虫等有性繁殖特性.结果表明,加拿大一枝黄花为头状花序,单株植物的头状花序数量为3 199.50±459.64,花序的中央管状花数量为3.57±0.86,边缘舌状花数量为9.30±2.14,单株植物具有产生4万多粒种子的潜能;种群花期一般为10—11月,其中单个花序的平均花期为(10.90±2.93)d,管状花具有活性的花粉比为(93.56±8.99)%,随着开花时间的增加保持基本稳定;加拿大一枝黄花的杂交指数、花粉胚珠比以及自交亲和性等结果表明其为兼性异交植物,蜜蜂(Apismellifora)是主要的传粉昆虫,在自然状态下加拿大一枝黄花的结实率高达78.51%.本研究从加拿大一枝黄花的繁殖特性较深入地分析了其种子量大和结实率高的原因,为研究加拿大一枝黄花的迅速扩散蔓延提供理论依据,也为其他菊科杂草种子的相关研究提供借鉴.
加拿大一枝黄花;入侵能力;繁殖特性;兼性异交
加拿大一枝黄花(SolidagocanadensisL.)是多年生草本植物,从北美引入我国后迅速逸生为恶性杂草,被列入我国第二批外来入侵物种名单[1].该物种在浙江省68个县(市)均有分布,其中杭州地区2005年的发生面积就达到了0.2万hm2,并呈现出进一步扩散的趋势[2-3].加拿大一枝黄花对入侵地的生物多样性、自然生态系统和经济社会均构成了严重的威胁,目前属于杭州地区危害最大的入侵性植物之一[4].
加拿大一枝黄花兼具无性和有性两种繁殖方式,它通过有性繁殖产生种子苗,以提高遗传多样性并建立新的种群,而领域的扩张则是由根茎苗的克隆生长来实现的[5-6].其种子具有数量多、质量轻、具冠毛等特性,有助于其脱离母株并实现长距离的风传扩散;同时,加拿大一枝黄花较高的种子结实率使其具有较高的发芽率和环境适应能力,这极大地增加了加拿大一枝黄花的入侵能力[7-9].而作为种子发育的起点,植物的繁育系统直接影响种子特性,对于物种的生存与竞争显得至关重要[10].
植物的繁育系统是多种多样的,从雌雄同体到雌雄异体,以及从自花授粉到专性的异花授粉[11-13].加拿大一枝黄花的繁育系统具有花序综合特性、开放式样、自交亲和性以及授粉模式等繁育系统,能够促进异花授粉,最大限制地减少有害突变的影响、保持种群的遗传多样性以及增强后代的潜在适应能力[14-16].这不仅降低了近亲繁殖种子的产生,而且增加成功繁衍的几率和保证产生足够的种子数量,提高加拿大一枝黄花入侵新生境的能力.
作为一种重要的外来入侵性植物,目前对于加拿大一枝黄花繁殖特性等相关研究并不全面,仅局限于花序上花粉与胚珠的活性和结实率等,缺乏对胚珠比、授粉模式以及自交亲和性等繁殖特性的相关研究[17-18].同时,也未深入探讨加拿大一枝黄花有性繁殖特性对其种群扩散能力的影响.本试验通过野外观测以及实验室检测等方法,对加拿大一枝黄花的花粉活力、胚珠比、自交亲和性、花期以及访花昆虫等有性繁殖特征进行详细研究,以期从繁育系统来明确加拿大一枝黄花的入侵能力及其庞大种子量的成因,并为早期预警和防控措施的制定提供科学依据.
1 研究地点与研究方法
1.1 研究地点自然概况
研究点位于浙江省杭州市中国计量学院网室旱地(30°19′N,120°21′E,海拔8~9 m),属钱塘江下游,原为滩涂荒地,是加拿大一枝黄花爆发最严重的区域之一.该地区冬温夏热、四季分明,降水丰沛,季节分配比较均匀,年平均气温介于13~20 ℃之间,年平均降水量一般在800~1 600 mm左右.主要的伴生杂草为春飞蓬(ErigeronphiladelphicusL.)、钻形紫菀(AstersubulatusMichx.)、苦苣菜(SonchusoleraceusL.)和芦苇(PhragmitesaustralisCav.)等.
1.2 研究方法
1.2.1 试验材料与测定时间
菊科植物的头状花序可认定为一朵单花,故试验材料为加拿大一枝黄花的头状花序.选用定殖三年以上且发育程度相对一致的加拿大一枝黄花自然种群,在单个花序尚未开放前开始试验.
花粉活力、花粉胚珠比与花期及种子成熟时间的测定时间为2010年的10月至11月;结实率数据重复两年,测定时间为2010年与2011年的10月至次年1月;访花昆虫的观测及捕捉在2010年与2012年的10月至11月间光照充足、气温高、风速小等适于访花昆虫活动的天气中进行.
1.2.2 开花动态与形态特征
观测加拿大一枝黄花的种群开花动态,随机选取6棵植株,测定总状花序的垂直高度与底部直径、平均单花总数和单花开放顺序.从各总状花序中随机选取出50朵单花,测定单花中管状花与舌状花的数量和颜色,观察柱头与花药的空间分布以及花蜜和气味的有无.
1.2.3 杂交指数(OCI)的估算
随机从5株加拿大一枝黄花的总状花序上选取50朵管状花已开放的单花,利用NIKON体视镜(SMZ1000型)测定单花直径,并观测管状花雌雄蕊的不同开放时间与空间高度差.按照Dafni等的标准,估算杂交指数,并由OCI值判定繁育系统类型[19].
1.2.4 花粉胚珠比
在5株加拿大一枝黄花的总状花序上各随机选取6朵单花,共30朵,在开花前采摘并放置于FAA固定液中带回实验室,取单花的全部花药用尖头镊子(SS-SA型)捣碎于一个1.5 mL的离心管中,用含有0.5%亚甲蓝染液的溶液定容至1 mL.在MS2 MiniShaker漩涡混匀器下震荡60 s后,用Research Plus单道可调量程移液器吸取20 μL的花粉液于载玻片上,在显微镜下统计玻片中的花粉数量,并在体视镜下观测单花的胚珠总数,每朵花重复三次.花粉胚珠比(P/O)为该单花的花粉总量与胚珠数量的比值,根据Cruden的标准可判断加拿大一枝黄花的繁育系统类型[20].
1.2.5 花粉活力
利用醋酸杨红染色法测定加拿大一枝黄花的花粉活力.随机选取10株处于盛花期的加拿大一枝黄花,在每个总状花序上标记10朵将要开放的单花,总计100朵.于开花后第1~13天,每天早上9点随机选取6朵单花,利用醋酸杨红染液制成花粉的染色玻片,统计玻片中被染成红色的花粉占总花粉数量的比例(即为花粉活力),每朵单花重复制作5张玻片,玻片中观察到的花粉总数需大于100.
1.2.6 自交亲和性
于2010年11月4日和2011年10月22日,种群处于盛花期时,分别挑选20株尚未开花的加拿大一枝黄花植株,其中10株在开花前1天用牛皮纸袋罩住整个花序,另外10株待花序枯萎且脱落种子前做同样的处理.待花序上种子完全成熟后,分别于2011年1月12日和2012年1月9日,将所有的纸袋采集回实验室,并统计各花序上种子的饱满度及数量.
1.2.7 单花花期与种子成熟时间
分别在10株植株的花序上随机标记70朵单花并编号,以单花中第一个花药开裂作为单花花期的起点,每24 h统计一次花序变化,以整个单花上全部管状花枯萎作为花期的终点.同时测定单花开花后,种子达到成熟并开始脱落所需时间.
1.2.8 访花昆虫
捕捉停留在加拿大一枝黄花头状花序上的访花昆虫,从早上8点开始,每隔一个小时用捕虫网捕捉一次,每次十分钟,至17点10分结束.将捉到的访花昆虫用乙酸乙酯制成的毒瓶处死后带回实验室制成干标本,利用显微镜观测标本上是否携带加拿大一枝黄花的花粉,并统计不同时间段内访花昆虫的种类与数量.
1.3 数据处理与统计
数据采用统计软件spss19.0对数据进行处理,花粉活力采用单因素方差分析(One-Way ANOVA: LSD Test);自交亲和性采用双因素方差分析(General Linear Model: S-N-K Test);花粉胚珠比、单花花期与种子成熟时间采用t检验测定样本平均数.
2 结果与分析
2.1 花序开花动态与形态特征
加拿大一枝黄花种群9月下旬开始现蕾,10月中下旬为盛花期,11月中旬后开花基本结束,11—12月种子开始陆续成熟.其总状花序的顶部率先开放,随后逐渐向底部蔓延.总状花序的垂直高度为10~20 cm、底部直径为5~15 cm.位于盛花期时,总状花序上的单花平均数量为3 199.50±459.64,且单花上边缘舌状花的数量为9.30±2.14,中央管状花数量为3.57±0.86.管状花呈鲜黄色,基部含有蜜腺,能够分泌蜜汁,在阳光直射下会产生清香气味.
2.2 杂交指数
加拿大一枝黄花的杂交指数为4,根据Dafni等的判定标准,加拿大一枝黄花的繁育系统为异交且需要传粉者.
2.3 花粉胚珠比
加拿大一枝黄花单花的平均胚珠数量为12.87±2.13,平均花粉总数为11 786.55±3 449.56,则花粉胚珠比为952.38±361.62.根据Cruden的判定标准,数据位于796.6±87.7至5 859.2±936.5之间,则加拿大一枝黄花属于兼性异交(表1).这与管状花中同时包含雌雄蕊的现象相吻合.
表1 加拿大一枝黄花的杂交指数与花粉胚珠比
Table 1 Outcrossing index and pollen-ovule ratio ofSolidagocanadensisL.

测量对象数值繁育系统类型头状花序直径2雌雄空间分离1雌雄时间分离1杂交指数4异交,部分自交新和,需要访花昆虫单花花粉总数11786.55±3449.56单花胚珠总数12.87±2.13花粉胚珠比952.38±361.62兼性异交
注:加拿大一枝黄花的头状花序直径为2.06±0.27 mm,记为2;管状花为两性花,雌雄异熟,记为1;柱头与花药空间分离,记为1.
2.4 花粉活力
加拿大一枝黄花的花粉活力随着开花时间的增加并没有显著降低(P>0.05),开花后第3天花粉活力最低,为84.31%.而高峰期为第4天至第11天,且在开花后的第10天花粉活力达到最大值为97.88%(图1).相比较与开花中后期,前3天的花粉活力较低,之后均维持在90%以上,且未出现下降的趋势.结果表明,加拿大一枝黄花具有花粉活力高且持续时间长等特点.
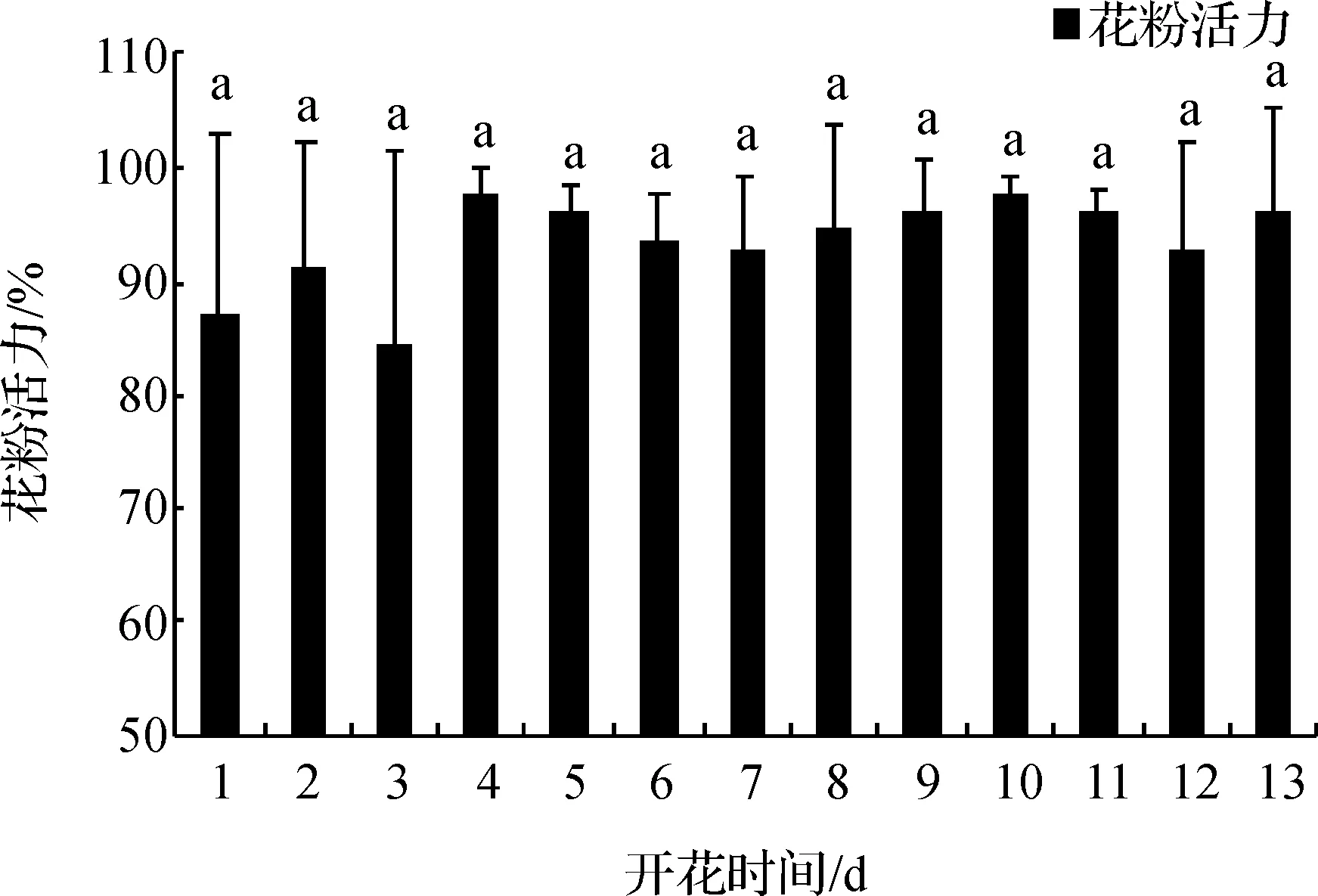
图1 加拿大一枝黄花的花粉活力变化Figure 1 Changes of pollen viability in Solidago canadensis L.注:小写字a母表示不同时间内花粉活力没有显著差异(P>0.05)
2.5 自交亲和性
自然状态下加拿大一枝黄花的平均结实率为(78.51±12.30)%,且自交不亲和.在开花前套袋处理下,几乎没有饱满的种子,2010年与2011年的结实率均为0%(图2).在自然对照处理下,2010年种子的结实率达到73.40%~88.60%,而2011年的种子结实率相对较低,为52.50%~87.01%.套袋自交处理能够显著降低种子的结实率(P<0.01),而自然状态下不同年份的种子结实率并没有显著性差异(P>0.05).实验结果表明,加拿大一枝黄花为异花授粉,这与通过胚珠比测定得出的结果一致.
2.6 单花花期与种子成熟期
试验观测发现管状花开裂前呈鲜黄色,逐渐膨大开裂成4瓣,并有花粉产生.同时,管状花的柱头开始迅速生长,之后展开成Y状,露出可授区.待授粉完成后,花柱开始枯萎,呈现黄褐色,从而完成一个开花周期,加拿大一枝黄花的单花花期为(10.90±2.93)d.此后,单花膨胀开裂,露出冠毛,种子逐渐干燥至成熟,观测结果表明单花开花后(28.93±5.20)d,种子达到成熟并开始脱落.
2.7 访花昆虫
加拿大一枝黄花为虫媒授粉植物,试验共捕捉到主要的访花昆虫10种(表2),分属于膜翅目(Hymenoptera)、鳞翅目(Lepidoptera)、双翅目(Diptera).2010年时,膜翅目昆虫的数量比双翅目昆虫多了42.22%,而在2012年时,双翅目昆虫的数量达到膜翅目昆虫的5.18倍,且鳞翅目昆虫的数量也较2010年有所增加.虽然双翅目昆虫的数量更多,但是试验观测发现其单花停留时间较长,大多为40 s~60 s,且胸部刚毛短直且稀疏,不能携带大量花粉.鳞翅目的蜜蜂(Apismellifora)是主要的传粉昆虫.蜜蜂在每朵单花上的停留时间较短,仅为3~19 s,访花频率且持续时间长,从上午9点到下午16点.
表2 三天内观测到加拿大一枝黄花植株上主要的访花昆虫种类与访花昆虫总数
Table 2 Observation of insect flower visitor density and insect orders onSolidagocanadensisunder 3 days
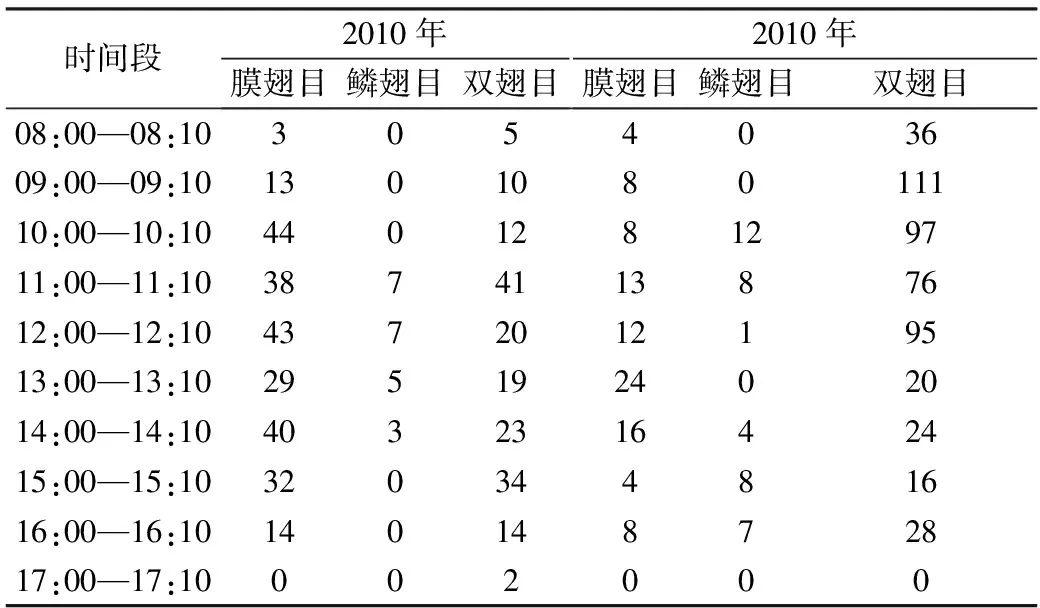
时间段2010年膜翅目鳞翅目双翅目2010年膜翅目鳞翅目双翅目08:00—08:10305403609:00—09:10130108011110:00—10:10440128129711:00—11:10387411387612:00—12:10437201219513:00—13:10295192402014:00—14:10403231642415:00—15:1032034481616:00—16:1014014872817:00—17:10002000
3 讨 论
繁殖是外来植物成功定殖和扩张的前提,物种本身具有的繁殖特征直接决定了入侵能力,并呈显著正相关[21-22].
首先,加拿大一枝黄花具有的强入侵性首先表现为种子量巨大,这与其花序数量密切相关.本研究发现其总状花序上的平均单花数量高达3 199.50±459.64朵,而每朵单花上的平均胚珠数量为12.87±2.13,表明单个植株均具有产生4万粒或更多种子的潜力.尽管本试验低于沈海超等在2006—2008年的测定结果,但均远高于Werner和Platt关于2万多粒的表述[23-24].这表明相比于原产地,加拿大一枝黄花更适宜在杭州地区生长.而巨大的种子量为该物种的远距离扩散及入侵提供了优势,能够保证足够多的种子到达新环境.
其次,高度自交不亲和也有利于增强加拿大一枝黄花的入侵能力.相比于自交亲和植物,异花授粉不仅能最大限度地减少有害基因突变,还能保持遗传的多样性以及提高后代的潜在适应性,所以大多数的入侵植物均为自交不亲和[25].本研究发现加拿大一枝黄花同时具有单雌的舌状花以及雌雄同蕊的管状花.舌状花率先开放,管状花在开裂的当天开始释放花粉,同时花柱迅速向上生长,使柱头的授粉区远离花药,雌雄蕊的时空异位可以有效避免植株的自交,有助于维护自交不亲和,增强其入侵性.同时自交不亲和促使加拿大一枝黄花的结实率高达78.51%,而较高的结实率保证了种子具备较广的环境适应范围与较高的萌发率,弥补建群初期由于种子数量缺乏带来的局限,并易形成“卫星式”种群,从而实现该入侵物种的快速扩散蔓延.
再者,花粉活力持续时间长.加拿大一枝黄花的单花花期为(10.90±2.93)d、花粉总数为11 786.55±3 449.56、胚珠总数为12.87±2.13、平均花粉活力为(93.56±8.99)%,且花粉活力能维持13 d.本试验结果与郝建华在对加拿大一枝黄花柱头与花粉活力的研究相似,均存在巨大的花粉数量以及能维持长时间的花粉活力与柱头活力[18].同时加拿大一枝黄花的管状花较小且位于单花的中央,蜜蜂的后足容易接触和附着到花粉.这不仅增加了受精几率,降低了恶劣天气对授粉昆虫访花行为的影响,而且提高了加拿大一枝黄花的结实率.
作为同属的菊科非入侵种,短葶飞蓬(Erigeronbreviscapus)单花数量少,平均花粉数量仅为加拿大一枝黄花的11.65%,单花开放持续时间短暂,限制了其生长[26].通过对比短葶飞蓬发现加拿大一枝黄花具有的花序数量多、高度自交不亲和、花期持续长以及存在高效访花昆虫等繁殖特性极大地增强了其入侵能力.目前,国内外针对加拿大一枝黄花繁育系统的相关描述并不全面,仅局限于花粉活力与单花花期等,且并未深入探讨繁殖特性对其入侵能力的影响[18,27].
通过观测加拿大一枝黄花的繁育系统,本研究发现其趋向于产生数量多、结实率高的种子.结合风媒扩散的特性,加拿大一枝黄花在扩张过程中容易形成单一的优势物种,并存在大规模扩散的潜力.故在与其他物种竞争的过程中,加拿大一枝黄花具有明显的优势和强大的入侵能力.由于本研究仅探讨了加拿大一枝黄花的有性繁殖系统,未涉及无性繁殖对入侵性的影响,因此对该物种的入侵及扩散机制还有待于进一步的研究.本研究有助于深入了解外来入侵植物加拿大一枝黄花的有性繁殖特性及其对种群入侵能力的影响,为探讨加拿大一枝黄花的强入侵性提供了科学依据.
[1] 董梅,陆建忠,张文驹,等.加拿大一枝黄花——一种正在迅速扩张的外来入侵植物[J].植物分类学报,2006,44(1):72-85. DONG Mei, LU Jianzhong, ZHANG Wenju, et al. Canada goldenrod (Solidagocanadensis): an invasive alien weed rapidly spreading in China[J].Acta Phytotaxonomica Sinica,2006,44(1):72-85.
[2] 徐正浩,陈为民,蔡国强.杭州地区外来入侵生物的鉴别特征及防治[M].杭州:浙江大学出版社,2008:9.
[3] 闫小玲,寿海洋,马金双.浙江省外来入侵植物研究[J].植物分类与资源学报,2014,36(1):77-88. YAN Xiaoling, SHOU Haiyang, MA Jinshuang. The alien invasive plants in Zhejiang Province, China[J].Plant Diversity and Resources,2014,36(1):77-88.
[4] 雷军成,徐海根.基于MaxEnt的加拿大一枝黄花在中国的潜在分布区预测[J].生态与农村环境学报,2010,26(2):137-141. LEI Juncheng, XU Haigen. MaxEnt-based prediction of potential distribution ofSolidagocanadensisin China[J].Journal of Ecology and Rural Environment,2010,26(2):137-141.
[5] 郭水良,方芳.入侵植物加拿大一枝黄花对环境的生理适应性研究[J].植物生态学报,2003,27(1):47-52. GUO Shuiliang, FANG Fang. Physiological adaptation of the invasive plant Solidaga canadensis to environments[J].Acta Phytoecologica Sinica,2010,26(2):137-141.
[6] 黄华.外来入侵植物加拿大一枝黄花生态适应性研究[D].金华:浙江师范大学,2006. HUANG Hua. Studies on ecological adaptability of invasive plantSolidagocanadensis[D].Jinhua: Zhejiang Normal University,2006.
[7] 郭强,朱敏,徐勒,等.五种杂草种子沉降速度[J].生态学杂志,2008,27(4):519-523. GUO Qiang, ZHU Min, XU Le, et al. Seed settlement velocity of five weed species[J].Chinese Journal of Ecology,2008,27(4):519-523.
[8] 张海亮,朱敏,李干金.影响加拿大一枝黄花种子非随机脱落的因素[J].植物生态学报,2015,39(3):258-263. ZHANG Hailiang, ZHU Min, LI Ganjin. Factors influencing the nonrandom abscission ofSolidagocanadensisseeds[J].Chinese Journal of Plant Ecology,2015,39(3):258-263.
[9] 黄华,郭水良.外来入侵植物加拿大一枝黄花繁殖生物学研究[J].生态学报,2005,25(11):2795-2803. HUANG Hua, GUO Shuiliang. Study on reproductive biology of the invasive plantSolidagocanadensis[J].Acta Ecologica Sinica,2005,25(11):2795-2803.
[10] 谢联辉,尤民生,侯有明.生物入侵——问题与对策[M].北京:科学出版社,2011:3.
[11] 周兵,闫小红,肖宜安,等.外来入侵植物美洲商陆的繁殖生物学特性及其与入侵性的关系[J].生态环境学报,2013,22(4):567-574. ZHOU Bing, YAN Xiaohong, XIAO Yian, et al. Traits of reproductive biology associated with invasiveness in alien invasive plant Phytolacca americana[J].Ecology and Environmental Sciences,2013,22(4):567-574.
[12] 何燕红,董淼,马爽,等.孔雀草的开花特性与繁育系统[J].华中农业大学学报,2015,34(2):9-15. HE Yanhong, DONG Miao, MA Shuang, et al. Flowering characteristics and breeding system of Tagetes patula[J].Journal of Huazhong Agricultural University,2015,34(2):9-15.
[13] RUGGIERO M V, CAPONE S, PIROZZI P, et al. Mating system and clonal architecture: a comparative study in two marine angiosperms[J].Evolutionary Ecology,2005,19(5):487-499.
[14] LAFUMA L, MAURICE S. Increase in mate availability without loss of self-incompatibility in the invasive speciesSenecioinaequidens(Asteraceae)[J].Oikos,2007,116(2):201-208.
[15] IKEGAMI M, WHIGHAM D F, WERGER M J A. Ramet phenology and clonal architectures of the clonal sedgeSchoenoplectusamericanus(Pers.) Volk. ex Schinz & R. Keller[J].Plant Ecol,2009,200(2):287-301.
[16] KAMEYAMA Y, KUDO G. Flowering phenology influences seed production and outcrossing rate in populations of an alpine snowbed shrub, Phyllodoce aleutica: effects of pollinators and self-incompatibility[J].Annals of Botany,2009,103:1385-1394.
[17] FERRER M M, GOOD-AVILA S V. Macrophylogenetic analyses of the gain and loss of self-incompatibility in the Asteraceae[J].New Phytologist,2007,173(2):401-414.
[18] 郝建华,钱海军,强胜,等.加拿大一枝黄花的开花动态及柱头与花粉活力[J].南京农业大学学报,2010,33(6):63-67. HAO Jianhua, QIAN Haijun, QIANG Sheng, et al. Flowering phenology, stigma receptivity and pollen viability inSolidagocanadensisL.[J].Journal of Nanjing Agricultural University,2010,33(6):63-67.
[19] DAFNI A. Pollination Ecology: a Practical Approach[M].Oxford: Oxford University Press,1992:1-57.
[20] CRUDEN R W. Pollen-Ovule Ratios: a conservative indicator of breeding systems in flowering plants[J].Evolution,1977,31(1):32-46.
[21] 郝建华,刘倩倩,强胜.菊科入侵植物三叶鬼针草的繁殖特征及其与入侵性的关系[J].植物学报,2009,44(6):656-665. HAO Jianhua, LIU Qianqian, QIANG Sheng. Reproductive traits associated with invasiveness inBidenspilosa(Asteraceae)[J].Chin Bull Bot,2009,44(6),656-665.
[22] 曾建军,肖宜安,孙敏.入侵植物剑叶金鸡菊的繁殖特征及其与入侵性之间的关系[J].植物生态学报,2010,34(8):966-972. ZENG Jianjun, XIAO Yian, SUN Min. Reproductive traits associated with invasiveness inCoreopsislanceolata[J].Chinese Journal of Plant Ecology,2010,34(8):966-972.
[23] 沈海超,朱敏,诸葛晓龙,等.种群密度对加拿大一枝黄花生长与繁殖的影响[J].生态学杂志,2010,29(7):1295-1300. SHEN Haichao, ZHU Min, ZHUGE Xiaolong, et al. Growth and reproductive characteristics ofSolidagocanadensiswith different population densities[J].Chinese Journal of Ecology,2010,29(7):1295-1300.
[24] WERNER P A, PLATT W J. Ecological relationships of co-occurring goldenrods (Solidago:Compositae)[J].American Naturalist,1976,110(976):959-971.
[25] RAMBUDA T D, JOHNSON S D. Breeding systems of invasive alien plants in South Africa: does Baker’s rule apply?[J].Diversity and Distributions (Diversity Distrib),2004,10(5,6):409-416.
[26] 李鹂,党承林.短葶飞蓬(Erigeron breviscapus)的花部综合特征与繁育系统[J].生态学报,2007,27(2):571-578. LI Li, DANG Chenglin. Floral syndrome and breeding system ofErigeronbreviscapus[J].Acta Ecologica Sinica,2007.27(2):571-578.
[27] WERNER P A, GROSS R S, BRADBURY I K. The biology of canadian weeds: 45.SolidagocanadensisL.[J].Canadian Journal of Plant Science,1980,60(4):1393-1409.
Impact of reproductive traits on the invasive ability ofSolidagocanadensisL.
ZHANG Hailiang, ZHU Min, LI Ganjin
(College of Life Sciences, China Jiliang University, Hangzhou 310018, China)
SolidagocanadensisL. is one of the most important invasive weeds causing serious threats to native plants. In order to explore the flower characteristics and the reproductive system of S.canadensisnatural populations, the flowering dynamics of inflorescence, the outcrossing index, the pollen-ovule ratio, the pollen viability, the seed set percentages, the florets flowering time and the visiting insects of S.canadensisL. were observed. Results showed that the average number of S.canadensiscapitulum per ramet was 3199.50±459.64, and the inflorescence central tubiform floret number was 3.57±0.86, and the margin ligulate flower number was 9.30±2.14. The flowering time of population was from October to November, of which the average flowering period of a single inflorescence was (10.90±2.93) d. The average pollen viability of an individual inflorescence tubiform floret was (93.56±8.99) %, and did not decrease with the increasing of the flowering time. The outcrossing index of S.canadensiswas 4 which indicated that it belonged to the cross-pollinate plants and needed pollinators during pollination. The pollen-ovule ratio was approximately 952.38±361.62, indicating that theS.canadensisbreeding system was facultative xenogamy. The most common floral visitors were bee species. These results suggest that the breeding system traits ofS.canadensishave the potential to produce a huge amount of seed numbers, and can be carried away by wind for long distance dispersal. Thus, it increases the invasion potential ofS.canadensisin China.
SolidagocanadensisL.; invasiveness; reproductive traits; facultative xenogamy
1004-1540(2015)03-0324-07
10.3969/j.issn.1004-1540.2015.03.014
2015-04-13 《中国计量学院学报》网址:zgjl.cbpt.cnki.net
国家自然科学基金资助项目(No.30771434),浙江省公益性技术应用研究计划项目(No.2010C34003).
张海亮(1989- ),男,浙江省常山人,硕士研究生,主要研究方向为植物入侵生态学.Email:229160671@qq.com 通讯联系人:朱 敏,女,副教授.Email:minzhu@cjlu.edu.cn
Q948.1
A
