光照强度对长春花生活史形成和光合作用的影响
2015-02-27高扬王永勖樊梓鸾王振宇唐中华
高扬,王永勖,樊梓鸾,王振宇,唐中华
(1.吉林市林业科学研究院,吉林吉林132013;2.东北林业大学林学院,哈尔滨150040;3.哈尔滨工业大学食品科学与工程学院,哈尔滨150090;4.东北林业大学,哈尔滨150040)
光照强度对长春花生活史形成和光合作用的影响
高扬1,王永勖1,樊梓鸾2,王振宇3,唐中华4
(1.吉林市林业科学研究院,吉林吉林132013;2.东北林业大学林学院,哈尔滨150040;3.哈尔滨工业大学食品科学与工程学院,哈尔滨150090;4.东北林业大学,哈尔滨150040)
长春花是重要的药用植物,广泛栽植于热带和亚热带地区,其次生代谢产物文多灵、长春碱,长春质碱等可治疗多种癌症。如果可以通过调节光照来达到不同的生产目的,将对生产实践具有重要意义。实验分3个强度光照培养长春花,分别为100 μmol/m2·s、500μmol/m2·s和900μmol/m2·s,运用主成分分析法(PCA),对营养生长、有性生长和无性繁殖3类15种性状进行统计,结果表明:不同光照强度对长春花生活史型的调控作用十分明显,其生活史型随着光照强度的减弱,由VS转变为VC,体现了植物能量的内部循环。光合数据结果表明,嫩叶主要利用强光,老叶主要利用弱光,使植物充分利用不同生境下的光照,以保证生存。
长春花;生活史型;主成分分析
植物生活史又称植物生活周期,是指植物在一生中所经历的以细胞分裂、细胞增殖、细胞分化为特征,最终产生与亲代基本相同的子代的生殖、生长和发育的循环过程。一个典型的植物生活史包括植物的营养生长、有性生殖和无性生殖3个基本阶段,其保障是能量的供应与分配,其实质是子代从亲代获得一套完整包含子代生长发育所需的全部遗传新的DNA,由此实现植物延续后代的基本目的[1]。
长春花[Catharanthusroseus(L.)G. Don],属于夹竹桃科(Apocynaceae)长春花属(CatharanthusG. Don)。直立多年生草本或亚灌木状。其次生代谢产物长春碱、长春新碱、文多灵有抗癌作用。本实验研究光照对长春花生活史型的影响,期望对生产实践起到指导作用。
1 材料与方法
以温室内培育70天的长春花为实验材料,在平均光照强度分别为100μmol/m2·s、500μmol/m2·s和900μmol/m2·s(光照时间6:00~19:00,温度为28℃(昼)/20℃(夜),湿度60%),人工气候箱中培养四周后,对长春花植株进行生活史性状参数测定。
光合数据由LI-6400测定,光补偿点(LCP, μmol photons/m2·s)、光饱和点(LSP, μmol photons /m2·s)、最大净光合速率等重要参数由下面公式得出:
Pn=P1×(1-e-P2×(PPFD-P3))
其中,P1为光饱和时的光合速率,即最大净光合速率;P2为常数;Pn是实际测定的光合速率;PPFD是指光量子同量密度(photosynthetic photon flux density, μmol/m2·s);P3是光补偿点;e为自然对数。光饱和点按净光合速率为最大净光合速率的90%时的光合有效辐射求得。
2 结果与分析
2.1 数据的标准化处理
对数据首先进行标准化处理,消除量纲,按营养生长、有性生长和无性生长将长春花形态性状分为3类,分别测定如植株高度、基径、节间长等15个主要数量指标,结果见表1。

表1 不同光照强度对长春花生活史型形成的影响
2.2 生活史主成分提取和分析
应用SPSS12.0按照主成分提取与分析的方法,对其营养生长、有性繁殖和无性繁殖性状进行主成分分析,第一主成分特征值均大于1,主分量得分系数见表2。
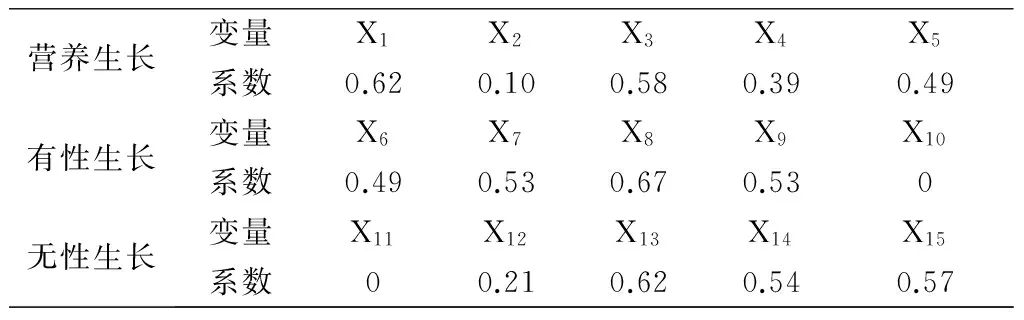
表2 长春花在不同生活史性状上主成分向量系数矩阵
根据主分量得分系数,分别计算出不同类型长春花在营养生长、有性生殖和无性生殖的主成分得分,结果见表3。主成分结果见图1。
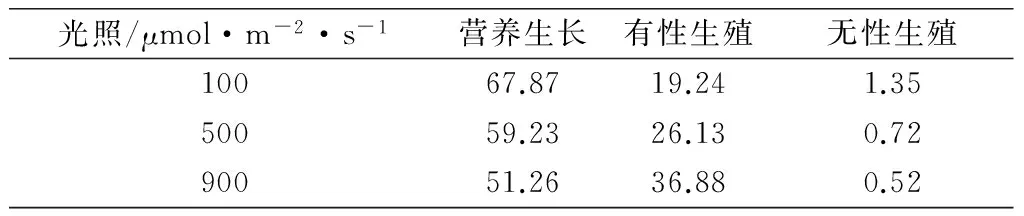
表3 不同类型长春花在不同生活史阶段的主成分结果
经过主分量归一化结果,得到100μmol/m2·s V0.6787S0.1924C0.0135,500μmol/m2·s V0.5923S0.2613C0.0072,900μmol/m2·s V0.5126S0.3688C0.0052。可以看出,光照强度改变后长春花植株内有性生殖和无性生殖的比例有了较为明显的增加。光照强度减弱后长春花内部能量分配格局起了变化,从原来以营养生长的VS生活史型向VC生活史型过渡。
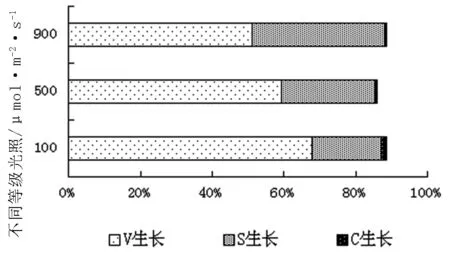
图1 长春花不同光照条件下主分量综合得分
2.3 不同光照对长春花的光合与呼吸作用
2.3.1 不同龄级叶片的光响应曲线。叶龄不同对外界光响应敏感程度具有显著的差异。本实验测定了100、500、900μmol/m2·s光照条件下,长春花嫩叶和老叶的光响应曲线(图2)。
由图2可以看出,嫩叶光合作用与光照强度呈正相关,光补偿点和光饱和点均较高。提高光照强度能显著提高长春花未成熟叶片的光合水平。而老叶的光合作用与光照强度呈负相关,光补偿点和饱和点接近,可能由于其电子传递链的老化和较低的羧化效率而趋向于利用低光照。这可能是植物适应不同光照强度的一种生理机制。

图2 幼嫩和成熟叶片在不同光照条件下的光响应曲线
2.3.2 光合作用相关数据及气孔显微结构。不同光照下长春花最大净光合速率、呼吸和气孔导度数据如图3。
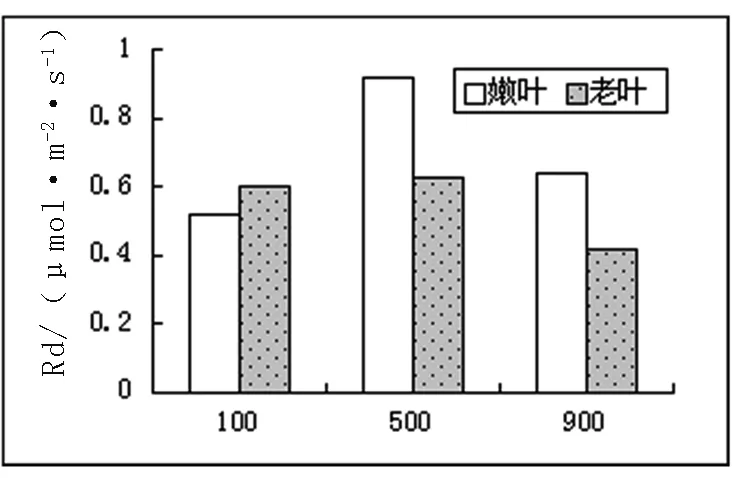
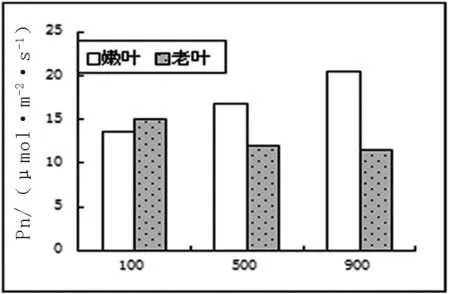
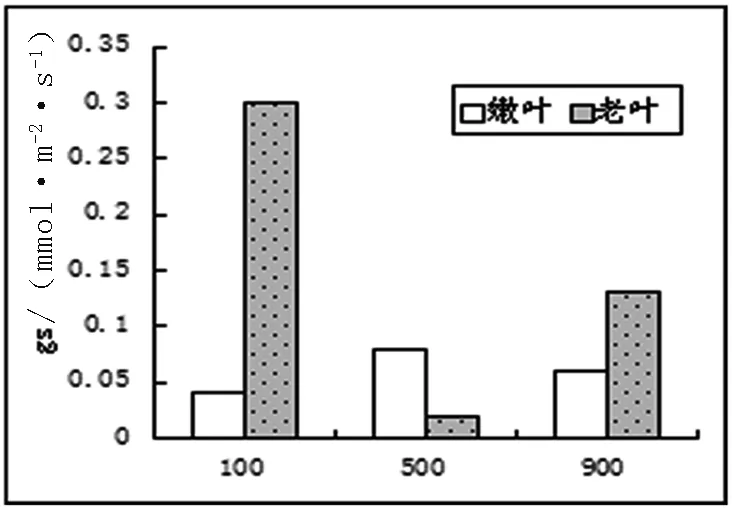
图3 不同光照下长春花光合、呼吸、气孔导度图
从图3中可以看出,最大净光合速率中,嫩叶速率与光照强度成正比,而老叶则成反比。这和以前的研究成果,不同发育阶段的叶片能吸收和利用不同光质和光强,所以衰老叶片也被称为阴生叶,主要利用弱光,而幼嫩叶片主要利用强光。这样有助于植物充分适应不同生境下光照条件[2]相一致。呼吸试验中嫩叶在500μmol/m2·s条件下,达到最大,其气孔导度也达到最大。老叶的呼吸作用随光照强度增强而降低,气孔导度在弱光下最大,进一步说明衰老叶片适应低光照的能力较强。
3 讨论
用主成分分析法计算出3个光照条件下长春花生活史型分别为100μmol/m2·s V0.6787S0.1924C0.0135,500μmol/m2·s V0.5923S0.2613C0.0072,900μmol/m2·s V0.5126S0.3688C0.0052,可以看出,光照强度对长春花生活史型的调控作用十分明显。低光照下,长春花主要将能量集中在营养生长和无性生长,保证植株的存活。同时减弱光照强度可诱导积累生物碱,从而增加植物组织中生物碱的含量[3-4]。随着光照强度的增加,植物叶片保卫细胞膨压下降气孔关闭[5-6],植物所需的二氧化碳无法满足,致使光合作用下降或停止[7-8],而可溶性糖开始积累,可溶性糖,包括蔗糖、葡萄糖和果糖,在叶片中大量积累可能与提高保水能力、增加抗性有关,同时还能作为能量供应物质和信号分子促进有性繁殖[9]。而实验结果S型比例上升验证了这个结论。
这对生产实践有一定的指导作用,如果想得到更多的种子可以适当的增强光照,从代谢产物的角度来讲,低光照是一种胁迫,有利于长春花体内的次生代谢产物文多灵、长春碱、长春质碱等抗癌成分的积累;如果想增加其含量,可考虑适当减弱光照强度。
[1]祖元刚,王文杰,杨逢建,等.植物生活史型多样性及其动态研究[J],生态学报,2002,22(11):1811-1818.
[2]阎秀峰,王洋,尚辛亥,等,光强和光质对野外栽培高山红景天生物量和红景天甙含量的影响[J].生态学报,2004,24(4):647-679.
[3]Haegele B F,Rowell R M.Genetic and environ mental based variability in secondary metabolite leaf content of Adenostyles alliariae and A.alpina(Asteraceae).Atest of there source avail ability hypothesis[J].Oikos,1999,85(2):234-246.
[4]SalmoreAK,HunterMD.Environmental and genotypic influence sonisoquino line alkaloid contentin Sanguinaria canadensis[J]. Journal of Chemical Ecology,2001,27(9):1729-1747.
[5]Wong S C, Cowan I R, Farquhar G D. Stomatal conductance correlates with photosynthetic capacity. Nature, 1979, 282(5737): 424-426.
[6]Parida K A, Jha B. Salt tolerance mechanisms in mangroves: a review. Trees-Structure and Function, 2010, 24(2): 199-217.
[7]Gama P B S, Inanaga S, Tanaka K, Nakazawa R. Physiological response of common bean (PhaseolusvulgarisL. ) seedlings to salinity stress.African Journal of Biotechnology, 2007, 6(2): 79-88.
[8]MullerB, Pantin F, G nard M, Turc O, Freixes S, Piques M, Gibon Y. Water deficits uncouple growth from photosynthesis, increase C content,and modify the relationships between C and growth in sink organs. Journal of Experimental Botany, 2011, 62(6): 1715-1729.
[9]Masaaki O and Kryoshi O. Effects of sugar on Vegetative Development and Floral Transition in Arabidopsis. Plant Physiol ,2001,127:252-261.
Effect of Different Light Intensity on Life Cycle forms and Photosynthesis ofCatharanthusroseus
Gao Yang1*, Wang Yongxu1, Fan Ziluan2, Wang Zhenyu3, Tang Zhonghua4
(1.Research Institute of Forestry Science Jilin City, Jilin 132013;2.School of Forestry, Northeast Forestry University,Harbin 150040; 3.School of Food Science and Engineering,Harbin Institute of Technology,Harbin 150090;4.Northeast Forestry University; Harbin 150040)
Catharanthusroseuscan be used as medicine,Its secondary metabolites such as vindoline, vinblastine can be used to cure various cancers. It would be important for production if we can be by adjusting the illumination to achive diffrent purposes of production. The experiment was divided into three intensity of light cultureCatharanthusroseus, respectively 100μmol/m2·s,500μmol/m2·s and 900μmol/m2·s,the results show that the control effects of different light intensity on the life history ofCatharanthusroseustype is obvious, its life cycle forms with the reduction of light intensity, changes from VS for the VC, embodies the plant energy internal circulation.The photosynthetic data results show that young leaves use of bright light, old leaves use of weak light, make full use of light plants under different habitats in order to ensure survival.
Catharanthusroseus; Life cycle forms; PCA
2015-01-20
国家自然科学基金项目(31170510)
高扬(1981-),女,硕士,工程师,从事森林培育方面的研究工作,E-mail: hjgly36@126.com。
Q948.1;Q945.11
A
DOI.:10.13268/j.cnki.fbsic.2015.03.001
