葛根素抑制人成骨样MG-63细胞分泌IL-6的分子机制研究
2015-02-26李乐飞郭小芹张立朋韩泽民
罗 婷,李乐飞,郭小芹,张立朋,王 越,李 玲,韩泽民
(1.辽宁医学院武警后勤学院附属医院研究生培养基地,辽宁锦州 121000;2.武警后勤学院病原生物和免疫学教研室,天津 300309;3.武警后勤学院药理学教研室,天津 300309;4.武警后勤学院附属医院口腔教研室,天津 300162)
葛根素抑制人成骨样MG-63细胞分泌IL-6的分子机制研究
罗 婷1,李乐飞1,郭小芹2,张立朋2,王 越2,李 玲3,韩泽民4
(1.辽宁医学院武警后勤学院附属医院研究生培养基地,辽宁锦州 121000;2.武警后勤学院病原生物和免疫学教研室,天津 300309;3.武警后勤学院药理学教研室,天津 300309;4.武警后勤学院附属医院口腔教研室,天津 300162)
中国图书分类号:R284.1;R329.24;R392.12
摘要:目的 研究葛根素(puerarin)抑制人成骨样MG-63细胞分泌IL-6的分子机制。方法 利用兼有两种雌激素受体(estrogen receptor,ER)亚型表达的人成骨样MG-63细胞为研究模型,通过ELISA、RT-PCR、荧光素酶报告基因检测、小RNA干扰等方法,研究葛根素对MG63细胞产生骨吸收调节因子IL-6的作用及作用机制。结果 葛根素可明显抑制MG-63细胞IL-6表达和IL-6基因启动子的转录活性,并且该作用可被纯ER阻断剂ICI 182,780部分阻断。采用小RNA干扰技术进一步证明葛根素对成骨细胞的上述作用是ERα依赖的。结论 葛根素调节人成骨细胞产生IL-6主要是ERα依赖的。
关键词:葛根素;人成骨细胞;白细胞介素-6;雌激素受体α;雌激素受体β;小RNA干扰技术
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.020.html
近年来,口腔种植技术发展迅速,并已经成熟为目前口腔医学领域的一门前沿学科。种植修复对于骨量和骨质要求高,因而骨质疏松被认为是种植成功与否的重要因素。骨质疏松症是一种以骨量低下、骨显微结构破坏为特征,导致骨脆性增加、易发生骨折的全身性骨病[1]。该病已成为影响老年人健康及生活质量的严重问题。骨组织是通过成骨细胞和破骨细胞的偶联活动完成自我更新和重建。在正常生理状态下,骨吸收和骨形成保持平衡。绝经后,妇女雌激素水平下降,骨吸收大于骨形成,从而发生骨量丢失导致骨质疏松症,因此,大量的雌激素缺乏被认为是绝经后骨质疏松症的主要原因。雌激素替代治疗一度成为治疗绝经后骨质疏松的首选,但雌激素的选择性差,长期使用可增加子宫内膜癌和乳腺癌发病的危险性[2]。故寻找防治绝经后骨质疏松症有效且副作用小的药物,成为了目前研究的热点和难点。
葛根系豆科植物野葛或甘葛藤的干燥根,从中提取的单体异黄酮化合物即葛根素(puerarin)。葛根素具有减慢心率、降低血压、扩张血管等作用,临床上多于心绞痛、高血压、脑梗死和脑供血不足的治疗[3-4]。本课题组前期工作发现,葛根素能明显促进人成骨样细胞的增殖和分化[5-6]。在前期工作基础上,本文以人成骨样MG-63细胞为研究模型,该细胞具有特征性的成骨细胞功能,并同时表达雌激素受体(estrogen receptor,ER)α、β[7],研究葛根素对MG63细胞产生骨吸收调节因子IL-6的作用及作用机制。本文结果将为探讨植物雌激素对成骨细胞的作用机制及临床应用植物雌激素治疗骨质疏松症奠定基础,也为把骨质疏松症拓为口腔种植的适应证而寻求理论依据。
1 材料与方法
1.1主要试剂 葛根素购自中国药品生物制品检定所;DMEM高糖培养基、活性碳处理的FBS(sF-BS)为美国Gibco公司产品;胎牛血清(FBS)为中美合资兰州民海生物工程有限公司产品;TRIzol Rea-gent为美国Invitrogen公司产品;2×PCR Mixture、2 ×Premix Taq为TaKaRa公司产品;质粒DNA小量纯化试剂盒、100 bp DNA Ladder Marker为北京天根生物工程公司产品;重组人IL-6、人IL-6 ELISA试剂盒为美国R&D公司产品;M-MLV Reverse Tran-scriptase、荧光素酶检测试剂盒为美国Promega公司产品;17-β雌二醇(17β-estradiol,E2)、纯ER阻断
剂ICI 182,780、PMA(phorbol 12-myristate 13-ace-tate)及ONPG均为美国Sigma公司产品。
1.2细胞系和细胞培养 人成骨样细胞系MG-63购自武汉大学中国典型培养物保藏中心。该细胞用含10%FBS的DMEM高糖培养基培养,该培养基中含有100 mg·L-1链霉素和100 kU·L-1青霉素。
1.3细胞转染和ERα、ERβ基因沉默稳定细胞克隆的建立 按照LipofectamineTM2000的说明书进行,分别将pGenesil-ERα shRNA、pGenesil-ERβ shR-NA和pGenesil-scrambled shRNA载体转染至MG-63细胞,经G418加压筛选建立MG-63/ERα shRNA、MG-63/ERβ shRNA和MG-63/scrambled shRNA稳定低表达ERα或ERβ的细胞株[8]。
1.4质粒 SV40-β gal是一种带有β-半乳糖苷酶报告基因的质粒,其上游亦含有SV40病毒的早期启动子,作为内标测量荧光素酶的表达,消除转染效率不同造成的样本之间的差异,由本实验室保存。pGL2-IL6p(-1200)是一种带有荧光素酶报告基因的质粒,其上游含有长约1 200 bp的IL-6基因启动子,由美国Michigen大学Evan T Keller教授惠赠。
1.5药物处理细胞 取对数生长期的MG-63细胞,培养24 h待细胞贴壁后,更换含有1%FBS DMEM高糖培养基培养24 h,使细胞同步化。然后加入不同终浓度的葛根素(0.01、0.1、1 μmol· L-1)、E2(0.1 μmol·L-1)或DMSO处理,各浓度设置3个平行孔,37℃、5%CO2培养箱内作用48 h。
1.6ELISA检测IL-6 在6孔板中各孔加入细胞悬浮液2 mL(2.5×108·L-1),按“1.5”的方法处理细胞后,收集培基上清,按照ELISA试剂盒说明书检测培基上清中IL-6的含量。
1.7RT-PCR反应 在6孔板中各孔加入细胞悬浮液2 mL(2.5×108·L-1),按“1.5”的方法处理细胞后,先提取RNA,然后逆转录后进行RT-PCR反应。逆转录反应条件参照M-MLV逆转录酶说明书进行,引物序列β-actin、IL-6如文献[9]所述。PCR反应体系:上、下游引物各10 pmol,2×Premix Taq 10 μL,cDNA 1.0 μL,加双蒸水至总体积20 μL。PCR反应条件:94℃5 min预变性;94℃30 s变性,59℃45 s退火,72℃1 min延伸,34个循环;72℃延伸10 min。逆转录结束后,取PCR反应液5 μL于12 g·L-1琼脂糖凝胶电泳。结果以β-actin作为内参照,以靶基因/β-actin光密度的比值作为mRNA的相对表达丰度,进行半定量检测。应用Bio-Rad公司的Quantity One软件进行分析。
1.8细胞瞬时转染和荧光素酶报告基因的检测按照LipofectamineTM2000的说明书将SV40-β gal和pGL2-IL6p(-1200)共转染至MG-63细胞。转染24 h后,按“1.5”的方法处理细胞,收集细胞裂解液,分别测定β-半乳糖苷酶及荧光素酶活性,用二者之比作为荧光素酶的相对活性。
1.9ICI 182,780预处理细胞 同“1.5”所示的方法,区别在于取葛根素的剂量为0.1 μmol·L-1。先加入终浓度为100 μmol·L-1的ER阻断剂ICI 182,780,37℃作用30 min,然后再加入葛根素。并且设立ICI 182,780对照组。
1.10统计学分析 采用SPSS 13.0统计软件进行实验数据处理。各组间比较采用单因素方差分析(One-Way ANOVA)。采用GraphPad Prism 5软件进行资料图表处理。
2 结果
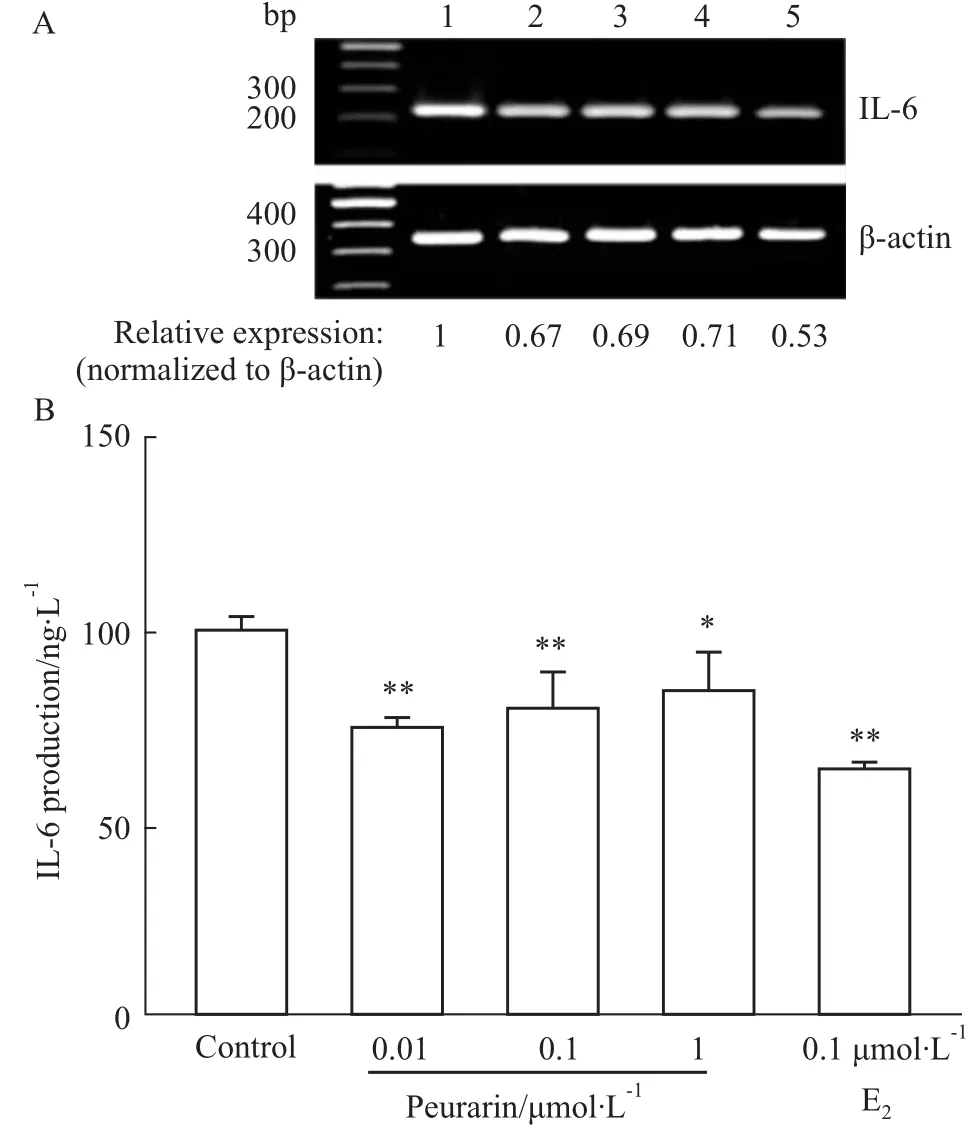
Fig 1 Effect of puerarin on IL-6 expression in MG-63 cells
2.1葛根素对MG-63细胞IL-6基因和蛋白表达的抑制作用 由Fig 1所示,与对照组相比,葛根素处理组(0.01、0.1、1 μmol·L-1)IL-6 mRNA表达水平分别降低了约33%、31%和29%(Fig 1A),相应的蛋白表达水平分别下降约29%、15%和6% (Fig 1B)。而E2(0.1 μmol·L-1)也能明显抑制MG-63细胞IL-6 mRNA和蛋白的表达水平。上述
结果提示,作为一种植物雌激素,葛根素可抑制成骨细胞骨吸收因子IL-6基因和蛋白的表达,其作用效果与E2类似。
2.2葛根素对MG-63细胞IL-6基因启动子转录活性的影响 为进一步探讨葛根素是否通过影响MG-63细胞IL-6基因启动子转录活性而抑制IL-6基因和蛋白的表达,我们将质粒pGL2-IL6p(-1200)转染入MG-63细胞,经PMA刺激后,观察葛根素对IL-6基因启动子转录活性的作用。Fig 2显示,不同浓度葛根素和E2(0.1 μmol·L-1)均能明显抑制PMA诱导的IL-6基因启动子的转录活性。实验结果表明,葛根素和E2通过抑制成骨样细胞IL-6基因启动子转录活性而下调IL-6基因和蛋白的表达。
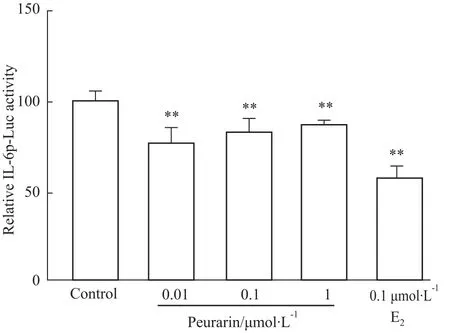
Fig 2 Effect of puerarin on IL-6 promoter activation in MG-63 cells
2.3ICI 182,780对葛根素抑制MG63细胞IL-6表达及其基因启动子转录活性的影响 为了研究葛根素对成骨细胞的上述作用是否由ER通路介导,先用ER阻断剂ICI 182,780(100 μmol·L-1)处理MG-63细胞30 min,然后加入葛根素(0.1 μmol· L-1)。而后分别采用RT-PCR和ELISA检测IL-6 mRNA和蛋白表达水平。结果发现,葛根素能明显抑制MG-63细胞IL-6 mRNA(Fig 3A)和蛋白(Fig 3B)表达水平,而ICI 182,780可部分阻断葛根素对IL-6的抑制作用,ICI 182,780本身对IL-6的表达水平影响不大。
此外,本文还研究了ICI 182,780对葛根素抑制MG63细胞IL-6基因启动子转录活性作用的影响。Fig 4显示,ICI 182,780亦可部分阻断葛根素对PMA刺激的IL-6基因启动子转录活性的抑制作用,同样,ICI 182,780本身对IL-6基因启动子转录活性作用不明显。该结果表明,葛根素通过调控IL-6基因启动子转录活性,从而抑制IL-6基因和蛋白的表达,这一作用是ER途径介导的。

Fig 3 Puerarin-inhibited osteoblastic IL-6 expression is blocked by the ER antagonist ICI 182,780

Fig 4 Puerarin-inhibited osteoblastic IL-6 promoter activation is blocked by the ER antagonist ICI 182,780
2.4葛根素对成骨细胞IL-6表达的抑制作用由ERα介导 应用MG-63及其稳定转染的细胞克隆,
本文还发现,与对照组相比,葛根素能明显抑制未转染MG-63细胞与MG-63/scrambled shRNA细胞IL-6 mRNA的表达水平,而在两组间抑制作用差异无显著性;与MG-63/scrambled shRNA细胞相比,葛根素对MG-63/ERα shRNA细胞IL-6 mRNA水平的抑制作用明显减弱,而对MG-63/ERβ shRNA细胞的作用并无影响(Fig 5)。
葛根素对IL-6蛋白表达水平的影响与其基因表达水平基本一致,即葛根素对MG-63/ERα shRNA细胞IL-6产生的抑制作用较MG-63/scrambled shR-NA细胞明显减弱(P<0.05),而这一现象并没有发生在MG-63/ERβ shRNA细胞上(Fig 6)。该结果表明葛根素对成骨细胞IL-6基因和蛋白表达的抑制作用主要是ERα依赖的。

Fig 5 Effect of puerarin on IL-6 gene expression in MG-63/ERα shRNA and MG-63/ERβ shRNA cells
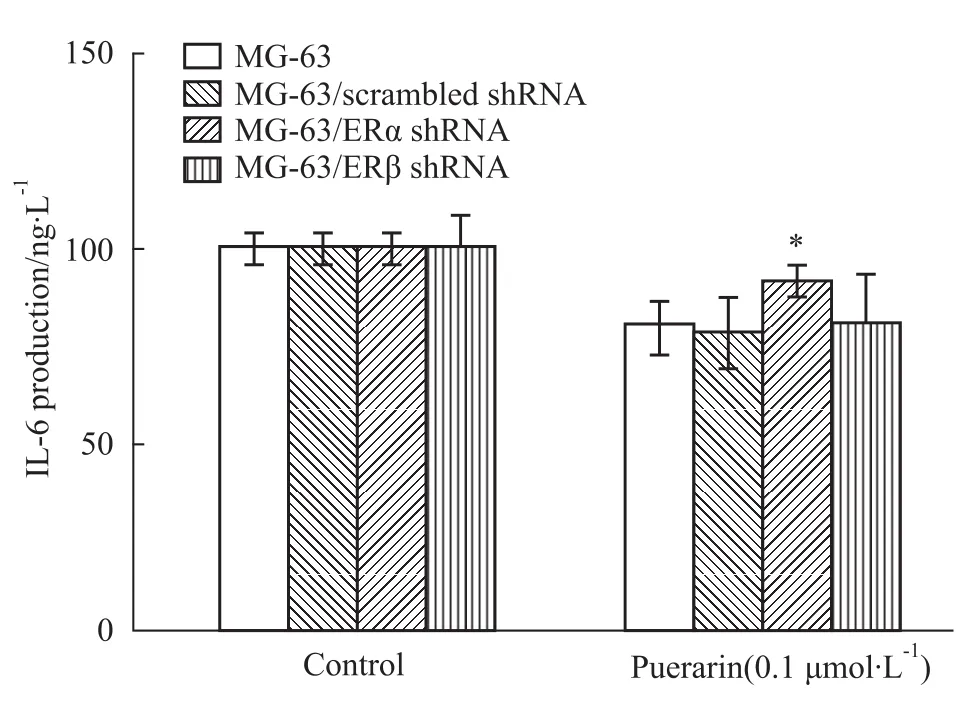
Fig 6 Effect of puerarin on IL-6 protein secretion in MG-63/ERα shRNA and MG-63/ERβ shRNA cells
3 讨论
雌激素替代疗法是目前临床防治绝经后骨质疏松症的首选方案,但长期使用雌激素可引发对乳腺、子宫及卵巢的毒副作用。因此,具有骨靶向性的雌激素类药物已经成为目前抗骨质疏松药物研究的热点之一。
葛根素和大豆异黄酮同属植物雌激素,二者结构极其相似,对绝经后骨质丢失有一定的预防作用。研究表明[10-11],大豆异黄酮化合物大豆苷元可抑制去卵巢大鼠骨量丢失,而对子宫基本无雌激素样的刺激作用。故本文推测,葛根素可能具有和大豆苷元相似的对骨的药理活性,但目前尚缺乏对其作用机制的深入研究。
作为一种多功能性细胞因子,IL-6除能调节细胞增殖、分化及血管生成等功能外,在骨代谢中也发挥了重要的作用。IL-6能刺激成骨细胞中RANKL的表达,通过RANKL与RANK相互作用促进破骨细胞分化,并诱导破骨细胞活性增强,从而促进骨吸收[12]。IL-6的水平与雌激素的水平密切相关,雌激素能够通过抑制IL-6的产生来调节骨代谢。因此,雌激素水平下降导致的IL-6水平升高,极可能是导致绝经后骨质疏松的重要原因之一[13]。临床和动物研究均证实,葛根素能降低血清IL-6水平,有效改善雌激素缺乏导致的骨质疏松[14],然而其抑制IL-6产生的分子机制尚未阐明。
本文发现,葛根素通过降低MG-63细胞IL-6启动子的活性从而抑制其IL-6的产生。在相同浓度下,葛根素对IL-6的抑制作用不及雌二醇,其原因可能与二者对PMA刺激的IL-6基因启动子转录活性的敏感性不同有关。据文献报道,雌激素对成骨细胞和骨髓间质细胞IL-6基因表达的抑制作用可能与其下调NF-κB、NF-IL-6的活性有关,二者均能上调IL-6基因的表达[15]。由此提示,葛根素与雌二醇具有类似的生物学活性,即通过抑制成骨细胞IL-6的产生,阻止破骨细胞成熟,从而发挥其抗骨质疏松活性。
雌激素对骨代谢的调节作用是由骨组织上的ER介导的。ER属核受体超家族成员,其主要成员有ERα和ERβ两个亚型。Viereck等[16]研究表明,E2主要通过活化ERα抑制成骨细胞产生IL-6,这与我们的实验结果是一致的。作为异黄酮类植物雌激素,葛根素通过何种途径影响成骨细胞IL-6的分泌?本实验结果发现,葛根素对MG-63细胞IL-6启动子的转录活性及IL-6表达的抑制作用可被ER阻断剂ICI 182,780部分阻断。随后运用RNA干扰技术进一步证明葛根素对MG-63细胞IL-6表达的调控作用主要是ERα依赖的。
本文对葛根素抑制MG-63细胞IL-6分泌的作用机制进行了初步探讨,我们的结果表明,葛根素通
过ERα介导的途径抑制成骨细胞IL-6基因的表达及蛋白的分泌,进而抑制骨吸收。本研究结果将为临床应用骨靶向雌激素治疗骨质疏松症提供一定的理论依据,为把骨质疏松症拓为口腔种植的适应证提供了一定的理论依据。
(致谢:本研究的主要工作在本实验室完成,部分工作在院内天津市重点实验室完成。感谢以上实验室的帮助。)
参考文献:
[1] Sipos W,Pietschmann P,Rauner M,et al.Pathophysiology of os-teoporosis[J].Wien Med Wochenschr,2009,159(9-10):230 -4.
[2] 傅德皓,杨述华,肖宝钧,等.应用骨靶向药物治疗骨质疏松症的研究进展[J].中国医院药学杂志,2010,30(3):234-6.
[2] Fu D H,Yang S H,Xiao B J,et al.Research progress of applica-tion of bone targeting drug in treatment of osteoporosis[J].Chin Hosp Pharm J,2010,30(3):234-6.
[3] 姚 丹,丁选胜.葛根素药理作用机制探讨及临床应用[J].中国临床药理学与治疗学,2008,13(4):468-74.
[3] Yao D,Ding X S.Discussions in pharmacological action and the development in clinical application of puerarin[J].Chin J Clin Pharmacol Ther,2008,13(4):468-74.
[4] 何正光,陈 刚,祝慧凤,等.葛根素注射液对大鼠脑缺血/再灌注损伤的保护作用[J].中国药理学通报,2011,27(8):1181-2.
[4] He Z G,Chen G,Zhu H F,et al.Protective effects of puerarin on focal cerebral ischemia-reperfusion injury in rats[J].Chin Phar-macol Bull,2011,27(8):1181-2.
[5] 李灵芝,刘启兵,张永亮,等.葛根素对UMR106细胞增殖及碱性磷酸酶活性的影响[J].中国新药杂志,2005,14(11):1291 -4.
[5] Li L Z,Liu Q B,Zhang Y L,et al.Effects of puerarin on the pro-liferation and alkaline phosphatase activity of UMR-106 cells[J].Chin J New Drugs,2005,14(11):1291-4.
[6] 赵艳威,李宗,宋光明,等.葛根素促进人成骨样MG-63细胞分化的分子机制研究[J].中草药,2014,45(4):536-40.
[6] Zhao Y W,Li Z M,Song G M,et al.Molecular mechanism for promotion of puerarin on differentiation in human osteoblast-like MG-63 cells[J].Chin Tradit Herbal Drugs,2014,45(4):536 -40.
[7] 翟远坤,潘亚磊,牛银波,等.柚皮苷及其代谢物柚皮素对乳鼠颅骨成骨细胞分化成熟影响的比较研究[J].中国药学杂志,2013,48(16):1373-9.
[7] Zhai Y K,Pan Y L,Niu Y B,et al.Comparative study on the differentiation and maturation of rat calvarial osteoblasts by naring-in and naringenin in vitro[J].Chin Pharm J,2013,48(16):1373-9.
[8] Wang Y,Li L Z,Zhang Y L,et al.LC,a novel estrone-rhein hy-brid compound,concurrently stimulates osteoprotegerin and inhib-its receptor activator of NF-kappaB ligand(RANKL)and interleu-kin-6 production by human osteoblastic cells[J].Mol Cell Endo-crinol,2011,337(1-2):43-51.
[9] Wang Y,Yang J,Gao Y,et al.Reciprocal regulation of 5alpha-dihydrotestosterone,interleukin-6 and interleukin-8 during prolif-eration of epithelial ovarian carcinoma[J].Cancer Biol Ther,2007,6(6):864-71.
[10]Anderson J J,Ambrose W W,Garner S C.Orally dosed genistein from soy and prevention of cancellous bone loss in two ovariecto-mized rat models[J].J Nutr,1995,125(suppl 1):S799.
[11]徐 霞,贡沁燕,鲁映青,等.大豆异黄酮对去卵巢大鼠骨密度和雌激素活性的影响[J].中国新药与临床杂志,2002,21 (6):321-5.
[11]Xu X,Gong Q Y,Lu Y Q,et al.Effects of soy isoflavones on bone density and estrogen activity in ovariectomized rats[J].Chin J New Drugs Clin Rem,2002,21(6):321-5.
[12]Adebanjo O A,Moonga B S,Yamate T,et al.Mode of action of interleukin-6 on mature osteoclasts.Novel interactions with extra-cellular Ca2+sensing in the regulation of osteoclastic bone resorp-tion[J].J Cell Biol,1998,142(5):1347-56.
[13]Rachon D,Mysliwska J,Suchecka-Rachon K,et al.Effects of oestrogen deprivation on interleukin-6 production by peripheral blood mononuclear cells of postmenopausal women[J].J Endocri-nol,2002,172(2):387-95.
[14]罗显禄.葛根异黄酮对去卵巢大鼠的抗骨质疏松作用及其机制[J].中国生化药物杂志,2012,33(3):262-4.
[14]Luo X L.Mechanism of Pueraria Isoflavones on osteoporosis in ovariectomized rats[J].Chin J Biochem Pharmaceut,2012,33 (3):262-4.
[15]Manolagas S C.The role of IL-6 type cytokines and their receptors in bone[J].Ann N Y Acad Sci,1998,840:194-204.
[16]Viereck V,Grundker C,Blaschke S,et al.Raloxifene concur-rently stimulates osteoprotegerin and inhibits interleukin-6 produc-tion by human trabecular osteoblasts[J].J Clin Endocrinol Metab,2003,88(9):4206-13.
Molecular mechanism for inhibitory effect of puerarin on IL-6 secretion in human osteoblast-like MG-63 cells
LUO ting1,LI Le-fei1,GUO Xiao-qin2,ZHANG Li-peng2,WANG Yue2,LI Ling3,HAN Ze-min4
(1.Liaoning Medical University Postgraduate Training Base,the Affiliated Hospital of Medical College of CPAF,Jinzhou Liaoning 121000,China;2.Dept of Pathogenic Biology and Immunology,College of Logistics,CPAF,Tianjin 300309,China;3.Dept of Pharmacology,College of Logistics,CPAF,Tianjin 300309,China;4.Dept of Stomatology,the Affiliated Hospital of Medical College of CPAF,Tianjin 300162,China)
Abstract:Aim To investigate the molecular mecha-nism for the inhibitory effect of puerarin on IL-6 secre- tion in human osteoblast-likeMG-63 cells.Methods According to our previous studies,human osteoblast-
like MG-63 cells containing two estrogen receptor (ER)isoforms are a suitable model for this study.En-zyme-linked immnosorbent assay(ELISA),RT-PCR,luciferase reporter assay and small interfering RNA were performed to investigate the effect of puerarin on IL-6 expression in osteoblast-derived cells and underly-ing molecular mechanism.Results Puerarin could obviously inhibit IL-6 expression and IL-6 promoter ac-tivity by human osteoblastic MG-63 cells.Treatment with the ER antagonist ICI 182,780 abrogates the a-bove actions of puerarin on osteoblast-derived cells.U-sing siRNA technology,we further demonstrated that the effects of puerarin on IL-6 production were media-ted by ERα.Conclusion The effect of puerarin on IL-6 production in osteoblast is mediated by ERα.
Key words:puerarin;osteoblast;IL-6;ERα;ERβ;siRNA technology
作者简介:罗 婷(1989-),女,硕士生,研究方向:口腔种植外科,E-mail:496110748@qq.com;李乐飞(1987-),男,硕士生,研究方向:口腔种植外科,共同第一作者,E-mail:heide11111@163.com;王 越(1968-),女,博士,教授,研究方向:抗骨病药物分子机制,通讯作者,Tel:022-84876730;E-mail:wan-gyue6808@126.com;韩泽民(1967-),男,博士,教授,副主任医师,研究方向:口腔种植外科,通讯作者,Tel:022-60578756;E-mail:wjyykq2014163@.com
基金项目:国家自然科学基金资助项目(No 81273520,81572852,81502256);天津市自然科学基金资助项目(No 12JCZDJC26300,15JCYBJC28900);武警后勤学院科学技术研究项目(No WHZ201202,WHB201404,WHB201405,WHB201406,2015ZXKF05)
收稿日期:2015-07-28,修回日期:2015-08-23
文献标志码:A
文章编号:1001-1978(2015)11-1524-06
doi:10.3969/j.issn.1001-1978.2015.11.010
