大黄酸聚乳酸纳米粒的制备及体外评价*
2015-02-25陈丹飞王国伟徐骏军尚小广朱永琴浙江中医药大学杭州310053
★ 陈丹飞 王国伟 徐骏军 尚小广 朱永琴 (浙江中医药大学 杭州 310053)
大黄酸聚乳酸纳米粒的制备及体外评价*
★ 陈丹飞*第一作者:陈丹飞 (1989—),女,在读硕士研究生。Tel:15158192215,E-mail: mschendanfei@163.com。王国伟徐骏军尚小广朱永琴(浙江中医药大学杭州 310053)
摘要:目的:制备包载大黄酸的聚乳酸纳米粒(RH-PLA-NPs),考察其理化性质,并评价其体外特性。方法:优选聚乳酸(PLA)为载体,采用自乳化溶剂扩散法来制备RH-PLA-NPs。在前期单因素考察的基础上,正交设计优化筛选RH-PLA-NPs制备处方并考察工艺稳定性,透射电镜观察其外观形态,激光粒度仪测定粒径及Zeta电位,超速离心法结合HPLC测定包封率及载药量,透析法考察其体外释药特性,MTT法评价其对Caco-2细胞的生物安全性。结果:最佳工艺制备的RH-PLA-NPs外观呈圆整球形,平均粒径为(134.37±3.61)nm,多分散系数为(0.099±0.023),Zeta电位(-18.42±0.07)mV,包封率(60.38±1.51)%和载药量(1.33±0.08)%;体外释药呈缓释特性,在PBS缓冲液和含20%乙醇PBS缓冲液中24h累积释放百分率分别为87.08%和93.05%,释放行为均符合Weibull方程,分别为lnln(1/1-Q)=1.1317lnt-1.8613(R=0.9693)和lnln(1/1-Q)=1.0512lnt-1.6707(R=0.9873);在0~200 μg/mL范围内,对Caco-2细胞无明显的细胞毒性。结论:成功制备了RH-PLA-NPs,其粒径分布均匀,包封率及载药量较高,体外释药具有缓释特征,并且具有良好的生物安全性,是一种有开发前景的新制剂。
关键词:大黄酸;聚乳酸;纳米粒;正交设计;体外评价
大黄酸(Rhein,RH)为蓼科植物掌叶大黄 (RheumpalmatumL.)的根茎提取物,属于单蒽核类1,8-二羟基蒽醌衍生物,具有抗肿瘤、抗炎、抗菌及调节肾功能等作用[1],但是RH水溶性差、半衰期短,生物利用度低,在一定程度上限制了其临床应用[2-3]。纳米粒(Nanoparticles,NPs)作为一种新型药物载体,具有提高难溶性药物的水溶性、延长药物半衰期、缓控释等优点,同时克服了乳剂、脂质体等载体易泄漏药物等缺点。近年来,随着NPs研究的进一步深入,其在改善难溶性药物口服吸收,提高生物利用度等方面的应用亦引起了极大的关注。
聚乳酸(Polylactic acid,PLA)具备优良的生物相容性和生物降解性,且价格低廉,相对分子量可控,现已经被FDA和CFDA批准用于制备NPs、微球、微囊等制剂的药用辅料,是制备NPs的理想载体材料。本研究以PLA为载体材料,采用改良的自乳化溶剂扩散法(Modified-spontaneous Emulsification Solvent Diffusion Method,M-SESD)制备RH-PLA-NPs,以包封率、载药量和粒径为主要指标,正交设计优化工艺筛选处方,透析法考察其体外释药特性,MTT法评价其对Caco-2细胞的生物安全性,并进行质量评价。为RH及同类药物的纳米制剂开发提供实验参考。
1试剂和仪器
RH (陕西森弗生物科技有限公司,纯度≥98%,批号20090320);RH对照品(中国食品药品检定研究院,批号110757200206);泊洛沙姆188(德国BASF,批号WPWA-544C);聚乳酸(山东岱罡生物科技有限公司,外消旋DL型,M=10000,批号09111917);甲醇(美国Honeywell);磷酸(美国TEDIA);0.25%胰蛋白酶溶液,D-Hanks缓冲液(美国Gibco);DMEM(含有4.5 g/L葡萄糖、3.7 g/L碳酸氢钠、10%胎牛血清、1%非必需氨基酸、1%谷氨酰胺、100 μg/mL青霉素和100 μg/mL链霉素)(杭州吉诺生物医药技术有限公司);其他试剂均为国产分析纯。Caco-2细胞(浙江中医药大学实验动物中心冻存,原购于中国科学院上海细胞研究所)。
Agilent-l200高效液相色谱仪器(美国Agilent);ZLS380激光粒度仪(美国Nicomp);LabConco冷冻干燥机(美国Labconco);超速离心机(美国Beckman);TGL-16B高速离心机(上海安亭仪器公司);HJ-6B磁力加热搅拌机(金坛市金伟实验仪器公司);CP225D型电子天平(北京赛多利斯仪器有限公司); S-212型恒速搅拌器(上海申胜生物技术有限公司);RE52CS型旋转蒸发器(上海亚荣生化仪器厂);Mill-Q超纯水器(美国Millpore);透析袋(截留分子量为3000上海绿鸟科技发展有限公司)。
2方法与结果
2.1纳米粒的制备
采用M-SESD制备RH-PLA-NPs,取一定量的RH和PLA溶于一定比例的丙酮与乙醇的混合溶剂中,构成有机相;另取一定体积的poloxamer 188水溶液作为水相;将有机相以缓慢滴加到一定搅拌速度下的水相中,滴毕,继续搅拌30 min,减压蒸出有机溶剂和部分水,得到带有蓝色乳光的RH-PLA-NPs胶体溶液,冷冻干燥后得RH-PLA-NPs冻干粉。
2.2测定方法的建立
2.2.1色谱条件色谱柱:Platisil ODS型(150 mm×4.6 mm,5 μm);流动相:甲醇∶0.1%磷酸(75∶25);流速:1.0 mL/min;柱温:25℃;检测波长:254 nm。
2.2.2专属性考察按“2.2.1”项下方法,制备不加入RH的空白PLA-NPs。RH对照品溶液、空白PLA-NPs和RH-PLA-NPs混悬液的色谱图见图1,可见杂质峰与药物峰分离较好,辅料和溶剂对药物测定无干扰,色谱的专一性良好,RH的保留时间约为8.44 min。
2.2.3标准曲线的制备精密配成浓度为0.122 mg/mL的RH对照品贮备液。分别量取RH对照品贮备液0.05,0.10,0.20,0.40,0.80,1.60,3.20 mL至10 mL容量瓶,用甲醇定容至刻度,摇匀,得浓度为0.612,1.224,2.448,4.896,9.792,19.584,39.168μg/mL的系列标准溶液,按“2.2.1”项下方法测定,以峰面积(A)为纵坐标,浓度C(μg/mL)为横坐标拟合标准曲线。大黄酸在0.612~39.168 μg/mL范围内A和C呈良好的线性关系,回归方程:A=71.272C-12.817,r=0.9998(n=7)。
2.2.4精密度考察精密量取不同体积RH对照品储备液于容量瓶中,用甲醇稀释成0.612,4.896,39.168μg/mL三种浓度,分别在日内测定5次并且连续测定3 d,计算RH的日内、日间精密度。日内和日间精密度RSD分别为0.54%,0.47%,0.58%和1.05%,0.86%,0.72%,符合方法学要求。
2.2.5回收率考察按处方量的80%,100%,120%精密称取RH对照品,分别加处方比例辅料,置100 mL容量瓶中,用甲醇溶解定容,配成浓度分别为17.2,21.5,25.8μg/mL的溶液。经0.22μm微孔滤膜过滤后,取续滤液测定,平行操作6次,计算回收率分别为97.72±1.32%,101.01±0.94%,99.97±1.75%,表明回收率符合方法学要求。

A.RH 标准溶液; B. PLA-NPs; C.RH-PLA-NPs
2.2.6稳定性考察取同一样品溶液于室温下放置,于0 ,2 ,4 ,8 ,12 ,24 h测定,考察室温对RH稳定性的影响,RSD为0.34%,表明样品在24 h 内稳定。
2.3正交实验
根据前期单因素考察结果,选择PLA处方量(A)、poloxamer 188浓度(B)、丙酮乙醇体积比(C)、有机相体积(D)为实验因素,各因素选取3个水平,见表1。按正交设计表L9(34)安排实验,以NPs粒径、包封率为考察指标。
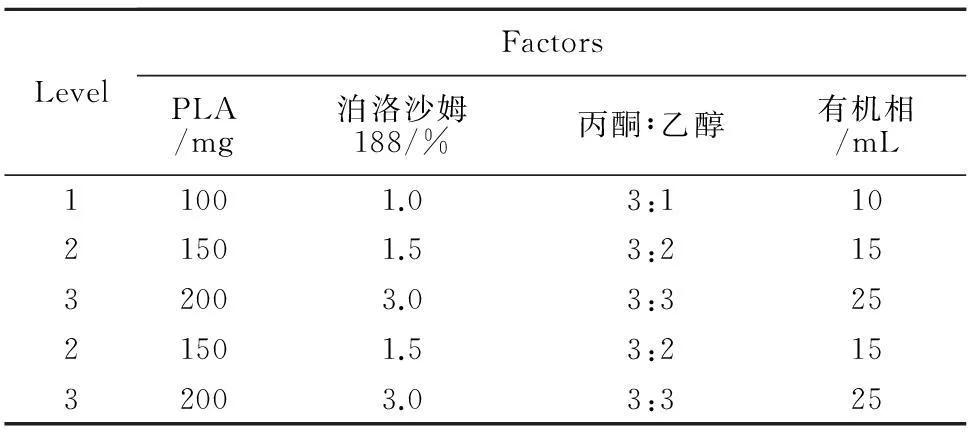
表1 正交实验因素水平表
应用综合加权评分法对正交实验结果进行综合分析,粒径(y1)和包封率(y2)分别按50%和50%的系数积分,综合评分(y)=0.5(208.42-y1)+ 0.5[140.70-(100-y2)],结果见表2和表3。

表2 正交实验结果

表3 方差分析表
由表2极差分析R值可知,在以粒径和包封率为考察指标的四个影响因素中,影响顺序为:PLA处方量(A)>poloxamer 188浓度(B)>有机相体积(D)>丙酮乙醇体积比(C)。由表3分析可知,影响因素A、B、D对粒径和包封率均具有显著影响(P<0.05),而C对其影响不显著。为了制备粒径小,包封率高的RH-PLA-NPs,选择最佳组合为A1B1C2D2,即PLA为100 mg,poloxamer 188浓度为1.0 %,丙酮与乙醇体积比为3∶2,有机相体积为15 mL。
2.4最佳工艺验证
为进一步考察最佳工艺的稳定性,按照正交实验得出的最优工艺,制备3批RH-PLA-NPs。由表4可知,NPs的平均粒径、PDI、Zeta电位、包封率和载药量均相对稳定,表明制备工艺稳定性较好。
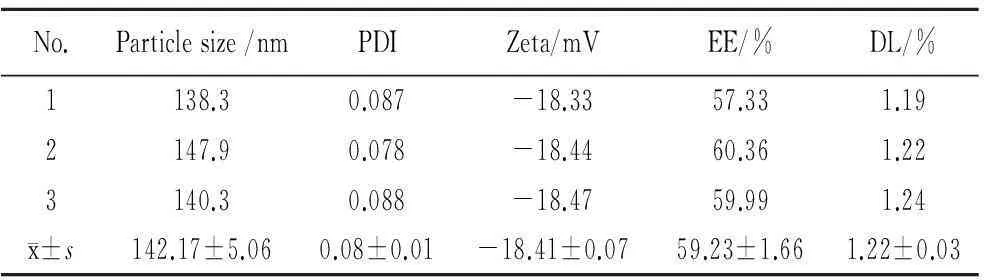
表4 验证实验
2.5质量评价
2.5.1外观形态制备得到的RH-PLA-NPs混悬液呈浅黄色、澄清、乳光明显。吸取适量RH-PLA-NPs混悬液滴于铜网上,静置2 min后用滤纸吸干,滴加2.0%磷钨酸溶液于铜网上负染13 min后用滤纸吸干残留液,自然挥干,用透射电镜观察,见图2。NPs呈圆球颗粒,表面圆滑,大小均匀,分布良好,粒子之间未见粘连及团聚现象。
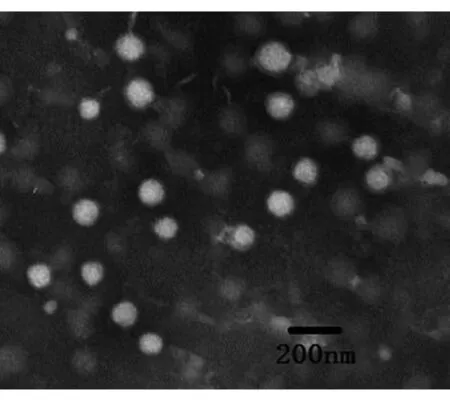
图2 RH-PLA-NPs透射电镜照片(×60000)
2.5.2平均粒径和Zeta电位取适量RH-PLA-NPs混悬液,用激光粒度仪测定平均粒径和Zeta电位,按软件程序进行测定,自动记录数据。结果NPs的平均粒径为(134.37±3.61)nm,PDI为(0.099±0.023),Zeta电位为(-18.42±0.07)mV。
2.5.3包封率和载药量的测定精密量取RH-PLA-NPs混悬液1.0 mL,加入具塞离心管中,超速离心(室温,18000 r/min,30min)后取上清液200 μL,用0.22 μm微孔滤膜过滤,取续滤液测定,计算上清液中的药物含量,记作W1;另精密量取RH-PLA-NPs混悬液1.0 mL,加入适量甲醇后超声,定容至15 mL,按同法求得NPs中总的药物含量,记作W0;按公式计算NPs的包封率和载药量,结果包封率为(60.38±1.51)%,载药量为(1.33±0.08)%。
EE%=(W0-W1)/W0×100%
DL%=(W0-W1)/Wt×100%
W0:NPs中的总药物量;W1:NPs中的游离药物量;Wt:NPs的总重量。
2.6体外释药考察
选择pH 7.4 PBS缓冲液和含20%乙醇的pH 7.4 PBS缓冲液作为释放介质,采用透析法对RH原药溶液(RH-Sol)与RH-PLA-NPs的体外释放特性进行研究。分别精密量取RH-Sol和RH-PLA-NPs混悬液适量,各6份,置于透析袋内,用透析夹夹紧。将透析袋置于预先保温的50 mL释放介质中,放于(37±0.5)℃恒温水浴振荡(75 r/min)中恒温振荡,分别于0.1,0.25,0.5,0.75,1,1.25,1.5,1.75,2,2.5,3,4,5,6,8,12,24 h取释放介质试样2 mL,立即补加等量同温空白释放介质。用0.22 μm微孔滤膜过滤后,取续滤液按“2.2.1”项下色谱条件测定,计算累积释放百分率(Q)。
RH-Sol与RH-PLA-NPs在PBS缓冲液和含20%乙醇的PBS缓冲液中的释药曲线见图3。由图可知,RH-Sol在两种释放介质中释药均很快,4 h时药物已基本全部释放,累积释放百分率分别为97.12%和96.33%,但RH-PLA-NPs释药行为主要分为突释和缓释两相,开始时释放较快,4h时药物的累积释放百分率分别为61.60%和61.25%,随后释药曲线渐趋平稳,缓慢释药,于24h时累积释放百分率分别为87.08%和93.05%。

图3 体外释放曲线(n=6)

表6 体外释放曲线拟合(含20%乙醇的PBS缓冲液)
分别用零级、一级动力学模型、Higuchi模型、Weibull模型对RH-PLA-NPs体外释药行为进行拟合, RH-PLA-NPs在PBS缓冲液和含20%乙醇的PBS缓冲液中的释药行为均符合Weibull方程,分别为lnln[1/(1-Q)]=1.1317lnt-1.8613(R=0.9693)和lnln[1/(1-Q)]= 1.0512lnt-1.6707(R=0.9873)。
2.7细胞毒性实验
Caco-2细胞置培养瓶中,加入DMEM培养基,置37℃恒温培养箱(5% CO2,相对湿度90%)连续培养。每2~3 d用含0.02% EDTA的胰蛋白酶消化,以1∶3比例传代培养。取对数生长期Caco-2细胞接种于96孔平底细胞培养板中,密度为1×105个/mL,每孔加入190L培养液培养12 h。然后实验组分别加入不同溶度的PLA-NPs和RH-PLA-NPs的混悬液10L,最终浓度分别为0.01 ,0.1,1,5,20,50,100,200 μg/mL,空白对照组加入无菌生理盐水,每组每浓度设6个平行孔。培养24 h后,每孔滴加5 mg/mL的MTT溶液10 L,微量振荡器上振荡3~5 min,继续培养4 h后,弃去上清液,加入DMSO 150 μL,在微量振荡器上振荡10 min,用酶标仪测定570 nm波长处其光密度(OD)值。取6个孔平均OD值计算细胞的存活率(IC),IC=(实验组OD值/空白对照组OD值) 100%。
采用MTT法测定了PLA-NPs和RH-PLA-NPs对Caco-2的细胞毒性。如图4所示,孵育24 h后,在纳米粒浓度达到200 μg/mL时,细胞的存活率仍然保持在90%以上。此外,在较高浓度时,RH-PLA-NPs的毒性略高于空白PLA-NPs,可能是由于包载在纳米粒中的RH对细胞产生一定的毒性。实验结果表明,在0~200 μg/mL范围内,PLA-NPs和RH-PLA-NPs纳米载体对Caco-2细胞无明显的毒性作用,具有良好的生物安全性。

图4 PLA-NPs和RH-PLA-NPs对Caco-2细胞的毒性
3讨论
对于水不溶性药物,制备NPs应用较多的是溶剂蒸发法、溶剂扩散法和盐析法等,但这些方法在实际应用中受到很大的限制,如制备中需使用二氯甲烷、二甲基亚砜等有毒有机溶剂;需均质器、超声细胞破碎仪等高能设备。而自乳化溶剂扩散法(SESD)能克服以上不足,特别适合于脂溶性药物纳米粒的制备,Murakam等[8]首次在SESD的基础上改进使用M-SESD,以丙酮与乙醇代替传统的丙酮和二氯甲烷,同时在水相中加入适量的表面活性剂,充分利用了丙酮和乙醇混合溶剂对聚合物、药物和表面活性剂的不同溶解性,通过溶剂的自发扩散制备NPs,大大提高药物的包封率。
难溶性药物既可完全包封于NPs的疏水性核中,也可被吸附于NPs的表面,还可存在于NPs的浅表层或壳层内,故不同NPs部位的药物释放速度不同[5-6]。体外释药考察显示,与RH-Sol相比,RH-PLA-NPs具有明显的缓控释效果。RH-Sol于4h时药物已基本全部释放,而RH-PLA-NPs于4h时药物在PBS缓冲液和含20%乙醇的PBS缓冲液中的累积释放百分率分别为61.60%和61.25%,随后释放曲线渐趋平稳,于24h时累积释放百分率分别为87.08%和93.05%。RH-PLA-NPs的释药行为呈现突释和缓释两相,突释现象可能是由于poloxamer 188具有很强的亲水性,在释放介质可以从分布于NPs表面的细小孔洞渗入到内部后,NPs表面和孔洞中的RH都被快速释放,形成“突释效应”。而缓释现象可能是由于PLA聚合物在缓慢解链溶解过程中,随着往NPs核心部位的“溶蚀”,NPs内部结构逐渐变得紧密而使释放介质渗入受阻,形成药物的缓慢控释。
本研究采用M-SESD法成功制备了包载大黄酸的聚乳酸纳米粒,正交设计优化筛选的处方具有较高的包封率和载药量,并且粒径分布均匀,稳定性好,体外释药具有缓释特性,并且具有良好的生物安全性。本实验为RH纳米制剂的开发提供一定的实验基础,并为同类药物的研究提供参考。
参考文献
[1]李晓红, 李蒙, 陶艳蓉. 大黄酸及其衍生物药理作用研究新进展[J].现代药物与临床, 2010, 25(6):417-421.
[2]Zhang JW, Wang GJ, Sun JG, et al. Determination of rhein in plasma by HPLC-fluorescence detection and its pharmacokinetics in rats[J].Chin J Nat Med, 2005,3(4):238-241.
[3]Peng Y, Sun JG, Wang GJ, et al. Pharmacokinetic study of rhein and its carboxyl-esterification derivatives in rats[J].Chin J Nat Med, 2009, 7(3):228-233.
[4]Murakami H, Kobayashi M, Takeuchi H, et al. Further application of a modified spontaneous emulsification solvent diffusion method to various types of PLGA and PLA polymers for preparation of nanoparticles[J].Powder Tech, 2000, 107(1):137-143.
[5]Kumaresh SS, Tejraj MA, Kulkarni AR, et al. Biodegradable polymeric nanoparticles as drug delivery devices[J].J Control Release, 2001, 70(12):1-20.
[6]Amani E Fagui, Pierre Dubot, Thorsteinn Loftsson, et al. Triclosan-loaded with high encapsulation efficiency into PLA nanoparticles coated with β-cyclodextrin polymer[J].J Incl Phenom Macrocycl Chem, 2013, 75(3):277-283.
Preparation and in Vitro Evaluation of Rhein-loaded Polylactic Acid Nanoparticles
CHEN Dan-fei, WANG Guo-wei, XU Jun-jun, SHANG Xiao-guang, ZHU Yong-qin
ZhejiangChineseMedicalUniversity,Hangzhou310053,China.
Abstract:Objective: To investigate the optimal preparation and prepare of RH-PLA-NPs,and to evaluate its in vitro property. Methods:Using PLA as carriers and applying modified spontaneous emulsification solvent diffusion to prepare RH-PLA-NPs, optimizing and screening the prescription by orthogonal design optimization, ultra-high speed centrifugal combination with methanol extraction to determinate the encapsulation efficiency and drug loadings rate, transmission electron microscope to observe appearance, laser particle size tester to determine the average particle size and Zeta potential , and using dialysis method to investigate in vitro release characteristics, MTT method to investigate the cytotoxicity on Caco-2 cells. Results:The results showed that RH-PLA-NPs were uniform size and round, and formed of (134.37±3.61) nm in particle size with PDI of (0.099±0.023), Zeta potential of (-18.42±0.07) mV, entrapment efficiency of (60.38±1.51)%, and drug loading of (1.33±0.08)%. The in vitro release profiles in PBS and PBS with 20% EtOH conform to the Weibull equation: lnln(1/1-Q)=1.1317lnt-1.8613(R=0.9693) and lnln(1/1-Q)= 1.0512lnt- 1.6707(R=0.9873), and 24 h release rate was 87.08% and 93.05%. Within the scope of the 0 200 μg/mL, RH-PLA-NPs had no obvious toxicity on Caco-2 cells. Conclusion:Preparing RH-PLA-NPs successfully with uniform particle size, higher drug-loading rate and encapsulation efficiency, control release characteristics and good biocompatibility. RH-PLA-NPs have promising prospects for further development.
Key words:Rhein; Polylactic Acid; Nanoparticles; Orthogonal Design; In Vitro Evaluation
收稿日期:(2014-12-25)编辑:曾文雪
中图分类号:TQ461
文献标识码:A
基金项目:*浙江省大学生科技创新活动计划项目(2013R410058)。
