地榆升白片联合重组人粒细胞集落刺激因子治疗紫杉类化疗后骨髓抑制的疗效
2015-02-24田慧芳
田慧芳
(湖北省鄂州市中医医院 输血科, 湖北 鄂州, 436000)
地榆升白片联合重组人粒细胞集落刺激因子治疗紫杉类化疗后骨髓抑制的疗效
田慧芳
(湖北省鄂州市中医医院 输血科, 湖北 鄂州, 436000)
摘要:目的观察和分析地榆升白片联合重组人粒细胞集落刺激因子(rhG-CSF)治疗紫杉类化疗后骨髓抑制的疗效。方法选取200例应用紫杉类药物化疗且首次出现重度骨髓抑制的患者作为研究对象,将其中于出现重度骨髓抑制前预防性应用地榆升白片且在出现重度骨髓抑制后联合应用rhG-CSF治疗的100例患者作为观察组,将仅在出现重度骨髓抑制后单纯应用rhG-CSF治疗的100例患者作为对照组。对2组患者发生重度骨髓抑制的时间、化疗结束后第4.5天、第8.5天、第20天、再次化疗结束后第4.5天的白细胞(WBC)计数、中性粒细胞(NE)计数、血小板(PLT)计数下降程度、rhG-CSF使用情况及治疗前、后肝肾功能指标、体力状况评分(KPS 评分)及不良反应情况进行观察和比较。结果观察组患者发生重度骨髓抑制的时间显著晚于对照组(U=2.799,P<0.05),在化疗周期的各监测时点,观察组患者的WBC计数、NE计数、PLT计数下降程度均轻于对照组(U=4.715~12.985,P<0.05);观察组患者的rhG-CSF用量和rhG-CSF使用天数均显著低于对照组(t=6.921、5.276,P<0.05),治疗后的KPS评分显著高于对照组(t=4.075,P<0.05),不良反应的发生率均显著低于对照组(χ2=3.979、18.065、11.607,P<0.05)。结论在应用紫杉类药物化疗中,预防性应用地榆升白片能够延缓重度骨髓抑制的发生,联合应用地榆升白片和rhG-CSF对重度骨髓抑制患者进行治疗,可减少rhG-CSF的用量,降低不良反应的发生率,改善患者的体力状况。
关键词:地榆升白片; 重组人粒细胞集落刺激因子; 化疗; 骨髓抑制; 中西医结合治疗
化疗是恶性肿瘤治疗中的关键环节,但化疗后产生的骨髓抑制严重影响了患者化疗方案的实施和化疗方案的临床疗效,已成为了现代医学肿瘤治疗的一大瓶颈[1]。化疗后出现的重度(Ⅲ~Ⅳ度)骨髓抑制若得不到相应的治疗,可使患者的病情加重,最终导致化疗失败。重组人粒细胞集落刺激因子(rhG-CSF)是一种人工合成的造血因子,可有效减轻化疗患者的骨髓抑制症状,是目前临床上治疗化疗引起的粒细胞减少症的常用方法[2]。在近年来的临床实践中,研究者发现单纯应用rhG-CSF对化疗后骨髓抑制进行治疗并不能达到理想的效果,而且大量应用rhG-CSF也会加重患者的不良反应。因此,研究者开始探索将rhG-CSF与其他药物联合应用来提高治疗的效率。中医药因其在恶性肿瘤化疗后骨髓抑制的防治方面的优势而被广泛关注,中西医结合治疗方法的研究也成为了该研究领域的焦点,本研究针对地榆升白片联合rhG-CSF治疗紫杉类化疗后骨髓抑制的疗效和安全性进行了观察和分析,现将研究的具体情况报告如下。
1资料与方法
1.1 一般资料
选取2013年1月—2014年12月本院收治的200例各类恶性肿瘤化疗患者作为研究对象,纳入患者均经术后或组织活检病理检查确诊,均为初诊初治病例并接受含紫杉类药物的联合化疗方案治疗,均完成2个周期以上治疗,预计生存期超过3个月,体力状况评分(KPS)评分≥60分。纳入患者均于化疗后首次出现Ⅲ~Ⅳ度骨髓抑制,骨髓抑制分度均符合世界卫生组织(WHO)的重度骨髓抑制诊断分级标准。排除化疗前血尿便常规、肝肾功能、心电图检查明显异常的患者,排除合并有感染性疾病、血液疾病的患者,排除接受同步放化疗治疗的患者。纳入患者的年龄为37~79岁,平均为(56.4±6.2)岁,男127例,女73例。将其中于出现重度骨髓抑制前预防性应用地榆升白片且在出现重度骨髓抑制后联合应用rhG-CSF治疗的100例患者作为观察组,将仅在出现重度骨髓抑制后单纯应用rhG-CSF治疗的100例患者作为对照组,2组患者在年龄、性别构成、肿瘤种类、KPS评分、化疗方案等方面的差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
观察组患者于首个周期化疗前开始预防性口服地榆升白片,用药剂量为每日3次,每次2~3片,在化疗期间血常规检查结果显示出现重度骨髓抑制时给予rhG-CSF皮下注射治疗,用药剂量为每日150~300 μg,同时给予口服地榆升白片治疗,用药剂量为每日3次,每次4片,连续治疗7 d,起效后继续口服地榆升白片治疗,用药剂量为每日3次,每次2~3片,以维持治疗效果;对照组在出现重度骨髓抑制时给予rhG-CSF皮下注射,用药剂量为每日150~300 μg,直到血常规检查WBC计数≥8.0×109/L时停药。
1.3 观察指标
对2组患者发生重度骨髓抑制的时间进行观察和比较;于化疗结束后第4.5天、第8.5天、第20天、再次化疗结束后第4.5天(以上均为中位时间)对两组患者的血常规指标进行监测,对上述监测时点的WBC计数下降程度、NE计数下降程度、PLT计数下降程度进行观察和分析;对两组患者的rhG-CSF及其他升血治疗的用药情况进行观察和比较;对两组患者治疗前、后的谷草转氨酶(AST)、谷丙转氨酶(ALT)、尿素(Urea)、肌酐(Cr)、KPS 评分及发热、肌肉骨关节痛、局部反应等不良反应情况进行观察和比较。
1.4 统计学处理
应用SPSS 13.0统计软件进行统计学分析,计量资料采用(均数±标准差)形式表示,两组之间的比较应用独立样本t检验进行处理,计数资料采用百分比的形式表示,无等级关系的计数资料应用卡方检验进行处理,有等级关系的计数资料应用频数表的秩和检验(Mann-Whitney U法)进行处理,以上统计学检验均以P<0.05为差异有统计学意义。
2结果
2.1 2组患者发生重度骨髓抑制时间的比较
观察组患者发生重度骨髓抑制的时间主要在化疗3周期和化疗4周期以后,对照组患者发生重度骨髓抑制的时间主要在化疗2周期和化疗3周期,2组患者发生重度骨髓抑制时间分布的差异有统计学意义(U=2.799,P<0.05),见表1。

表1 2组患者发生重度骨髓抑制时间的比较
与对照组比较,*P<0.05。
2.2 2组患者各监测时点血常规指标变化情况的比较
在化疗周期的各监测时点,观察组患者的WBC计数、NE计数、PLT计数下降程度均轻于对照组,2组患者的上述血常规指标下降程度的分布差异均有统计学意义(U=4.715~12.985,P<0.05), 见表2、3、4。

表2 2组患者各监测时点WBC计数下降程度的比较[n(%)]
与对照组比较,*P<0.05。

表3 2组患者各监测时点NE计数下降程度的比较[n(%)]
与对照组比较,*P<0.05。

表4 2组患者各监测时点PLT计数下降程度的比较[n(%)]
与对照组比较,*P<0.05。
2.3 2组患者rhG-CSF用量及其他升血治疗情况的比较
观察组患者的rhG-CSF用量和rhG-CSF使用天数均显著低于对照组,2组之间的差异有统计学意义(t=6.921、5.276,P<0.05),而其他升血治疗使用率的差异均无统计学意义(χ2=0.036~0.307,P>0.05), 见表5。
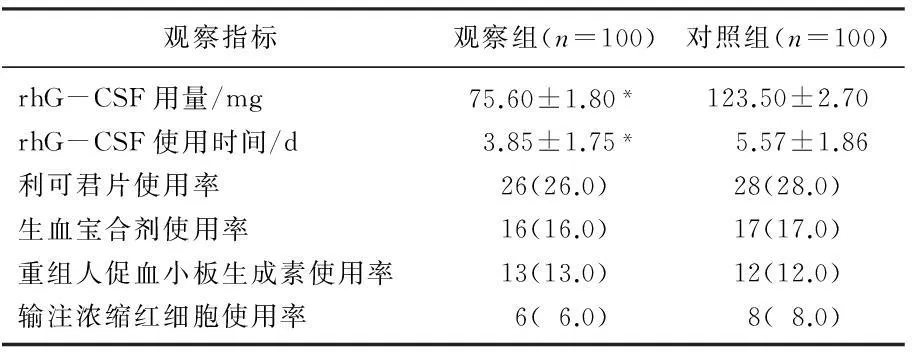
表5 2组患者rhG-CSF用量及其他升血治疗情况的比较[n(%)]
与对照组比较,*P<0.05。
2.4 2组治疗安全性指标的比较
2组患者治疗前、后的肝肾功能指标的差异均无统计学意义(t=0.135~0.609,P>0.05),见表6; 2组患者治疗前的KPS评分的差异无统计学意义(t=0.465,P>0.05), 而观察组患者治疗后的KPS评分显著高于对照组,差异有统计学意义(t=4.075,P<0.05), 见表7; 观察组患者的发热、肌肉骨关节痛、局部反应等不良反应的发生率均显著低于对照组,差异均有统计学意义(χ2=3.979、18.065、11.607,P<0.05), 见表8。
3讨论
紫杉醇是多种恶性肿瘤化疗的一线药物,在具有确切疗效的同时,其骨髓抑制、神经毒性、心脏毒性等不良反应也较多,相关研究[3]已证实,与应用长春瑞滨+顺铂方案(NP方案)、吉西他滨+顺铂方案(GP方案)相比,应用紫杉醇+顺铂方案(TP方案)患者的白细胞下降更为明显,不适于用于免疫功能降下或高龄患者的治疗,这在一定程度上降低了紫杉醇的临床应用价值。虽然近年来研究者先后尝试应用乳剂、胶囊、包合物、脂质体、纳米粒、凝胶、植入剂和药物释放支架等紫杉醇新剂型及联合用药等方式来减少紫杉醇在应用中产生的毒副作用,但是还没有一种效果确切的方式能够广泛应用于临床,骨髓抑制仍然是紫杉醇应用中的难题之一。应用紫杉醇化疗的患者一旦在化疗后出现重度骨髓抑制,则极有可能出现皮肤、口腔、上呼吸道、泌尿道等部位的感染,如未能给予及时、有效的治疗和护理,会严重影响患者的治疗效果。

表6 2组患者治疗前、后肝肾功能指标的比较
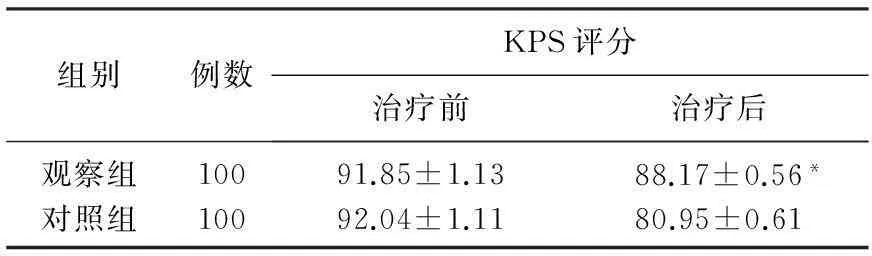
表7 2组患者治疗前、后KPS评分的比较
与对照组比较,*P<0.05。

表8 2组不良反应发生率的比较[n(%)]
与对照组比较,*P<0.05。
G-CSF是临床上针对化疗后骨髓抑制的常用药物,它是一种属于糖蛋白因子家族的多功能造血因子,由活化的T细胞、树突状细胞、巨噬细胞、角质细胞、内皮细胞和成纤维细胞等合成并分泌,能够刺激粒细胞和巨噬细胞的增殖、成熟和分化,具有重要的免疫调节功能[4]。G-CSF主要用于各种原因引起的粒细胞减少症及外周血干细胞的动员,相关研究[5]已证实,G-CSF对T细胞、树突状细胞、Treg、NK细胞及多种细胞因子的表达均具有重要的调节作用。rhG-CSF是一种重组生物制剂,于1993年在中国上市,至今已经在临床应用超过了20年的时间,主要分为长效和短效两种制剂,临床应用时要根据患者的具体情况进行选择[6]。相关研究[7-8]已证实,rhG-CSF能诱导造血祖细胞向中性粒细胞分化,对中性粒细胞的功能活性发挥调节作用,能够降低发热性中性粒细胞减少的发生率、持续时间和严重程度,从而保证及时、足量完成抗肿瘤治疗。在近年来的临床研究中,研究者[9]发现,如在出现化疗后重度骨髓抑制时单纯应用rhG-CSF,往往需要多次大量用药,易引起不良反应,而这些不良应用与化疗的不良反应相互叠加,会对患者的生活质量、体力状况和治疗依从性产生严重的影响,甚至还有个别患者会出现针对rhG-CSF的严重不良反应。
中药治疗是化疗后骨髓抑制治疗中的重要组成部分之一,以疗效确切、运用灵活、安全性高等优点受到广泛的关注。中医认为,化疗后骨髓抑制以虚证居多,在临床治疗上应以补法为治疗基本方法,再根据不同证型辨证论治,治疗原则以“补虚”和“攻毒”并重为宜。对气血两虚型患者,应以益气补血为主;对脾肾虚弱型患者,应以健脾益肾、养血活血为主;对肝肾阴虚型患者,应以补益肝肾、养血活血为主;对肝脾肾亏虚型患者,应以补益肝肾、健脾生血、气血阴阳双补为主。临床上也发展出了中成药、中药汤剂、穴位注射等多种给药方式,在辅助化疗防治骨髓抑制方面发挥了积极的作用[10]。地榆升白片的主要成分是中药地榆,地榆始载于《神农本草经》,《中国药典(2005年版)》将其规定为蔷薇科植物地榆或长叶地榆的干燥根。地榆味苦、酸、涩,性微寒,归肝、大肠经,具有凉血止血,解毒敛疮的功能,在临床用上主要用于便血、痔血、血痢、崩漏、水火烫伤、痈肿疮毒等疾病的治疗。现代药理学研究显示,地榆具有显著的抗氧化、抗过敏、抗炎、抗菌作用,对肿瘤和α-葡萄糖苷酶有抑制作用,因此,能够应用于预防和治疗肿瘤化疗导致的骨髓抑制,还能有效治疗子宫肌瘤等良性肿瘤[11], 地榆制炭后,含有大量的钙离子、鞣质和碳素等止血成分,可对患者的出血时间和凝血时间产生影响,在临床上可用于各种出血症的治疗[12]。本研究结果显示,在应用紫杉类药物化疗出现重度骨髓抑制后,联合应用地榆升白片和rhG-CSF进行治疗,能够减少rhG-CSF的用量和使用时间,降低不良反应的发生率,改善患者的体力状况,具有更好的疗效和安全性。
参考文献
[1]章伟, 赵林林, 陈立伟, 等. 恶性肿瘤化疗后骨髓抑制的中医药防治进展[J]. 四川中医, 2014, 32(6): 179.
[2]李振, 甄林林. G-CSF在乳腺癌化疗中的研究进展[J].现代医学, 2014, 43(3): 344.
[3]苏同义, 朱铁年, 高冬梅, 等. 不同化疗方案对晚期非小细胞肺癌患者骨髓抑制及免疫功能的影响[J]. 现代生物医学进展, 2014, 14(21): 4067.
[4]栗广伟, 冯喜英, 关巍. 粒细胞-巨噬细胞集落刺激因子在肺部疾病的研究进展[J/CD]. 中华肺部疾病杂志: 电子版, 2013, 6(2): 68.
[5]毛跃峰, 胡致平. 粒细胞集落刺激因子的免疫调节作用研究进展[J].中国肿瘤, 2012, 21(3): 203.
[6]莫红楠, 石远凯, 孙燕. 重组人粒细胞集落刺激因子在肿瘤化疗中应用20年回顾[J]. 中国新药杂志, 2013, 22(17): 2027.
[7]李娇, 张晟, 张瑾. 重组人粒细胞集落刺激因子预防乳腺癌化疗后骨髓抑制的疗效分析[J]. 中国癌症杂志, 2014, 24(12): 925.
[8]李波, 曹原, 司继刚.重组人粒细胞集落刺激因子对化疗后中性粒细胞缺乏的有效性和安全性研究[J]. 药学与临床研究, 2014, 22(6): 545.
[9]滕雪, 吴东媛, 关尚为, 等. 重组人粒细胞集落刺激因子注射液致严重不良反应1例[J]. 中国医院用药评价与分析, 2015, 15(1): 143.
[10]陈丹, 陈理. 中医药防治化疗后骨髓抑制的研究进展[J]. 江苏中医药, 2012, 44(7): 76.
[11]叶招浇, 阎澜, 李洪娇, 等. 中药地榆的药理作用及临床应用研究进展[J].药学服务与研究, 2015, 15(1): 47.
[12]张向阳, 魏红, 郑海萍, 等. 地榆炭的研究进展[J].环球中医药, 2014, 7(2): 158.
Therapeutic effects and safety of Garden Burnet Root leukopoietic tablets combined with recombinant human granulocyte colony-stimulating factor in treatment of marrow suppression after chemotherapy of paclitaxel
TIAN Huifang
(DepartmentofBloodTransfusion,E'zhouHospitalofTraditionalChineseMedicine,E'zhou,Hubei, 436000)
ABSTRACT:ObjectiveTo observe and analyze the therapeutic effects and safety of Garden Burnet Root leukopoietic tablets combined with recombinant human granulocyte colony-stimulating factor (rhG-CSF) in treatment of marrow suppression after chemotherapy of paclitaxel. MethodsA total of 200 patients treated with chemotherapy of paclitaxel and complicated with severe marrow depression for the first time were selected as the research objects. 100 patients treated with preventive Garden Burnet Root leukopoietic tablets before the occurrence of marrow depression and treated with Garden Burnet Root leukopoietic tablets combined with rhG-CSF after the occurrence of marrow depression were included into the observation group, while 100 patients with single application of rhG-CSF after the occurrence of marrow depression were included into the control group. The time of occurrence of severe marrow suppression, the degree of decreases of white blood cell (WBC) count, neutrophil (NE) count, platelet (PLT) count at 4.5 days, 8.5 days, 20 days after chemotherapy and 4.5 days after following chemotherapy, the application of rhG-CSF, the liver and kidney function indexes, the physical status score (KPS score) before and after the treatment and the adverse events of the patients in the two groups were observed and compared. ResultsThe occurrence of severe marrow suppression of the patients in the observation was later than that in the control group (U=2.799,P<0.05). At each monitoring points of chemotherapy cycle, the degrees of decreases of WBC count, NE count, PLT count were less than those in the control group (U=4.715~12.985,P<0.05); The dosages and days of the application of rhG-CSF of the patients in the observation group were significantly lower than those in the control group (t=6.921, 5.276,P<0.05), KPS score after the treatment was significantly higher than that in control group (t=4.075,P<0.05), the incidence rates of adverse events were significantly lower than those in the control group (χ2=3.979, 18.065, 11.607,P<0.05). ConclusionIn the chemotherapy of paclitaxel, the preventive application of Garden Burnet Root leukopoietic tablets can delay the occurrence of severe marrow suppression. The application of Garden Burnet Root leukopoietic tablets combined with rhG-CSF in the treatment of patients with severe marrow suppression can reduce the dosage of rhG-CSF, the incidence of adverse events and improve the physical condition of the patients.
KEYWORDS:Garden Burnet Root leukopoietic tablets; recombinant human granulocyte colony-stimulating factor; chemotherapy; marrow suppression; treatment of traditional Chinese and Western Medicine
收稿日期:2015-04-25
中图分类号:R 453
文献标志码:A
文章编号:1672-2353(2015)21-029-05DOI: 10.7619/jcmp.201521008
