铜催化不对称硅氢化1,4-还原α,β-不饱和Michael受体反应的研究进展
2015-02-24隋耀宗虞景露谢琳洁杨黎耀吴俊文
方 嫱,隋耀宗,虞景露,谢琳洁,杨黎耀,吴俊文,吴 静
(1.杭州师范大学材料与化学化工学院,浙江 杭州 310036;2.浙江工商大学食品与生物工程学院,浙江 杭州 310035)
铜催化不对称硅氢化1,4-还原α,β-不饱和Michael受体反应的研究进展
方嫱1,2,隋耀宗1,虞景露1,谢琳洁1,杨黎耀1,吴俊文1,吴静1
(1.杭州师范大学材料与化学化工学院,浙江 杭州 310036;2.浙江工商大学食品与生物工程学院,浙江 杭州 310035)
摘要:概述了近年来铜催化不对称硅氢化1,4-还原各类α,β-不饱和Michael受体如α,β-不饱和酯、酮、氨基酸酯、腈、砜、硝基化合物以及磷酸酯等的研究进展.
关键词:手性铜催化剂;不对称硅氢化;1,4-还原;α,β-不饱和Michael受体
催化不对称还原是一类重要的不对称催化反应,是制备手性醇、胺及氨基酸衍生物等最直接方法之一,这些化合物占了目前发展中单一异构纯药物的近40%.非贵金属铜催化的不对称硅氢化反应作为一种不对称还原方法,具有技术简单安全及催化剂成本低等特点,引起了有机化学家们的关注[1-6].1984年Brunner 等首次研究了Cu(I)催化不对称硅氢化还原苯乙酮,得到了39 %的对映选择性[7].直到2001年,Lipshutz等在此领域取得了重要突破[8],发展了特别高效的CuICl/手性双膦配体(如3,5-Xyl-MeO-BIPHEP[9-10]或DTBM-SEGPHOS[11])/t-BuONa/PMHS(聚甲基氢硅氧烷)催化体系(底物/配体高达100 000/1),可以高对映选择性还原酮、亚胺和α,β-不饱和羰基化合物等[4].随后,许多各具特色的Cu(I)和Cu(II)手性催化剂相继被用于不对称硅氢化反应[1-6,12-14].同时,新型手性铜催化剂的发展将硅氢化方法扩展到各类α,β-不饱和Michael受体,如α,β-不饱和羰基化合物、硝基化合物、腈、砜和磷酸酯等的不对称1,4-还原反应中[1-6],获得了一系列结构有意义或具有生物活性的手性产物.本文重点介绍近年来铜催化不对称硅氢化1,4-还原各类α,β-不饱和Michael受体反应的研究进展.
1研究进展
1.1 铜催化不对称硅氢化1,4-还原α,β-不饱和酯
具有β-手性中心的酯是多种医药和天然产物的结构单元或合成砌块[15].较早制备具有β-手性中心的酯及其衍生物的方法主要是催化不对称1,4-加成β-位单取代的α,β-不饱和酯,针对于特定的底物一些催化体系表现出很好的对映选择性[16-20].然而这类反应通常需要使用贵金属Rh、Pd等进行催化,且反应过程中往往需要消耗化学剂量的金属试剂如格氏试剂RMgX等,同时适用的反应底物类型较少.1999年,Buchwald等[21]在铜催化不对称硅氢化1,4-还原β,β′-双取代的α,β-不饱和酯制备具有β-手性中心的酯的研究中取得突破.他们采用10 mol %的(S)-Tol-BINAP(图1,1b)作为手性配体、以5 mol%的CuCl为铜盐前体、在5 mol %碱添加剂t-BuONa存在下,与化学计量的氢源PMHS原位产生催化剂,室温下可以高活性高对映选择性地催化一系列β,β′-双取代的直链α,β-不饱和酯的不对称1,4-还原反应,研究还发现底物的E构型和Z构型对反应的对映选择性没有影响.

图1 铜催化不对称硅氢化1,4-还原α,β-不饱和酯Fig.1 Copper-catalyzed asymmetric hydrosilylation 1,4-reduction of α,β-unsaturated esters
具有β-手性中心的内酯和内酰胺是具有生物活性化合物的重要结构片段,如络石配基、牛蒡子苷元、具有PDE·IV抑制活性的抗抑郁活性的磷酸二酯抑制剂等[22].含吡咯烷或哌啶结构的五、六元环内酰胺是一类非常重要的药品,如(-)-Paroxetine[23].2003年,Buchwald等又将Cu催化不对称硅氢化1,4-还原反应应用于手性内酯和内酰胺这两类化合物的合成中[24],以(S)-Tol-BINAP(图1,1b)为手性配体,取得了理想的催化效果,研究还表明,反应体系中添加一定量大位阻的叔戊醇t-AmOH对提高反应产率、对映选择性及反应速率均有利,他们还将这一方法成功应用于手性药物(-)-Paroxetine的不对称合成(图2).当该催化体系采用手性配体(S)-MeO-BIPHEP (2)时,可以高对映选择性地合成手性抗癌药物Eupomatilone-3[25]的关键中间体3(图3,室温,93%ee;-30 ℃,95%ee).
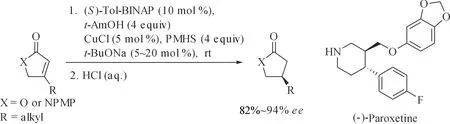
图2 铜催化不对称硅氢化1,4-还原α,β-不饱和内酯和内酰胺Fig.2 Copper-catalyzed asymmetric hydrosilylation 1,4-reduction of α,β-unsaturated lactones and lactams

图3 铜催化不对称硅氢化1,4-还原合成手性药物Eupomatilone-3前体Fig. 3 Copper-catalyzed asymmetric hydrosilylation 1,4-reduction of the precursor of chiral drug Eupomatilone-3
基于Eupomatilone-3的成功合成,Buchwald研究小组又研究了γ-芳基-α,β-不饱和内酯的催化不对称硅氢化动力学拆分,MeO-BIPHEP配体并没有表现出理想的对映选择性,而当使用CuCl2·2H2O/(R)-SYNPHOS(图4,4)/t-BuONa催化体系,可以高产率、较好对映选择性地还原一系列γ-芳基-α,β-不饱和内酯[25],这一催化体系对于γ-烷基-α,β-不饱和内酯不对称硅氢还原效果并不理想,这可能是因为这类内酯活性较低引起的.
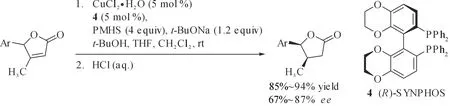
图4 铜催化不对称硅氢化还原γ-芳基α,β-不饱和内酯Fig.4 Copper-catalyzed asymmetric hydrosilylation reduction of γ-aryl α,β-unsaturated lactones
Lipshutz和郑桌等课题组也对铜催化不对称硅氢化1,4-还原α,β-不饱和酯反应进行了研究.Lipshutz等采用CuH/手性双膦配体[(R)-DTBM-SEGPHOS](图5,5)对环状和非环状的β,β′-二取代丙烯酸酯进行催化不对称硅氢化1,4-还原研究[26],得到较高光学纯度产物.同时,该催化剂对β-取代的肉桂酸乙酯类底物也具有很好的催化效果(图5).
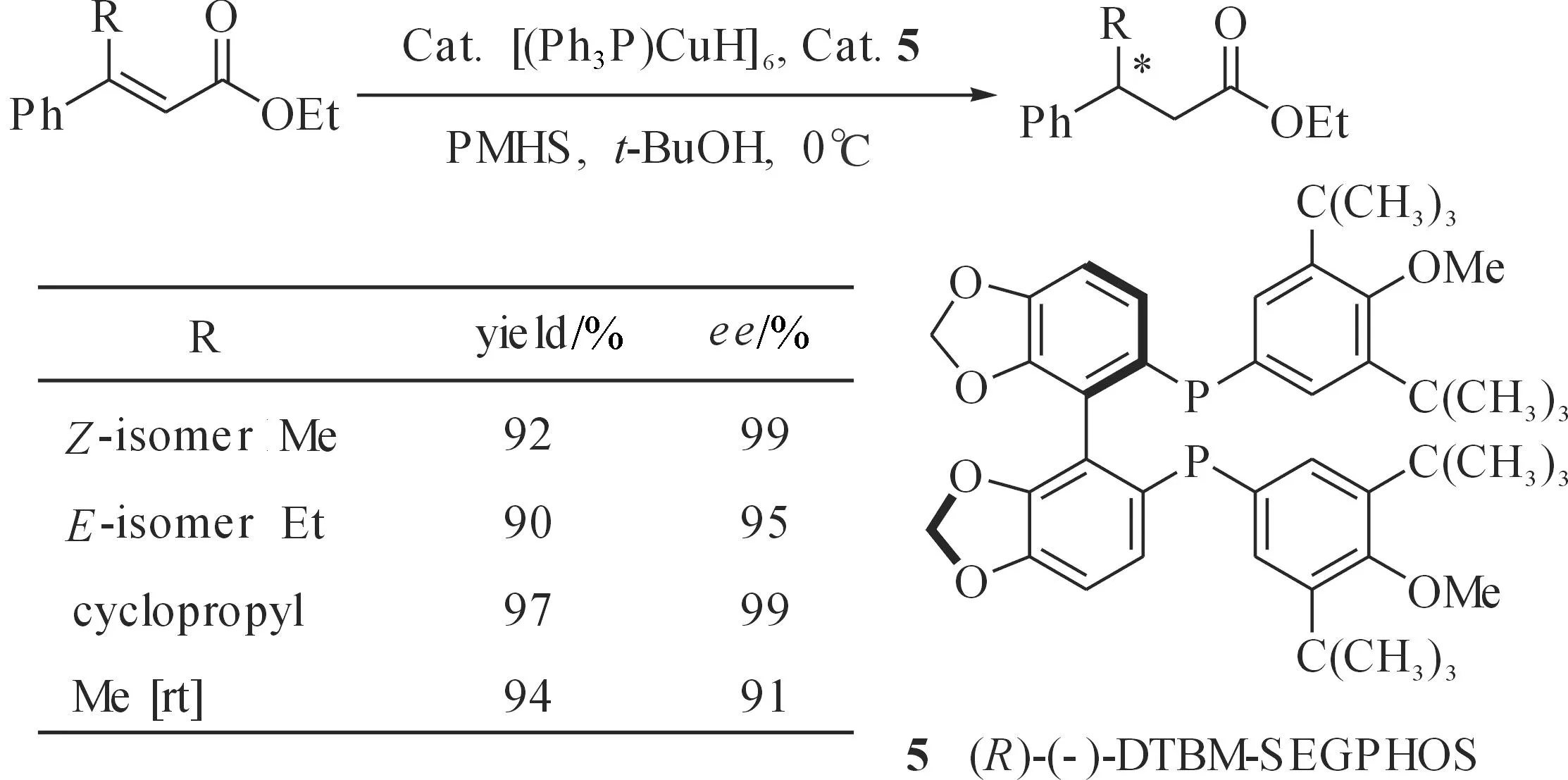
图5 CuH-SEGPHOS催化不对称硅氢化1,4-还原肉桂酸乙酯Fig. 5 CuH-SEGPHOS catalyzed asymmetric hydrosilylation1,4 reduction of ethyl cinnamate
当用(R,S)-PPF-P(t-Bu)2(6)为配体时这一催化体系可以高产率、高对映选择性地催化1,4-还原β,β′-二烷基取代丙烯酸酯[26].这可能是因为(R,S)-PPF-P(t-Bu)2具有特定的手性平面和中心元素,易于与β,β′-二烷基取代丙烯酸酯进行配位,从而得到很好的对映选择性(图6).
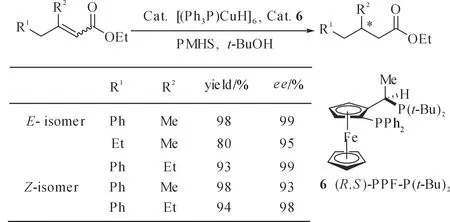
图6 铜催化不对称硅氢化1,4-还原β,β′-二烷基取代丙烯酸酯Fig. 6 Copper-catalyzed asymmetric hydrosilylation1,4-reduction of β,β′-disubstituted acrylic esters
2011年,郑卓等将含二茂铁结构的非对称杂化亚磷酰胺酯配体(Sc,Rp,R8-PPFAPhos,图 7)应用于铜催化不对称硅氢化1,4-还原β-烷基-β-芳基-α,β-不饱和丙烯酸酯类底物,研究结果表明催化体系对13种结构各异的底物还原取得了44%~99%的对映选择性和中等至好的反应活性[27].
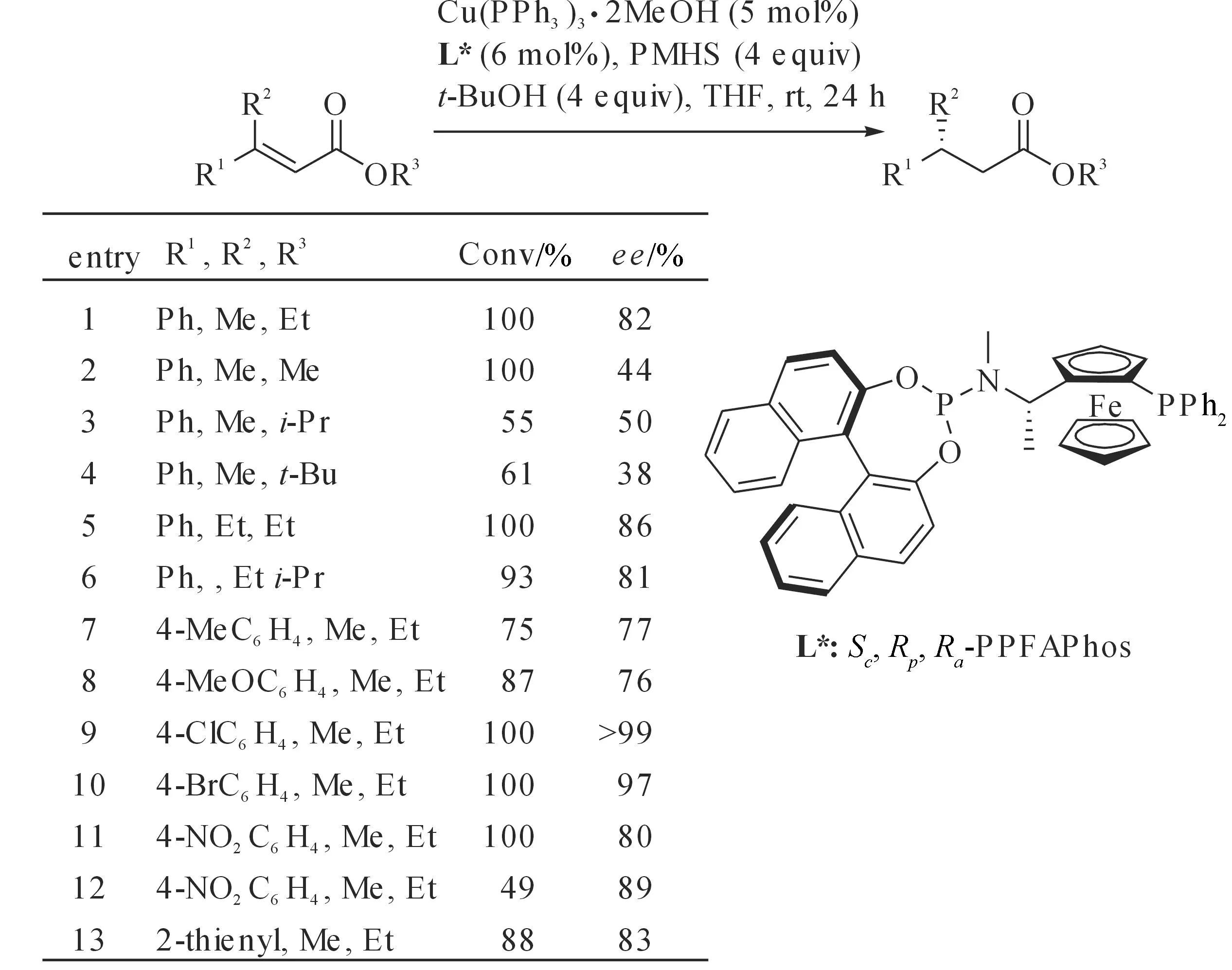
图7 铜催化不对称硅氢化1,4-还原β-烷基-β-芳基-α,β-不饱和酯类底物Fig. 7 Copper-catalyzed asymmetric hydrosilylation 1,4-reduction of β-alkyl-β-aryl-α,β-unsaturated esters
1.2 铜催化不对称硅氢化1,4-还原α,β-不饱和酮
具有β-手性中心的环酮的合成多是通过亲核加成进行的,但是采用这种方法合成的产物对映选择性通常低于90%.Buchwald发展的CuCl、t-BuONa、(S)-Tol-BINAP这一催化体系同样适用于β-取代的环烯酮的催化不对称1,4-还原[28],稍有不同的是,还原试剂PMHS用量被限制在1当量,过量的PMHS会导致副产物饱和醇的生成(图8).Buchwald和Yun还将该方法应用于2,3-二烷基环烷基酮的便捷合成工艺中.通过催化不对称硅氢化1,4-还原β-取代的环烯酮,无需分离,即可获得2,3-二烷基环烷基酮(图9).这一合成工艺也被进一步应用于E-前列腺素的合成中.

图8 铜催化不对称硅氢化1,4-还原环烯酮Fig. 8 Copper-catalyzed asymmetric hydrosilylation1,4-reduction of cycloalkenones
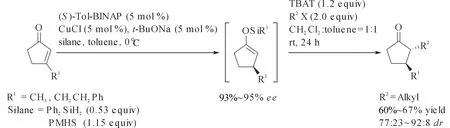
图9 一锅法合成手性2,3-二烷基取代环烷基酮Fig. 9 One pot synthsis of 2,3-dialkyl substituted cycloketone
Lipshutz等也对β-取代的环烯酮催化1,4-还原反应进行了研究[29],发现采用[(Ph3P)CuH]6或CuCl/(R)-DTBM-SEGPHOS(图5,5)/t-BuONa /PMHS原位产生的CuH,可以高产率高对映选择性还原β-取代的环烯酮(ee最高达99.5%),而过量的PMHS并未导致过度还原产物生成.值得注意的是,即使在很高的S/L(275 000∶1)值下,这一催化体系仍表现出很高的反应活性和对映选择性(ee最高达98.5%,图10).为了解决由于反应中使用催化剂当量较少而带来反应时间过长的问题,Lipshutz等采用了微波促进的办法大大缩短了反应时间[30],即使在较高的S/L值(1 000:1)下,10 min内反应即可完全,且催化剂的对映选择性没有发生明显下降.Lipshutz等[31]还利用CuCl/(R)-DTBM-SEGPHOS/PMHS体系制备出了手性Stryker试剂[(DTBM-SEGPHOS)CuH],该试剂室温下放置两周后用于化合物7的不对称硅氢化1,4-还原,对映选择性未发生明显变化.
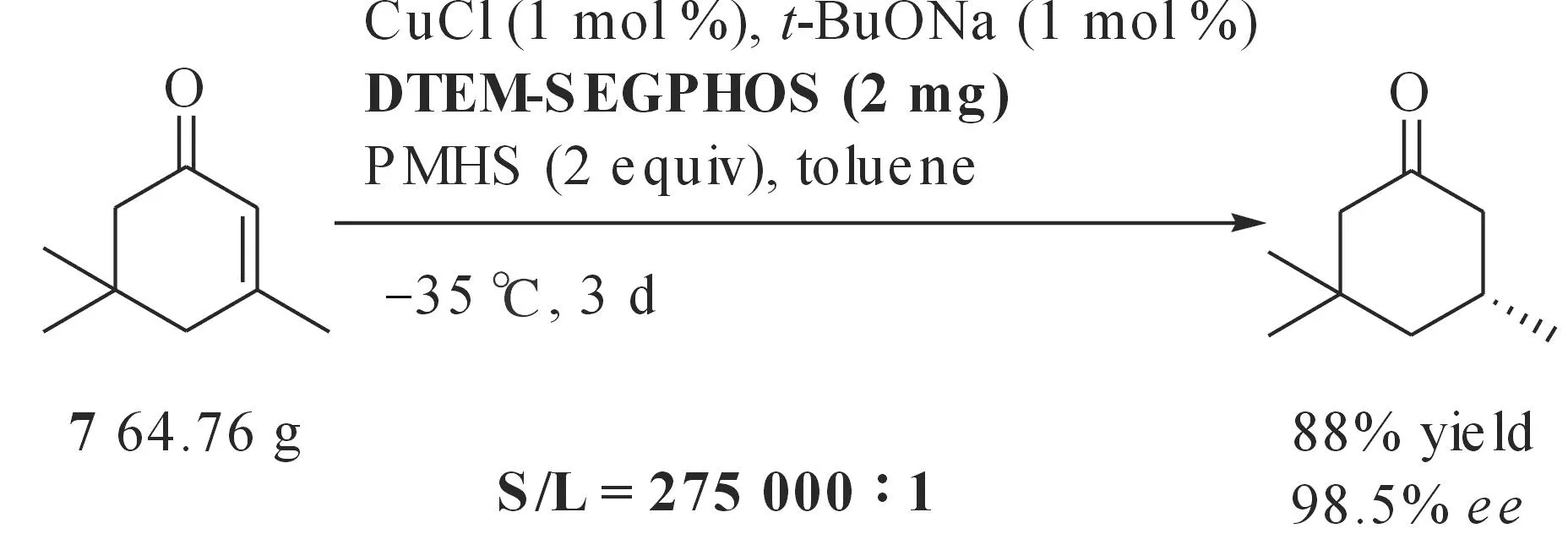
图10 Cu-(R)-DTBM-SEGPHOS催化不对称硅氢化1,4-还原β-取代的环烯酮Fig. 10 Cu-(R)-DTBM-SEGPHOS catalyzed asymmetrichydrosilylation 1,4-reduction of β-substituted cycloalkenones
此外,Lipshutz等发现N-杂卡宾(NHCS)类手性配体对铜催化不对称硅氢化1,4-还原α,β-不饱和环酮也具有较好的催化效率[32](图 11).

图11 Cu-NHCS催化不对称硅氢化1,4-还原α,β-不饱和环酮Fig. 11 Cu-NHCS catalyzed asymmetric hydrosilylation 1,4-reduction of α,β-unsaturated cycloketones
具有β手性中心的非环状脂肪族酮通常是基于Michael加成方法制备的,利用催化不对称硅氢化方法合成这类化合物一直没有取得显著突破,之前虽然也有一些相关研究,但均未获得理想的转化率和对映选择性.直到2003年,Lipshutz在这一领域取得了重要突破[33].
Lipshutz等采用CuCl/手性配体(图 12,8,9或10)/t-BuONa原位制备的催化体系用于直链α,β-不饱和酮的不对称1,4-还原,高产率(91%~97%)及高对映选择性(87%~99%ee)获得了相应产物,此外,他们还发现底物的构型会影响产物的立体化学,例如,采用相同催化体系时,(E)-和(Z)-构型的烯酮得到构型相反、对映选择性相近的产物(图 13).
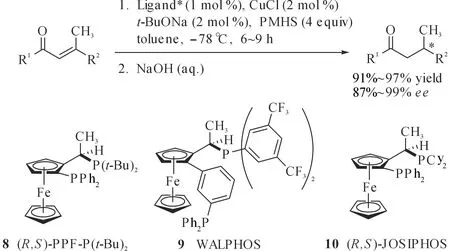
图12 铜催化不对称硅氢化1,4-还原非环状脂肪族烯酮Fig. 12 Copper-catalyzed asymmetric hydrosilylation 1,4-reduction of acyclic aliphatic ketenes
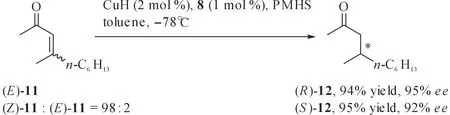
图13 底物几何构型对催化不对称硅氢化1,4-还原反应立体化学的影响Fig. 13 The influence of the geometry configuration of reactants on the stereochemistry of catalytic asymmetric hydrosilylation1,4-reduction reaction
1.3 铜催化不对称硅氢化1,4-还原脱氢氨基酸酯
光学纯β-氨基酸及其衍生物是很多天然产物和手性药物的重要手性构建骨架[34-36]等.制药业对于用传统发酵方法不能得到,却能通过不对称反应制备的非天然氨基酸非常关注.在各种催化法合成β-氨基酸及其衍生物的途径中,催化不对称还原β-脱氢氨基酸衍生物是最直接而有效的方法之一[37],其中,金属Rh或Ru催化不对称氢化β-脱氢氨基酸衍生物已经取得很好的结果[38-40],但关于使用非贵金属Cu催化不对称硅氢还原制备光学活性β-氨基酸的方法文献还较少报道.
2004年,Buchwald等[41]将Cu(OAc)2·H2O/(S)-BINAP (图1,1a)/PMHS催化体系应用于β-氮杂环-a,β-不饱和丙烯酸酯的不对称硅氢化1,4-还原反应中,获得了理想的反应活性(83%~98%)和对映选择性(81%~99%)(图 14).进一步的实验表明,空气气氛中的反应速率高于惰性气氛中的反应速率且产物的ee值保持不变.

图14 铜催化不对称硅氢化1,4-还原β-氮杂环-a,β-不饱和丙烯酸酯Fig. 14 Copper-catalyzed asymmetric hydrosilylation 1,4-reduction of β-nitrogen heterocylco-α,β-unsaturated acrylic ester
随后,郑卓等[42]将该催化体系应用于γ-氨基-α,β-不饱和羧酸酯的不对称硅氢化1,4-还原反应中,高对映选择性地得到了一系列β-芳基-γ-氨基丁酸酯衍生物,并将该合成方法成功地应用于手性药物(R)-Baclofen的不对称合成中(图15).

图15 铜催化不对称硅氢化1,4-还原合成β-芳基-γ-氨基丁酸酯衍生物Fig. 15 Copper-catalyzed asymmetric hydrosilylation 1,4-reduction of β-aryl-γ-aminobutyric acid esters and its derivatives
我们[43]发展了Cu(OAc)2·H2O/(S)-P-Phos (图16,13)/PMHS催化体系,可以高选择性合成一系列β-烷基取代的β-氨基酸酯(对映选择性最高达99%),有意义的是,底物的(Z)-和(E)-构型对反应的对映选择性无明显影响,大多数情况下 (Z)-式底物的反应活性高于 (E)-底物.我们同时还发现,该类底物中不同的β-烷基取代基和酯基对反应活性和对映选择性有明显影响.例如,当酯基为甲酯时,β-烷基取代基对催化反应无显著影响,部分产物ee值高达99%;而当酯基为乙酯时,随着β-位烷基取代基空间位阻的增大,反应活性明显降低;而当β-烷基取代基相同的情况下,随着酯基体积增大,反应对映选择性和活性都有所降低.
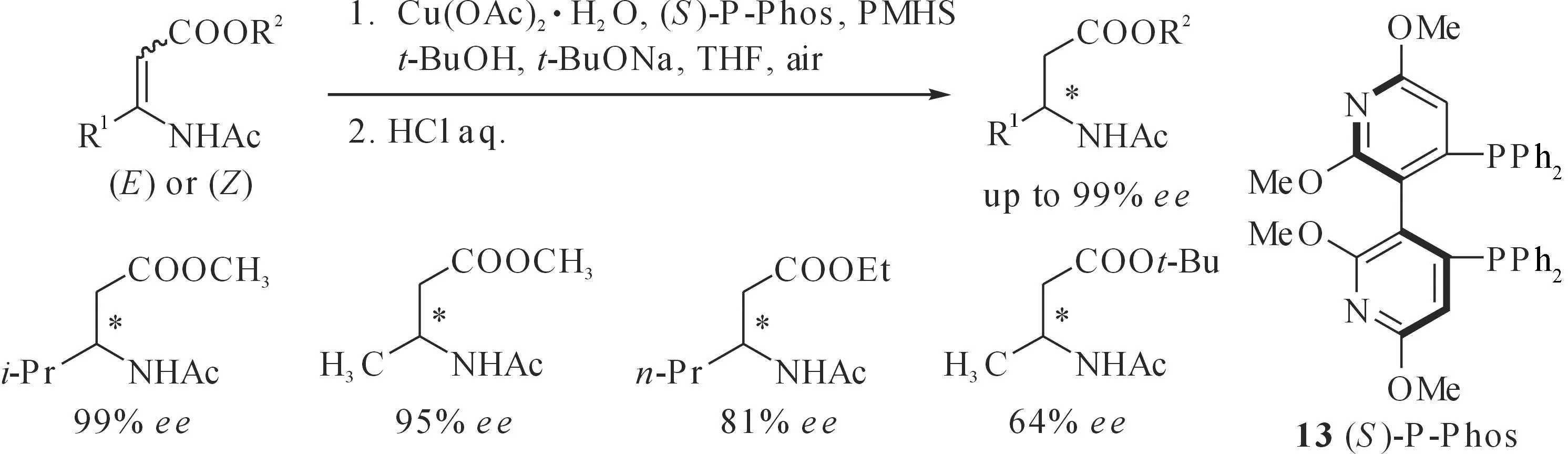
图16 铜催化不对称硅氢化1,4-还原β-烷基取代脱氢氨基酸酯Fig. 16 Copper-catalyzed asymmetric hydrosilylation 1,4-reduction of β-alkyl substituted dehydroamino acid esters
目前所报道的通过不对称还原获得β-氨基酸衍生物的方法中,大多数都需要在β-脱氢氨基酸酯的N原子上引入酰基作为保护基,在催化反应过程中,这一保护基作为螯合基团和催化剂金属中心配位以诱导反应的立体选择性,同时,可以防止N原子与催化剂金属中心配位,进而使催化剂失活,然而引入和脱除保护基团都相对困难限制了这一方法的进一步应用.N-芳基取代的β-氨基酸衍生物是合成许多天然产物和手性药物的关键中间体,制备这些化合物的最直接方法就是先合成N-芳基取代的β-丙烯胺酯,再对这些产物进行不对称还原.最近,在空气氛围下,我们将CuF2、手性(S)-P-Phos和PMHS原位生成的催化体系首次用于催化不对称硅氢化1,4-还原非酰基保护的β-甲基-β-脱氢氨基酸酯反应中,所得产物的光学纯度最高达91%,为N-芳基-β-甲基-β-氨基酸及其衍生物的手性合成提供了新方法(图17)[44].
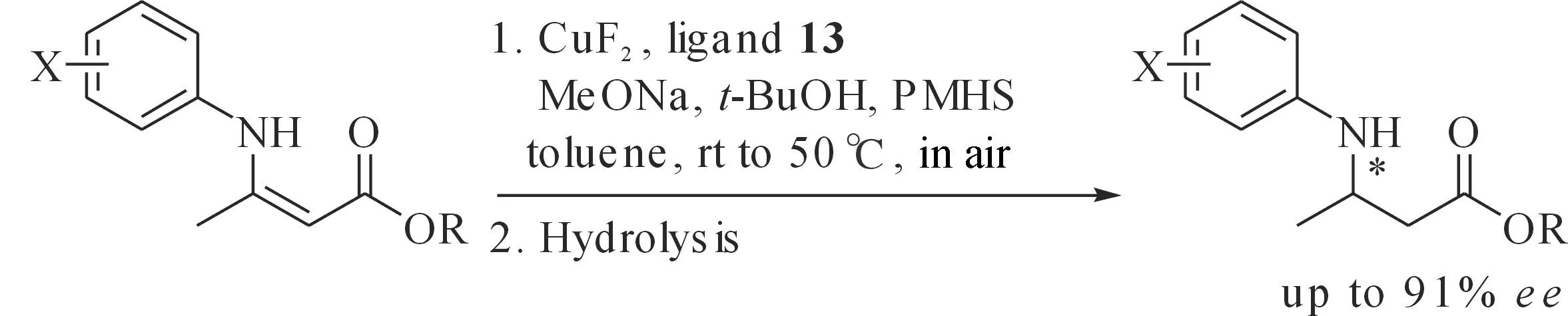
图17 铜催化不对称硅氢还原N-芳基-β-烷基脱氢氨基酸酯Fig. 17 Copper-catalyzed asymmetric hydrosilylationreduction of N-aryl β-alkyl dehydroamino acid ester
1.4 铜催化不对称硅氢化1,4-还原α,β-不饱和硝基化合物
具有光学活性的硝基化合物是精细化学合成中非常重要的手性中间体,例如可以方便地转化为手性胺、醛或酸,在偶极环加成反应中也可以作为氰氧化物前体[45].因此,研究α,β-不饱和硝基化合物的催化不对称1,4-还原反应具有重要的意义.据我们所知,目前仅Carreira研究小组[46]报道过采用CuF2/JOSIPHOS(图 12,10)催化体系[47],并以硝基甲烷(CH3NO2)为添加剂对β,β′-双取代-α,β-不饱和硝基化合物催化不对称硅氢化1,4-还原反应进行研究,得到了较好的ee值(82%~96%),但有氧的条件不利于该反应进行(图18).

图18 铜催化不对称硅氢化1,4-还原α,β-不饱和硝基化合物Fig. 18 Copper-catalyzed asymmetric hydrosilylation1,4-reduction of α,β-unsaturated nitro compounds
1.5 铜催化不对称硅氢化1,4-还原α,β-不饱和腈
腈基基团在一定条件下可以转换成其他官能团,如胺、醛或羧酸等.尽管过去40多年金属催化不对称氢化反应的研究取得了巨大成就,但是α,β-不饱和腈的催化不对称氢化反应一直以来是一个难题.一方面因为C=C双键的选择性还原常常伴有脱腈、腈基的还原、二聚以及多聚等问题;另一方面α,β-不饱和腈的低反应活性及腈基的线性结构往往导致氢化反应的对映选择性低.许健等[48]采用t-BuOCu/BINAP/PhSiH3原位产生的CuH,还原了一系列α,β-不饱和腈,当采用5 mol %的催化剂,室温下反应24 h可以以较高产率和较好对映选择性得到产物.当采用5 mol %催化剂前体Cu(OAc)2·H2O和5 mol %手性配体(S)-BINAP,并加入3当量的添加剂t-BuOH时,得到了较好的ee值(93%),但氧气会抑制该反应的进行(图 19).Yun等[49]随后发现Cu(OAc)2/JOSIPHOS/PMHS催化体系对这一类底物具有很好的活性及对映选择性(94%~99%ee)(图 20),此外他们还将这一催化体系应用于β-芳基β-吡啶丙烯腈的催化不对称硅氢化1,4-还原反应,拓宽了底物范围,并得到了很好的对映选择性(图 21,62%~96%)[50].
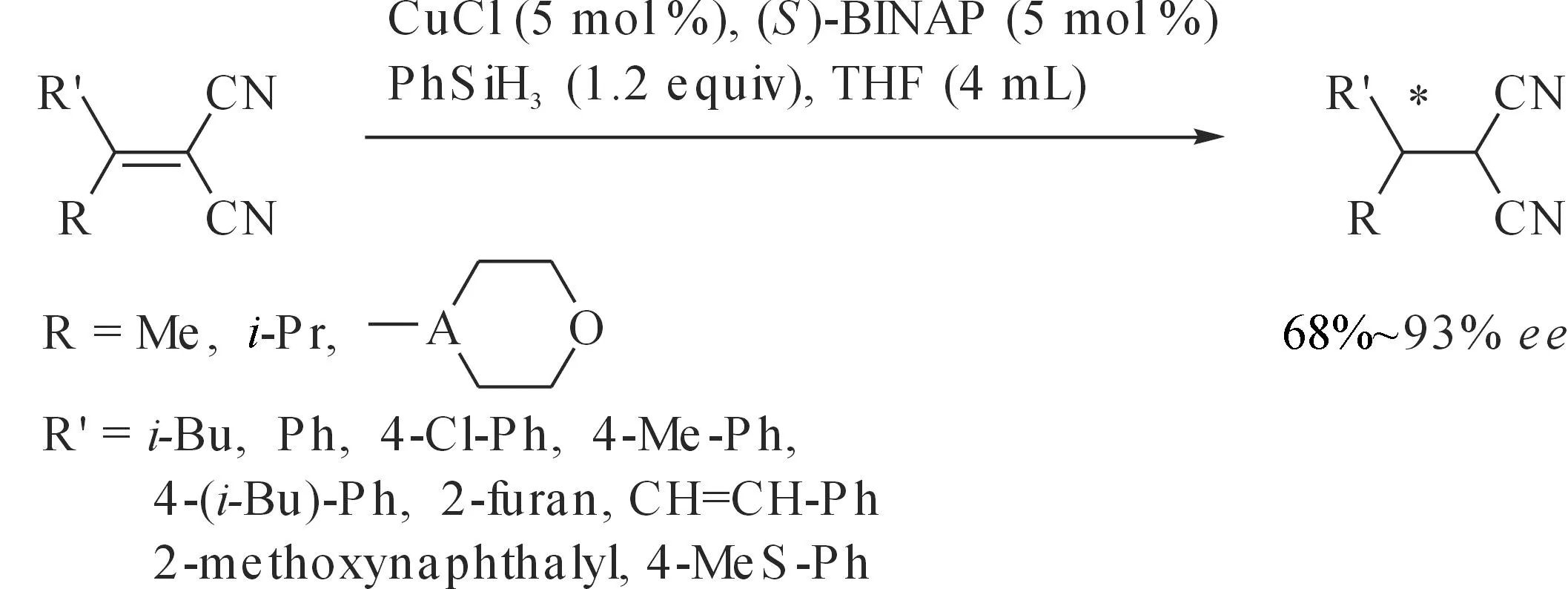
图19 铜催化不对称硅氢化1,4-还原α,β-不饱和腈Fig. 19 Copper-catalyzed asymmetric hydrosilylation 1,4-reductionof α,β-unsaturated nitrile compounds

图20 铜催化不对称硅氢化1,4-还原β-烷基-β-芳基丙稀腈Fig. 20 Copper-catalyzed asymmetric hydrosilylation1,4-reduction of β-alkyl-β-aryl acrylonitrile
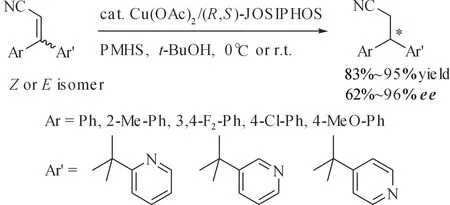
图21 铜催化不对称硅氢化1,4-还原β,β′-二芳基丙烯腈Fig. 21 Copper-catalyzed asymmetric hydrosilylation1,4-reduction of β,β′-diaryl acrylonitrile
1.6 铜催化不对称硅氢化1,4-还原α,β-不饱和砜
尽管砜这类化合物在有机合成中是非常重要的中间体,但相关的催化不对称合成具有β-手性中心的砜及其衍生物的研究却很少涉及,据我们所知至今仅Carretero课题组报道过相关反应[51],采用CuCl/t-BuONa/(R)-BINAP或(R)-
SEGPHOS/PhSiH3催化体系,以甲苯为溶液中,可以高产率和高对映选择性得到对应产物.他们还将该方法应用于β,β′-二取代、环取代α,β-不饱和砜及其顺反异构体的不对称硅氢化1,4-还原反应中,获得了高产率和高对映选择性(图 22),Z、E异构体的不对称还原得到的手性产物构型相反但ee值相同.

图22 铜催化不对称硅氢化1,4-还原β,β′-二芳基丙烯砜Fig. 22 Copper-catalyzed asymmetric hydrosilylation1,4-reduction of β,β′-diaryl propylene sulfone
1.7 铜催化不对称硅氢化1,4-还原α,β-不饱和磷酸酯
关于合成具有手性中心的烷基磷酸酯类化合物,特别是β取代的手性磷酸酯的报道相对较少,相关报道采用的是对丙烯基磷酸酯进行1,4-亲核加成获得手性化合物[52],或是采用贵金属如铑[53]对这类底物进行氢化还原获得手性中心.最近郑卓等采用Cu(OAc)2·H2O/t-BuONa/(R)-SEGPHOS催化体系对这类底物的催化不对称硅氢化1,4-还原反应进行了研究,获得了很好的对映选择性(图 23,90%~95%ee)[54].

图23 铜催化不对称硅氢还原α,β-不饱和磷酸酯Fig. 23 Copper-catalyzed asymmetric hydrosilylation reduction of α,β-unsaturated phosphonic acid ester
2结论与展望
铜催化不对称硅氢化1,4-还原各类α,β-不饱和Michael受体反应的研究近年来取得了不少进展,但如何提高催化效率、拓展催化反应底物范围以及深入对该反应机理的认识等方面仍是将来需要进一步关注的研究内容.
参考文献:
[1] Riant O, Mostefai N, Courmarcel J. Recent advances in the asymmetric hydrosilylation of ketones, imines and electrophilic double bonds[J]. Synthesis,2004,2004(18):2943-2958.
[2] Rendler S, Oestreich M. Polishing a diamond in the rough:“Cu-H” catalysis with silanes[J]. Angew Chem Int Ed,2007,46(4):498-504.
[3] Díez-González S, Nolan S P. Copper, silver, and gold complexes in hydrosilylation reactions[J]. Acc Chem Res,2008,41(2):349-358.
[4] Deutsch C, Krause N, Lipshutz B H. CuH-catalyzed reactions[J]. Chem Rev,2008,108(8):2916-2927.
[5] 李争宁,刘改玲,赵宝贻.H-Cu-P络合物在有机合成中的应用[J].化学进展,2008,20(12):1910-1922.
[6] Arena C G. Recent progress in the asymmetric hydrosilylation of ketones and imines[J]. Mini-Rev Org Chem,2009,6(3):159-167.
[7] Brunner H, Miehling W. Asymmetric catalysis: XXll. Enantioselective hydrosilylation of ketone by CuI-catalyst[J]. J Organomet Chem,1984,275:C17-C21.
[8] Lipshutz B H, Noson K, Chrisman W. Ligand-accelerated, copper-catalyzed asymmetric hydrosilylations of aryl ketones[J]. J Am Chem Soc,2001,123(51):12917-12918.
[9] Schmid R, Foricher J, Cereghetti M,etal. Axially dissymmetric diphosphines in the biphenyl series: synthesis of(6,6′-dimethoxybiphenyl-2,2′-diyl)bis(diphenylphosphine)(‘MeO-BIPHEP’) and analoguesviaanortho-lithiation/iodination ullmann-reaction approach[J]. Helv Chim Acta,1991,74(2):370-389.
[10] Schmid R, Broger E A, Cereghetti M,etal. New developments in enantioselective hydrogenation[J]. Pure Appl Chem,1996,68(1):131-138.
[11] Saito T, Yokozawa T, Ishizaki T,etal. New chiral diphosphine ligands designed to have a narrow dihedral angle in the biaryl backbone[J]. Adv Synth Catal,2001,343(3):264-267.
[12] Kantam M L, Yadav J, Laha S,etal. Asymmetric hydrosilylation of ketones catalyzed by magnetically recoverable and reusable copper ferrite nanoparticles[J]. J Org Chem,2009,74(12):4608-4611.
[13] Junge K, Wendt B, Addis D,etal. Copper-catalyzed enantioselective hydrosilylation of ketones by using monodentate binaphthophosphepine ligands[J]. Chem Eur J,2010,16(1):68-73.
[14] Li M, Li B, Xia H F,etal. Mesoporous silica KIT-6 supported superparamagnetic CuFe2O4nanoparticles for catalytic asymmetric hydrosilylation of ketones in air[J]. Green Chem,2014,16(5):2680-2688.
[15] Paraskar A S, Sudalai A. Co-catalyzed reductive cyclization of azido and cyano substitutedα,β-unsaturated esters with NaBH4: enantioselective synthesis of (R)-baclofen and (R)-rolipram[J]. Tetrahedron,2006,62(20):4907-4916.
[16] Lu X, Lin S. Pd(II)-bipyridine catalyzed conjugate addition of arylboronic acid toα,β-unsaturated carbonyl compounds[J]. J Org Chem,2005,70(23):9651-9653.
[17] Paquin J F, Stephenson C R J, Defieber C,etal. Catalytic asymmetric synthesis with Rh-diene complexes: 1, 4-addition of arylboronic acids to unsaturated esters[J]. Org Lett,2005,7(17):3821-3824.
[18] Lukin K, Zhang Q, Leanna M R. Practical method for asymmetric addition of arylboronic Acids toα,β-unsaturated carbonyl compounds utilizing an in situ prepared rhodium catalyst[J]. J Org Chem,2009,74(2):929-931.
[19] Morigaki A, Tanaka T, Miyabe T,etal. Rhodium (I)-catalyzed 1, 4-conjugate arylation towardβ-fluoroalkylated electron-deficient alkenes: a new entry to a construction of a tertiary carbon center possessing a fluoroalkyl group[J]. Org Biomol Chem,2013,11(4):586-595.
[20] López F, Harutyunyan S R, Meetsma A,etal. Copper-catalyzed enantioselective conjugate addition of Grignard reagents toα,β-unsaturated esters[J]. Angew Chem Int Ed,2005,44(18):2752-2756.
[21] Appella D H, Moritani Y, Shintani R,etal. Asymmetric conjugate reduction ofα,β-unsaturated esters using a chiral phosphine-copper catalyst[J]. J Am Chem Soc,1999,121(40):9473-9474.
[22] Peng Z H, Woerpel K A. Stereoselective synthesis of substitutedγ-butyrolactones by the [3+2] annulation of allylic silanes with chlorosulfonyl isocyanate: enantioselective total synthesis of (+)-Blastmycinone[J]. Org Lett,2001,3(5):675-678.
[23] de Gonzalo G, Brieva R, Sánchez V M,etal. Enzymatic resolution oftrans-4-(4′-fluorophenyl)-3-hydroxymethylpiperidines, key intermediates in the synthesis of (-)-paroxetine[J]. J Org Chem,2001,66(26):8947-8953.
[24] Hughes G, Kimura M, Buchwald S L. Catalytic enantioselective conjugate reduction of lactones and lactams[J]. J Am Chem Soc,2003,125(37):11253-11258.
[25] Rainka M P, Milne J E, Buchwald S L. Dynamic kinetic resolution ofα,β-unsaturated lactones through asymmetric copper-catalyzed conjugate reduction: application to the total synthesis of eupomatilone-3[J]. Angew Chem Int Ed,2005,44(38):6177-6180.
[26] Lipshutz B H, Servesko J M, Taft B R. Asymmetric 1,4-hydrosilylations ofα,β-unsaturated esters[J]. J Am Chem Soc,2004,126(27):8352-8353.
[27] Hou C J, Guo W L, Hu X P,etal. Chiral ferrocenyl phosphine-phosphoramidite ligands for Cu-catalyzed asymmetric conjugate reduction ofα,β-unsaturated esters[J]. Tetrahedron: Asymmetry,2011,22(2):195-199.
[28] Moritani Y, Appella D H, Jurkauskas V,etal. Synthesis ofβ-alkyl cyclopentanones in high enantiomeric excess via copper-catalyzed asymmetric conjugate reduction[J]. J Am Chem Soc,2000,122(28):6797-6798.
[29] Lipshutz B H, Servesko J M, Petersen T B,etal. Asymmetric 1,4-reductions of hinderedβ-substituted cycloalkenones using catalytic SEGPHOS-ligated CuH[J]. Org Lett,2004,6(8):1273-1275.
[30] Lipshutz B H, Frieman B A, Unger J B,etal. Thermally accelerated asymmetric hydrosilylations using ligated copper hydride[J]. Can J Chem,2005,83(6/7):606-614.
[31] Lipshutz B H, Frieman B A. CuH in a bottle: A convenient reagent for asymmetric hydrosilylations[J]. Angew Chem Int Ed,2005,44(39):6345-6348.
[32] Jurkauskas V, Sadighi J P, Buchwald S L. Conjugate reduction ofα,β-unsaturated carbonyl compounds catalyzed by a copper carbene complex[J]. Org Lett,2003,5(14):2417-2420.
[33] Lipshutz B H, Servesko J M. CuH-catalyzed asymmetric conjugate reductions of acyclic enones[J]. Angew Chem Int Ed,2003,42(39):4789-4792.
[34] Schmuck C, Wennemers H. In highlights in bioorganic chemistry: methods and application[M]. Wiley-VCH: Weinheim,2004:63-89.
[35] Juaristi E, Soloshnok V J. Enantioselective synthesis ofβ-amino acids[M]. Hoboken: Wiley & Sons, Inc,2005.
[36] Cole D C. Recent stereoselective synthetic approaches toβ-amino acid[J]. Tetrahedron,1994,50(32):9517-9582.
[37] Weiner B, Szymański W, Janssen D B,etal. Recent advances in the catalytic asymmetric synthesis ofβ-amino acids[J]. Chem Soc Rev,2010,39(5):1656-1691.
[38] Tang W, Zhang X. New chiral phosphorus ligands for enantioselective hydrogenation[J]. Chem Rev,2003,103(8):3029-3070.
[39] 马元辉,张勇健,张万斌.β-胺基丙烯酸酯衍生物的不对称催化氢化反应研究进展[J].有机化学,2007,27(3):289-297.
[40] Bruneau C, Renaud J L, Jerphagnon T. Synthesis ofβ-aminoacid derivativesviaenantioselective hydrogenation ofβ-substituted-β-(acylamino)acrylates[J]. Coord Chem Rev,2008,252(5):532-544.
[41] Rainka M P, Aye Y, Buchwald S L. Copper-catalyzed asymmetric conjugate reduction as a route to novelβ-azaheterocyclic acid derivatives[J]. Proc Natl Acad Sci USA,2004,101(16):5821-5823.
[42] Deng J, Hu X P, Huang J D,etal. Enantioselective synthesis ofβ-aryl-γ-amino acid derivatives via Cu-catalyzed asymmetric 1,4-reductions ofγ-phthalimido-substitutedα,β-unsaturated carboxylic acid esters[J]. J Org Chem,2008,73(15):6022-6024.
[43] Wu Y, Qi S B, Wu F F,etal.Synthesis ofβ-amino acid derivatives via copper-catalyzed asymmetric 1,4-reduction ofβ-(acylamino)acrylates[J]. Org Lett,2011,13(7):1754-1757.
[44] Sui Y Z, Fang Q, Li M,etal. Cu(II)-catalyzed enanti oselective conjugate reduction for the synthesis ofN-Arylβ-amino acid esters[J]. Chin J Chem,2012,30:2611-2614.
[45] Seebach D. Methods of reactivity umpolung[J]. Angew Chem Int Ed,1979,18(4):239-258.
[46] Czekelius C, Carreira E M. Catalytic enantioselective conjugate reduction ofβ,β-disubstituted nitroalkenes[J]. Angew Chem Int Ed,2003,115(39):4941-4943.
[47] Czekelius C. Carreira E M. Convenient catalytic, enantioselective conjugate reduction of nitroalkenes using CuF2[J]. Org Lett,2004,6(24):4575-4577.
[48] Ren Y L, Xu X L, Sun K P,etal. A new and effective method for providing optically active monosubstituted malononitriles: selective reduction ofα,β-unsaturated dinitriles catalyzed by copper hydride complexes[J]. Tetrahedron: Asymmetry,2005,16(24):4010-4014.
[49] Lee D, Kim D, Yun J. Highly enantioselective conjugate reduction ofβ,β-disubstitutedα,β-unsaturated nitriles[J]. Angew Chem Int Ed,2006,45:2785-2787.
[50] Lee D, Yang Y M, Yun J. Copper-catalyzed asymmetric reduction of 3,3-diarylacrylonitriles[J]. Org Lett,2007,9(14):2749-2751.
[51] Llamas T, Arrayas R G, Carretero J C. Catalytic asymmetric conjugate reduction ofβ,β-disubstitutedα,β-unsaturated sulfones[J]. Angew Chem Int Ed,2007,119(18):3393-3396.
[52] Hayashi T, Senda T, Takaya Y,etal. Rhodium-catalyzed asymmetric 1,4-addition to 1-alkenylphosphonates[J]. J Am Chem Soc,1999,121(49):11591-11592.
[53] Duan Z C, Hu X P, Wang D Y,etal. Enantioselective synthesis of optically active alkanephos-phonates via rhodium-catalyzed asymmetric hydrogenation ofβ-substitutedα,β-unsaturated phosphonates with ferrocene-based monophosphoramidite ligands[J]. Adv Synth Catal,2008,350(13):1979-1983.
[54] Duan Z C, Hu X P, Wang D Y,etal. Cu-catalyzed asymmetric conjugate reduction ofβ-substitutedα,β-unsaturated phosphonates: an efficient synthesis of optically activeβ-stereogenic alkylphosphonates[J]. Tetrahedron Lett,2009,50(48):6720-6722.
Progress in Copper-Catalyzed Asymmetric Hydrosilylation 1,4-Reduction of
α,β-Unsaturated Michael Acceptors
FANG Qiang1,2, SUI Yaozong1, YU Jinglu1, XIE Linjie1, YANG Liyao1, WU Junwen1, WU Jing1
(1.College of Material, Chemistry and Chemical Engineering, Hangzhou Normal University, Hangzhou 310036,China;
2.College of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou 310035,China)
Abstract:Recent progress in copper-catalyzed asymmetric hydrosilylation 1,4-reduction of α,β-unsaturated Michael acceptors, including α,β-unsaturated esters, ketone, amino acid ester, nitrile, sulfone and phosphonic acid ester, is discussed.
Key words:chiral copper catalysts; asymmetric hydrosilylation; 1,4-reduction; α,β-unsaturated Michael acceptors

第14卷第1期2015年1月杭州师范大学学报(自然科学版)JournalofHangzhouNormalUniversity(NaturalScienceEdition)Vol.14No.1Jan.2015
文章编号:1674-232X(2015)01-0001-10
中图分类号:O621.3
文献标志码:A
doi:10.3969/j.issn.1674-232X.2015.01.001
通信作者:吴静(1968—),女,教授,博士,主要从事不对称催化领域的基础和应用研究. E-mail: jingwubc@hznu.edu.cn
基金项目:国家自然科学基金项目( 91127010, 21172049, 21032003);教育部“创新团队发展计划”项目(IRT1231);浙江省自然科学基金项目(LZ13B030001).
收稿日期:2014-12-20
