柞蚕抗病活性物质的提取及应用
2015-02-24李树英
李树英
(辽宁省农业科学院大连生物技术研究所,辽宁大连 116024)
柞蚕抗病活性物质的提取及应用
李树英
(辽宁省农业科学院大连生物技术研究所,辽宁大连 116024)
介绍了柞蚕抗病活性物质的诱导方法、检测方法,不同诱导源、不同柞蚕品种的诱导效果,不同诱导时间产生抗菌物质活性的差异,柞蚕抗病活性物质的制备方法,以及柞蚕抗病活性物质在治疗病毒性乙型肝炎、刺参养殖、仔猪饲养中的应用效果,展望了柞蚕抗菌肽在食品防腐方面的应用前景。
柞蚕滞育蛹;抗病活性物质;抗菌肽;诱导;制备;应用
昆虫虽没有高等动物那样完善的免疫体系,但其先天免疫和获得性免疫能力却是惊人的[1-3]。近几年来,对昆虫免疫和防御机制的研究发现,给蜡螟(Galleriamellonella)、蓖麻蚕(Philosamiacynthiaricini)、天蚕(Hyalophoracecmpia)、柞蚕(Anthereaepermyi)、家蚕(Bombyxmori)及棕尾别麻蝇(Sarcophagapregrina)的幼虫或蛹注射非致病细菌、菌疫苗、生理盐水、水溶性粒子等,均能诱导血淋巴产生免疫活性多肽和蛋白。其中被称为抗菌肽的一族碱性多肽具有较强的广谱杀菌能力,可杀死l0余种革兰氏阴性和革兰氏阳性细菌。麻蝇幼虫所产生的凝集素能激活小鼠巨噬细胞产生抗癌物质并可激活人的白细胞产生γ-干扰素[1-2,4-6]。这些现象不仅使昆虫学界产生兴趣,也引起了其他科学领域学者的重视。能否将昆虫的抗病活性物质提取出来为人类所用,已成为科学界研究的重要课题。
柞蚕是一种经济昆虫,饲养于野外,经常受到各种病毒、细菌等的侵染及自然界一些恶劣环境的袭击,却能得以生存和繁衍。试验中曾给5龄柞蚕口服10万个柞蚕病毒和上亿个致病细菌,仍能存活,说明柞蚕具有独特的防御、免疫系统和很强的抗病毒、抗细菌能力。现将柞蚕抗病活性物质的提取,以及柞蚕抗病活性物质在日常生活中的应用及前景介绍如下。
1 柞蚕抗病活性物质的诱导
许多研究已经证实[7-9 ],在柞蚕体内的血淋巴中,存在若干种抗病活性物质,但由于数量稀微,难以提取。若要形成工业提取规模,就必须先采取生物诱导的专门技术处理,激发柞蚕的防御机制,促使其生成足量的抗病活性物质。
1.1 柞蚕抗病活性物质的诱导方法
通常采用的诱导源为大肠杆菌突变株(Escherichia coli Kl2D31),将大肠杆菌接种于培养基中,于37 ℃条件下培养24 h,转接于相同液体培养基中培养6~7 h,用无菌昆虫生理盐水稀释制成菌悬液备用(104~106个/mL菌体)。
将上述制备的诱导源分别注射于柞蚕蛹体内,每头蛹注射50 μL。把注射后的柞蚕蛹置于22 ℃的温度条件下培养,每隔24 h取血样1次做活性检测,待活性达到高峰时,分离提取柞蚕抗病活性物质。
1.2 柞蚕抗病活性物质的检测方法
正常柞蚕蛹体内的抗病活性物质含量很低,当用柞蚕链球菌等处理后,体内的抗病基因迅速被激活,从而合成一系列抗病活性物质用来抵抗外源微生物的侵染。这些活性物质主要成分有柞蚕抗菌肽、柞蚕溶菌酶和柞蚕凝集素等。
柞蚕抗菌肽:是一类碱性小肽,对热十分稳定,等电点pI为10。现已发现柞蚕抗菌肽有抗菌肽D、抗菌肽A、抗菌肽B。其中,抗菌肽D的分子量为3.8 kDa,由36个氨基酸组成,其C末端是封闭的。
柞蚕抗菌肽具有广谱杀菌效果,能杀死多种革兰氏阳性和革兰氏阴性细菌。其作用机理主要是损伤细菌细胞膜结构,菌体表面出现微细小孔使内含物外泄,最后菌体崩坏而死亡。
柞蚕溶菌酶:是一种碱性蛋白,分子量约为14 kDa,可溶解细菌。溶菌酶被认为是昆虫体液免疫的重要因子。柞蚕溶菌酶与大蜡螟、惜古比天蚕溶菌酶相似,与鸡溶菌酶相比,柞蚕溶菌酶的赖氨酸及谷氨酸较多。
柞蚕凝集素:是一种糖蛋白,SDS-聚丙烯酰胺凝胶电泳证实是由10个分子38 kDa的亚基组成。具有促进小鼠淋巴细胞增殖和增强免疫调节的作用;通过高度专一识别恶性肿瘤细胞表面糖蛋白中糖链的变化而进行肿瘤诊断,并能将药物定向送至肿瘤组织与药物一起发挥“生物导弹”的作用 。
由于它们均受柞蚕蛹抗病基因的统一调控,因此各组分之间的活性比例是稳定的,并呈正相关关系。其中,柞蚕抗菌肽的活性检测方法比较简单,易于操作。所以,我们一般用抗菌活性的大小来表示柞蚕抗病活性物质的含量。
柞蚕抗菌活性物质测定参照参考文献[1]和参考文献[10]的琼脂孔穴扩散法进行,具体方法如下。
样品的处理:在冰浴下采取诱导蛹血淋巴(血淋巴冻干物按1∶10,溶于生理盐水),然后置100 ℃水浴中加热5 min,取上清液于3 000 r/min,离心5 min,取离心上清液为供试样品。
抗菌活性物质测定:一是大肠杆菌菌液的制备。用接种环挑取大肠杆菌Escherichia coli Kl2D31斜面菌种接种于液体应用培养基中,37 ℃静止培养16 h。从中吸取0.2 mL培养菌液再转接于新鲜的5 mL液体应用培养基中,37 ℃振荡培养4~6 h,使每毫升菌液约含大肠杆菌Escherichia coli Kl2D31106个左右。二是检测平板的制备。将l00 mL LB固体培养基溶化后降温至55 ℃,按终浓度2%加E+B缓冲液(50倍)、1.0%葡萄糖溶液(20%)、0.1%硫酸链霉素(250 000 U/mL),充分混匀后加人大肠杆菌菌液50 μL。迅速振荡充分混匀后,倾入玻璃培养皿内,6.5 mL/皿,水平放置,凝固后4 ℃保存备用。三是抗菌活力的测定。用打孔器在检测平板上打出直径2.7 mm的小圆孔,并对待测样品、对照样品编号。分别吸取待测样品和对照样品各5 μL,按编号逐一注入小孔中,每个样品设3个重复。每块平板上都带有对照样品作为内控。盖好皿盖,静置10 min后,倒置于37 ℃恒温箱中培养12~18 h,可见清晰的抑菌圈。用游标尺测量其直径,分别记录待测样品和对照样品的抑菌圈直径,并通过其平均值,按公式IU=2X×1 000,X=(抑菌圈直径-2.7 mm)÷2.1,计算样品的活力单位(IU)。
1.3 不同诱导源的诱导效果
采用大肠杆菌Escherichia colik Kl2D31、柞蚕链球菌1212、灭活的柞蚕NPV、柞蚕绢丝腺等诱导柞蚕蛹,比较不同诱导源诱导的柞蚕蛹产生抗病活性物质的效果。将不同诱导源给柞蚕蛹注射后,分不同时间取出蛹血淋巴做杀菌活性测定,以大肠杆菌为对照。结果表明,柞蚕链球菌1212一组的诱导活性水平最高,是大肠杆菌诱导活性的2倍左右,在体内持续的时间也最长(280 h后才消失);灭活的柞蚕NPV和柞蚕微孢子虫一组的诱导活性低于对照大肠杆菌;柞蚕5龄末期绢丝腺诱导活性水平最低,在体内持续时间也短[10](图1)。大多数诱导源一般在诱导后72~96 h,抗菌物质活性达到高峰。这似乎表明,不同异源物质与刺激柞蚕滞育蛹免疫系统应答反应的强弱有一定的关系。
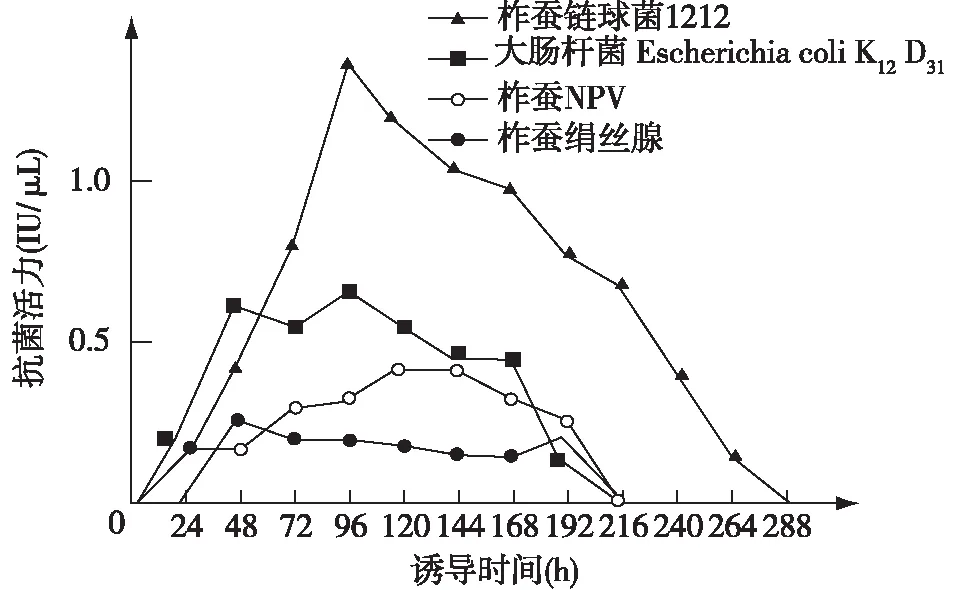
图1 柞蚕链球菌1212、灭活的柞蚕NPV、大肠杆菌 Escherichia coli Kl2D31和柞蚕绢丝腺,诱导柞蚕蛹 产生抗菌物质的活性曲线

图1 柞蚕链球菌1212、灭活的柞蚕NPV、大肠杆菌 Escherichia coli Kl2D31和柞蚕绢丝腺,诱导柞蚕蛹 产生抗菌物质的活性曲线
1.4 不同品种柞蚕蛹的诱导效果
在以制备抗病活性物质为目的的大量诱导试验中观察到,在相同的诱导条件下,不同品种的柞蚕蛹,诱导的抗菌物质活性有明显差异[11]:用供试的27个柞蚕二化性品种和辽宁省当地的2个一化性品种滞育蛹测试。每个品种随机取20头蚕蛹(雌、雄各l0头),分别在柞蚕链球菌诱导前和诱导后,每隔24 h取血1次测定。实验结果表明,一是所有供试的柞蚕品种滞育蛹,在诱导前血淋巴中都检测不到抗菌活性物质,但经柞蚕链球菌诱导后则均能产生抗菌活性物质。二是不同柞蚕品种滞育蛹诱导的抗菌物质活性,在体内产生和持续的时间存在着明显的差异。在诱导后24 h,能检测出抗菌物质活性的有13个品种;而在诱导48 h后,则所有品种均能检测出抗菌物质活性;之后,随着诱导时间的延长,抗菌物质活性逐渐增高,达到高峰后又逐渐下降直到消失。大部分品种诱导的抗菌物质活性,在体内持续的时间为9~10 d,少数品种可长达12 d,而最短的只有5 d。三是不同柞蚕品种滞育蛹经诱导后,产生抗菌物质活性高峰的时间不同。诱导后2~3 d,抗菌物质活性达到高峰的有4个品种,4~5 d达到高峰的有8个品种,6~7 d达到高峰的有7个品种,8~9 d达到高峰的则有10个品种。从试验的29个柞蚕品种滞育蛹诱导产生抗菌物质活性的消长规律来看,不同品种诱导抗菌物质活性达到高峰的时间,与其抗菌物质活性的高低有关,诱导抗菌物质活性高的品种,其活性高峰出现的较晚,反之,则较早。
将不同柞蚕品种滞育蛹诱导抗菌物质活性的高峰值进行比较(图2),不同柞蚕品种的滞育蛹诱导抗菌物质活性存在明显的差异[11],就供试的27个二化性品种抗菌物质活性高峰值来看,可大致分为3个部分。第1部分抗菌物质活性较低的有8个品种,活性在0.2~0.7 IU/μL;第2部分的有l3个品种,活性在0.7~1.1 IU/μL;第3部分活性最高,有6个品种,活性在1.3~1.6 IU/μL。抗菌物质活性最高的和最低的相差7倍多。此外,辽宁当地2个一化性品种滞育蛹诱导的抗菌物质活性明显低于二化性品种。

1-定州1号,2-柞杂2号,3-宽青,4-短刚毛,5-鲁红,6-辽青,7-741,8-克青,9-河33,10-青皮,11-河5号,12-黄2号,13-青6号,14-青黄1号,15-黄安东,16-三里丝,17-3117,18-河6号,19-鲁杂2号,20-白蚕,21-清河,22-柞早1号,23-方山2号, 24-胶蓝,25-双青,26-B,27-64,28-松黄,29-鲁黄图2 柞蚕不同品种、不同化性滞育蛹诱导 抗菌物质活力高峰值的比较
1.5 不同诱导时间产生抗菌物质活性的差异
同一柞蚕品种,用相同的诱导源诱导,经过不同时间,产生的抗菌物质活性有很大差异,随着诱导时间的增加,活性增强,第4~5 天活性达到高峰,持续一段时间后逐渐下降,最后消失(图3)。用柞蚕链球菌1212诱导柞蚕滞育蛹,分别在不同诱导时间采取柞蚕蛹血淋巴做聚丙烯酰胺电泳,结果表明,诱导24 h检测不到抗菌活性物质,诱导48 h可以检测到抗菌蛋白(P5)和抗菌肽D,诱导96 h也可以同时检测到抗菌肽A,诱导120 h可以同时检测到4种抗菌组分。由此说明,抗菌蛋白和抗菌肽D合成较早,其合成水平也大大高于抗菌肽A和抗菌肽B[10]。

图3 不同诱导时间产生的抗菌物质活性
2 柞蚕抗病活性物质的制备方法
柞蚕二化性品种青6号、抗大,雌雄均可。采摘后的柞蚕茧置于室温放置1个月左右,使其完成变态,进入滞育。然后将柞蚕茧置0.4 ℃条件下保存。制备柞蚕抗病物质时割茧取蛹,以柞蚕链球菌1212作诱导剂,对柞蚕蛹进行诱导处理,以激活和调动柞蚕蛹的免疫防御系统而合成抗病物质。经诱导处理后的柞蚕蛹放置4~5 d,抗病物质活性达到高峰值时,冰浴下采集血淋巴,经过提取、精制、冷冻或喷雾干燥即得柞蚕抗病活性物质的干粉(图4)。
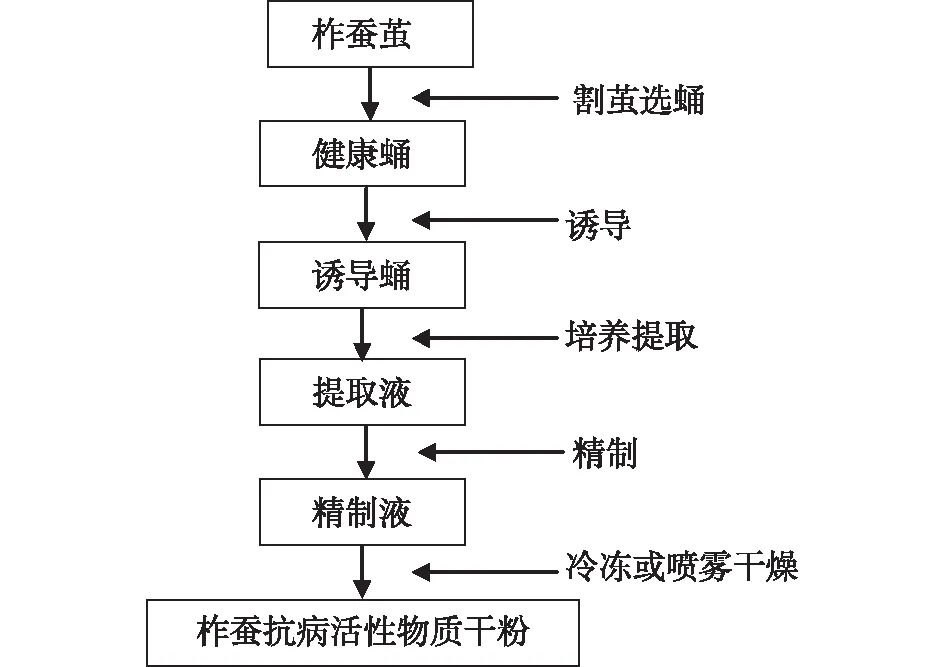
图4 柞蚕抗病活性物质制备工艺
3 柞蚕抗病活性物质的应用
柞蚕抗病活性物质是柞蚕滞育蛹经诱导后,体内的防卫系统被迅速激活,从而合成一系列生物活性物质。然而,其免疫防卫系统与哺乳动物不同,为非专一性,即不论用什么诱导方法,其产生的物质种类基本相同,这就为其广泛应用于动植物疾病的预防及治疗提供了可能。
3.1 柞蚕抗病活性物质在治疗病毒性乙型肝炎的应用
乙型肝炎是危害人类健康最主要传染病之一,危害极大。据统计,目前慢性病毒性乙型肝炎病毒携带者,约占世界人口的20%,每年约有超过100万人死于乙型肝炎病毒感染相关疾病,我国是乙型肝炎的高发区,慢性乙型肝炎病毒感染者约1.2亿,占了全世界感染者的1/3以上[12]。
近年来,在医药研究方面,世界上越来越多的科学家已把注意力从有机、无机合成制药转到生物制药上来,特别对占世界动物总数4/5的昆虫更是予以极大的关注。昆虫结构简单、器官原始,但却有其独特的防御免疫系统和强大的抗病力,应用柞蚕抗病活性物质治疗乙型肝炎,开辟了昆虫制药新领域。
20世纪90年代初我们开始了利用柞蚕抗病活性物质治疗乙型肝炎的研究,毒理学试验表明,柞蚕抗病活性物质对实验动物无毒副作用,且对生长起促进作用[12];卫生部规定的“鸭乙肝动物模型”实验表明,一定剂量的柞蚕抗病活性物质对鸭乙型肝炎病毒(Duck hepatitis B virus)有明显抑制作用;上海市传染病医院30例患者经本品治疗3个月,有12例HBeAg(Hepatitis B e antigen,乙型肝炎E抗原)转阴,转阴率40%;有1例HBsAg(Hepatitis B surface antigen,乙型肝炎表面抗原)转阴。有19例转氨酶治疗前异常,治疗后有18例恢复正常,有效率为94.7%;降黄疸有效率为81.25%,并对改善乏力、纳差、腹胀、肝区痛等症状也有明显的作用[13]。另外,对提高球蛋白,降低白蛋白也有一定的效果。临床结果表明,柞蚕抗病活性物质对治疗病毒性乙型肝炎有一定的疗效。
3.2 柞蚕抗病活性物质在刺参养殖中的应用
刺参(Apostichopusjaponicus),又称仿刺参,海参纲,刺参科,在我国北方俗称海参。自古以来,海参与人参几近齐名,作为高级滋补品和中医药膳,海参被冠为肴品海八珍之首。刺参是海参种类里营养价值和药用价值较高者,在我国以辽宁、山东等地出产的刺参品质最优;但随着养殖规模的扩大,刺参病害问题日趋突出,已成为限制刺参养殖业发展的瓶颈。在解决刺参病害问题上,传统做法就是使用抗生素类药物,超剂量使用抗生素造成了刺参生物体、养殖水体中存在大量残留的抗生素,对人类健康造成极大的威胁。因此,在刺参养殖中,抗生素替代品的研发已成为急需解决的重要问题。
2010年初开始,我们开展了利用柞蚕抗病活性物质作为饵料添加剂应用于海参育苗研究(因正在申报专利,没有发表文章),通过试验证明,由于其既含有抗菌肽、溶菌酶、凝集素等多种生物活性物质,又含有丰富的昆虫蛋白质、脂肪等营养物质;因此,既有促进海参生长,又可增强海参机体免疫功能和提高抗病性的作用,为今后实现海参及其它水产品绿色、健康养殖提供了可能。
3.3 柞蚕抗病活性物质在仔猪饲养中的应用
仔猪腹泻一直以来是养猪业非常头疼的一个问题,也是制约养猪业发展的一个瓶颈,仔猪腹泻可导致生长停滞,甚至生长倒退,严重者引起死亡,给养猪生产者造成极大的经济损失。引起仔猪腹泻的原因是多方面的,但从发病原因上看,总体上可分为生理性、病理性两大类。生理性腹泻主要是断奶后,由于饲料、管理、环境等发生变化,造成肠道菌群失调、免疫下降等所致;病理性腹泻主要原因是病原微生物的感染所致,尤其是病原性大肠杆菌、轮状病毒感染等。
根据多年研究结果[13],柞蚕抗病活性物质具有抗菌、抗病毒和增强机体免疫功能的作用,并且在原来实验的基础上,2014年又开展了这方面的研究,结果表明,柞蚕抗病活性物质具有增强仔猪免疫功能、减少腹泻发生、降低死亡率的作用,并能促进仔猪生长。
3.4 柞蚕抗菌肽在食品防腐方面的应用前景
柞蚕抗菌肽是一类由36个氨基酸组成的广谱性杀菌多肽,一方面抗菌谱证明,对造成食品腐败的多种革兰氏阳性和革兰氏阴性细菌均有杀灭作用,同时食入后易被体内蛋白酶水解消化,对人体无毒副作用;另一方面,对热较稳定,适于食品的高温灭菌。因此,具备了食品防腐剂的基本特性,具有开发前景。
[1] Hoffmann D. Induction of antibacterial activity in the blood of the migratory locust, locusta migratoral[J].Insect physiology,1980, 26(8):539-550.
[2] 吕建秋,陈凤珍,黄自然.柞蚕蛹溶菌酶的诱导与提取[J].蚕业科学,1990,16(4): 213-218.
[3] 屈贤铭,祁国荣,黄自然,等.注射大肠杆菌和超声波、诱导蚕体和蚕蛹产生抗菌物质的比较研究[J].昆虫学报,1984, 27(3):168-272.
[4] Boman H G,Steiner H.Immunity in cecropia pupae current topic in micmbiology[J]. Immunology,1981,(94/95):75-89.
[5] 黄自然,王少颐.注射大肠杆菌诱导柞蚕蛹血淋巴产生抗菌物质[J].华南农学院学报, 1981,2(1):65-68.
[6] 张春发,丁杰,李敬涛,等.柞蚕抗病机制及抗病物质的研究——Ⅳ.柞蚕消化液的血凝活性[J].蚕业科学,1987,13(2):121-122.
[7] 屈贤铭,祁国荣,黄自然.注射大肠杆菌或超声波诱导家蚕及蓖麻蚕产生抗菌物质的比较研究[J].昆虫学报,1984, 27(3):275-278.
[8] 周奇,黄自然,卢蕴良,等.柞蚕蛹抗菌物质的诱导源的研究[J].华南农学院学报, 1983,4(4):1-7.
[9] 祁国荣,周奇,屈贤铭,等.超声波诱导柞蚕蛹血淋巴产生抗菌物质[J].科学通报, 1983,(10): 625-625.
[10]张春发,丁杰,卢长祯,等.柞蚕抗病机制及抗病物质的研究——Ⅰ.柞蚕肠道致病菌等诱导柞蚕蛹产生抗菌物质的比较研究[J].蚕业科学,1985,11 (4):226-230.
[11]张春发,丁杰,卢长祯,等.柞蚕抗病机制及其抗病物质的研究——Ⅱ.不同柞蚕品种滞育蛹诱导抗菌物质活性的比较[J].蚕业科学,l986,12(1):43-47.
[12]丁然.慢性乙型病毒性肝炎的中医病位研究[D].北京:中国中医科学院,2013.
[13]张国德,姜德富.中国柞蚕[M].沈阳:辽宁科学技术出版社,2003:885-909.
2015-01-14;接受日期:2015-01-25
李树英(1959—),男,研究员。 Tel:13804965751,E-mail:13804965751@163.com
S885.1
B
1007-0982(2015)01-0020-05
