乳腺叶状肿瘤病理研究新进展
2015-02-24孔丽丽,曹岚清,许传杰等
乳腺叶状肿瘤病理研究新进展
孔丽丽,曹岚清,许传杰,张莲,孙梅*
(吉林大学第二医院 病理科,吉林 长春130041)
乳腺叶状肿瘤(Phyllodes tumour,PT),原名乳腺叶状囊肉瘤,1838年由Mailer首次描述并命名,但由于该名称常引起误解,自1982年起WHO开始使用中性名称“叶状肿瘤”。该肿瘤最典型的特征是形成叶状结构,突向囊腔内,由间质和上皮两种成分组成,生物学行为难以预测。叶状肿瘤可以侵犯邻近乳腺组织,还可以复发、转移和恶变。目前WHO按照组织学特征将PT分为良性、交界性和恶性,但目前临床对PT三个级别的界定尚无明确的标准,对其局部复发及远处转移的预测也缺乏精确有效的指标,而近些年来,免疫组织化学和分子生物学手段的广泛应用,使人们更加深入地认识PT的特点和发病机制,为此病的诊断、治疗及预后提供了必要的理论参考。
1临床特征
乳腺叶状肿瘤是一种少见的纤维上皮性肿瘤,占所有乳腺纤维上皮性肿瘤的2.5%,占所有乳腺原发性肿瘤不足1.0%[1]。据文献报道,乳腺叶状肿瘤任何年龄均可发生,但主要见于中年妇女(40-50岁),平均年龄为45岁[2]。本病男性罕见,仅有个案病例报道[3]。叶状肿瘤发病原因尚不清楚,可能与种族、年龄、生育授乳、内分泌等多种因素有关,该肿瘤常为原发,但也有文献报道,其起源于先前存在的纤维腺瘤,发病年龄比纤维腺瘤平均发病年龄晚15-20年[4]。
2病理检查
2.1 大体所见
肿瘤直径0.5-27 cm,平均5-7.2 cm[5],无包膜,良性肿瘤边界通常清楚,恶性肿瘤可侵及周围的乳腺组织。切面灰粉至棕褐色,特征性表现是切面见有裂隙或囊腔,间质结节呈叶状突入囊内。肿瘤多数坚实而有弹性,但也可能质软,呈粘液样或鱼肉样,有时还可见粗糙的钙化,另外,部分肿瘤可含有脂肪、软骨或骨等成分,体积大、高级别的肿瘤还可见出血或坏死。
2.2 镜下表现
乳腺叶状肿瘤由上皮和增生的间质两种成份构成,其间质细胞与普通型纤维腺瘤相比,有三个不同特点:(1)间质细胞在肿瘤的不同区域密度不同,一般在上皮周围间质细胞致密,常围绕上皮呈袖套样排列,而在远离上皮的区域间质细胞稀疏呈网格状,常有透明变性或者黏液变性。(2)叶状肿瘤的间质细胞可侵犯邻近乳腺组织,导致小叶轻度变形、脂肪组织卷入并杂乱分布于肿瘤内。(3)间质细胞会刺激陷入的腺体生长,导致肿瘤内导管形成不规则分支,结构复杂。叶状肿瘤另一典型特征是形成叶状结构并突入囊状裂隙,但并非所有的叶状肿瘤都具有此典型特征,所以不能仅依据叶状结构来诊断叶状肿瘤。肿瘤的上皮成分可发生鳞状上皮化生和大汗腺化生,间质可以发生脂肪、骨、软骨和骨骼肌等多种化生。偶见怪异型间质巨细胞,但不应作为恶性标志[6]。目前WHO将PT分为良性、交界性和恶性,其特征见下表。
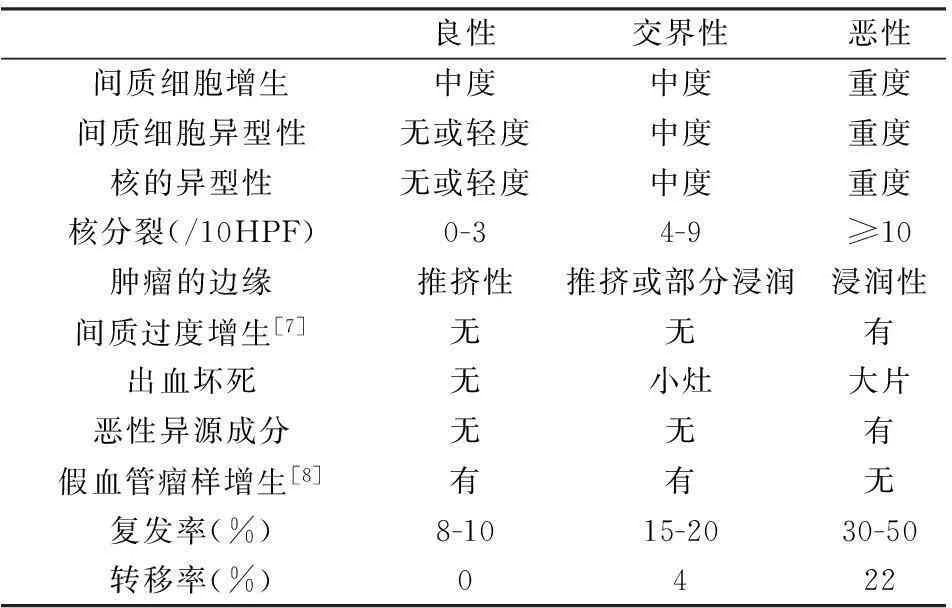
三种类型PT的临床病理特征[4,22]
用于区分良性、交界性和恶性PT的组织学特征应当综合来考虑,单独强调某一个特征可能导致过诊断,尤其是在核分裂像上[9]。而且很多文献认为该分级系统有一定的主观性[3,10]。Karim等[10]认为PT在组织学上不能识别的亚克隆也使得这种分级系统不能有效地反映临床预后。为进一步完善PT的分级系统精确判断临床预后,近些年来关于PT免疫组化和分子生物学的研究越来越多,这为PT的分级、诊断、鉴别诊断以及预测肿瘤的临床预后提供了很多帮助。
2.3 免疫组化
2.3.1Ki-67和P53文献报道,Ki-67和P53的表达率与PT的级别相关[11]。Ki-67是一种细胞增殖相关的抗原,在增殖细胞中表达而在静止细胞中不表达,故主要用于判断细胞的增殖活性。Ki-67的表达量在不同级别的乳腺叶状肿瘤中不同,在良性PT低表达,而在交界性和恶性则呈高表达[12]。
p53是最常见的抑癌基因之一,位于染色体17p13.1,绝大多数肿瘤的发生、发展伴有P53基因的突变。因此,p53被广泛用于多种肿瘤的预测和诊断。PT由良性发展为交界性的过程中,p53的表达量明显增加;而由交界性PT进一步发展为恶性PT的过程中,其表达量基本维持不变[13]。为此Ki-67和P53可用于鉴别良性和交界性。Kucuk[14]等也提议,可以将Ki-67和P53与组织学参数结合常规用于PT的分级诊断。
2.3.2MMPs基质金属蛋白酶(MMPs)是细胞外基质降解过程中的重要酶类,几乎能降解细胞外基质的所有成分。MMPs是一类自然进化中高度保守的酶,广泛分布于动植物体内,目前已发现26种人源MMPs,称为MMP家族。MMPs按结构和底物选择性可大致分为5类,分别是:胶原酶、明胶酶、基质溶素、膜型金属蛋白酶和其他。在正常稳定状态的组织中,MMPs表达量极少,而在涉及人体多种生理和病理过程中,如胚胎发生、炎症、血管形成、肿瘤侵袭和转移时,其表达量上升。研究发现,MMPs在人类几乎所有的肿瘤中都有表达的上调,其与肿瘤的生长,浸润和转移有关[15]。
MMP-14属于膜型金属蛋白酶,Kim等[16]研究发现随着叶状肿瘤级别的升高,MMP-14的表达率也升高,且交界性及恶性肿瘤的表达率明显高于良性肿瘤,而交界性与恶性肿瘤之间的差异则无统计学意义。Kim等还发现MMp-14与PT的复发相关,阳性者比阴性者有更高的复发率。
CD10(普通型急性淋巴母细胞性白血病抗原),也属于金属蛋白酶家族中的一员,研究发现CD10表达与叶状肿瘤的级别有关,表达量随着肿瘤级别的增高而增多[17-19]。不同级别之间CD10的表达量明显不同,在良性PT低表达,而在交界性和恶性明显升高。Al-Masri[20]等研究发现CD10的表达率还与转移率有关,CD10表达增多时转移率升高。在所有转移的PT中CD10强阳性,而CD10阴性的很少或者几乎不发生转移。
2.3.3HOXB13HOX基因是同源盒基因大家族中的一员,在进化过程中该基因具有高度的保守性,是细胞增殖、分化的调节基因,其表达失调会引起机体畸形、糖尿病、甚至肿瘤的发生。HOX基因分为A、B、C、D四组,共39个基因。HOXB13基因属于B组,位于17号染色体长臂21区,编码含285个氨基酸残基的转录调节因子。研究发现HOXB13基因与肾细胞癌、宫颈癌、前列腺癌等多种恶性肿瘤有关。Ang等[8]研究发现在乳腺PT中,HOXB13表达上调,在恶性尤其明显,其表达量分别是良性的2.85倍和交界性的2.77倍,而良性和交界性相比,HOXB13的表达量之间的差别不明显,其倍数仅为1.03,故可用来区分交界性与恶性叶状肿瘤。
2.3.4IMP3胰岛素样生长因子ⅡmRNA结合蛋白3(insulin-like growth factor Ⅱ mRNA binding protein 3,IMP3) 是一种具有高度保守性的mRNA结合蛋白,这种蛋白在胚胎发育时期,可以在多个组织中检测到,但正常成年机体内几乎不能被检测出[21]。研究发现,IMP3在胰腺癌、肺癌、肾癌和恶性间皮瘤等多种恶性肿瘤组织中都高表达的,因此IMP3被公认为一种癌胚蛋白。Yang[22]等统计显示IMP3仅在恶性PT中阳性,而交界性和良性的PT均为阴性,这样IMP3也可用于鉴别交界性和恶性的肿瘤。
另外,文献报道EGFR、CyclinA、CD117等生物标记物的表达率随PT的分级而增加[4,8,10];而CD34、ER/PR则相反[10,23]。
2.4 分子生物学
2.4.1染色体异常叶状肿瘤无论良恶性,至少有一个染色体发生改变,而且随着组织学级别的升高,异常的染色体的数目也会随着增多[8]。恶性者甚至可有多倍体。最常见的染色体异常就是1q的增加,一半以上的叶状肿瘤有1q的改变[4],其次是13q,6q,10p的缺失以及5p的增多。有文献报道3种级别的PT发生异常的染色体平均数分别是1;6;6[10]。
2.4.2启动子甲基化肿瘤相关基因启动子的甲基化是最常见的分子异常之一,其常见的机制是:肿瘤形成相关的基因,如抑制基因,DNA修复基因,转移抑制基因等,这些基因的启动子被甲基化,从而使该基因沉默,不能表达,最终导致肿瘤的形成。Huang等[24]对叶状肿瘤的基因甲基化进行研究,发现细胞周期与凋亡调控相关基因RASSFlA和细胞分化相关基因TWISTl的甲基化检测可用于鉴别纤维腺瘤和叶状肿瘤:TWISTl在纤维腺瘤中无甲基化,在叶状肿瘤中交界性和恶性肿瘤比良性肿瘤更易出现甲基化。RASSFlA在正常组织和纤维腺瘤中可少量甲基化,而叶状肿瘤中常为中高水平的甲基化,但甲基化程度与肿瘤的级别无相关性。Kim[25]等研究发现基因甲基化在交界性肿瘤和恶性肿瘤明显高于良性肿瘤,但交界性和恶性之间无明显差异。以上研究均提示基因改变在良性叶状肿瘤的生长过程中作用微弱,但从良性到交界性、恶性肿瘤的恶化发展过程中,基因的改变有着重要作用。
3叶状肿瘤的预后
所有叶状肿瘤均具有局部复发的潜能,平均复发率为21%,其中良性、交界性和恶性PT的复发率分别为7%、25%和27%。局部复发与多种因素有关。Tan等[26]认为复发率随级别升高而增加。Asoglu[27]等认为复发与肿瘤大小和切缘大小有关,若肿瘤直径大于10 cm,局部复发风险增加4倍;若切缘<1 cm,局部复发的风险增加5倍。Jang[5]等研究发现切缘的大小与复发无明显相关性,而切缘阳性是一个复发的高危因素,深入周围组织内非常小的肿瘤芽,在手术切除时可能残留下来并成为局部复发的来源。复发的肿瘤大多数与原先的肿瘤形态学上相一致,但研究发现肿瘤在复发的过程中获得新的基因改变,无论组织形态有无改变,其在分子水平已与原先肿瘤不同,生物学行为也随之改变[28]。文献报道,复发的肿瘤比原发肿瘤侵袭性增强,反复复发侵袭性会进一步增强[29]。叶状肿瘤少见转移,WHO统计PT总体转移率为10%,其中良性0,交界性4%,恶性22%。转移灶通常只有间质成分,而无上皮成分。转移率除与组织学级别有关外,还与CD10的表达有关。Al-Masri[20]等认为CD10表达增多,转移率随之升高。叶状肿瘤的间质成分可以发生恶变形成肉瘤[7],上皮成分可发生不典型增生和癌[29]。虽然肿瘤可以由良性向恶性逐渐演变,但是肿瘤内部存在的未能识别的不利的亚克隆,可能是肿瘤走向恶化的主要原因[10]。
4问题与展望
目前PT的诊断还是仅凭组织形态,虽然对PT相关生物学标志物的研究已开展很多,但绝大多数还未提供确切的研究结果,相信随着研究的不断深入,将会出现确切有效,高度敏感和特异的标志物,从而为乳腺PT的诊断、治疗及相关的药物开发提供充分的理论依据。
参考文献:
[1]McKenna AM,Pintilie M,Youngson B,Done SJ.Quantification of the morphologic features of fibroepithelial tumors of the breast[J].Arch Pathol Lab Med,2007,131(10):1568.
[2]Parker SJ,Harries SA.Phyllodes tumours[J].Postgrad Med,2001,77:428.
[3]Campagnaro EL,Woodside KJ,Xiao SY,et al.Cystosarcoma phyllodes(phyllodes tumour) of the male breast[J].Surgery,2003,133:689.
[4]Tse GM,Niu Y,Shi HJ.Phyllodes tumor of the breast:An update[J].Breast Cancer,2010,17:29.
[5]Jang JH,Choi MY,Lee SK,et al.Clinicopathologic risk factors for the local recurrence of phyllodes tumors of the breast[J].Ann Surg Oncol,2012,19(8):2612.
[6]Huo L,Gilcrease MZ.Fibroepithelial lesions of the breast with pleomorphic stromal giant cells:a clinicopathologic study of 4 cases and review of the literature[J].Ann Diagn Pathol,2009,13(4):226.
[7]Chia Y,Thike AA,Cheok PY,et al.Stromal keratin expression in phyllodes tumours of the breast:a comparison with other spindle cell breast lesions[J].J Clin Pathol,2012,65(4):339.
[8]Ang MK,Ooi AS,Thike AA,Tan P,Zhang Z,Dykema K,et al.Molecular classification of breast phyllodes tumors:Validation of the histologic grading scheme and insights into malignant progression[J].Breast Cancer Res Treat,2011,129:319.
[9]Lakhani SR,Ellis IO,Schnitt SJ,et al.WHO Classification of Tumours of the Breast[M].4th.Lyon:International Agency for Research on Cancer,2012:143-7.
[10]Karim RZ,O’Toole SA,et al.Recent insights into the molecular pathogenesis of mammary phyllodes tumours[J].J Clin Pathol,2013,66(6):496.
[11]Yonemori K,Hasegawa T,Shimizu C,Shibata T,Matsumoto K,Kouno T,et al.Correlation of p53 and MIB-1 expression with both the systemic recurrence and survival in cases of phyllodes tumors of the breast[J].Pathol Res Pract,2006;202(10):705.
[12]牛昀.乳腺叶状肿瘤免疫表型的研究进展[J].诊断病理学杂志,2010;17(1):7.
[13]Tan PH,Jayabaskar T,Yip G,et al.P53 and c-k it( CD117 ) protein expression as prognostic indicators in breast phyllodes tumors:a tissue microarray study[J].Mod Pathol,2005,18(12):1527.
[14]Kucuk U,Bayol U,et al.Importance of P53,Ki-67 expression in the differential diagnosis of benign/malignant phyllodes tumors of the breast[J].Indian J Pathol Microbiol,2013,56(2):129.
[15]Vu T,Werb Z.Matrix metalloproteinases:effectors of development and normal physiology[J].Genes Dev,2000,14:2123.
[16]Kim GE,Kim JH,et al.Stromal matrix metalloproteinase-14 expression correlates with the grade and biological behavior of mammary phyllodes tumors[J].Appl Immunohistochem Mol Morphol,2012,20(3):298.
[17]Tse GM,Tsang AK,Putti TC,et al.Stromal CD10 expression in mammary fibroadenomas and phyllodes tumours[J].J Clin Pathol,2005,58:185.
[18]Tsai WC,Jin JS,Yu JC,et al.CD10,actin,and vimentin expression in breast phyllodes tumors correlates with tumor grades of the WHO grading system[J].Int J Surg Pathol,2006,14:127.
[19]Ibrahim WS.Comparison of stromal CD10 expression in benign,borderline,and malignant phyllodes tumors among Egyptian female patients[J].Indian J Pathol Microbiol,2011;54(4):741.
[20]Al-Masri M,Darwazeh G,et al.Phyllodes Tumor of the breast:role of CD10 in predicting metastasis[J].Ann Surg Oncol,2012,19:1181.
[21]Takata A,Takiguchi S,Okada K,et al.Expression of insulin-like growth factor-II mRNA-binding protein-3 as a marker for predicting clinical outcome in patients with esophageal squamous cell carcinoma[J].Oncol Lett,2014,8(5):2027.
[22]Yang X,Kandil D,et al.Fibroepithelial tumors of the breast:pathologic and immunohistochemical features and molecular mechanisms[J].Arch Pathol Lab Med,2014,138(1):25.
[23]Ho SK,Thike AA,et al.Phyllodes tumours of the breast:the role of CD34,vascular endothelial growth factor and b-catenin in histological grading and clinical outcome[J].Histopathology,2013,63:393.
[24]Huang KT,Dobrovic A,et al.DNA methylation profiling of phyllodes and fibroadenoma tumours of the breast[J].Breast Cancer Res Treat,2010,124(2):555.
[25]Kim JH,Choi YD,Lee JS,et al.Borderline and malignant phyllodes tumors display similar promoter methylation profiles[J].Virchows Arch,2009,455(6):469.
[26]Tan PH,Thike AA,Tan WJ,et al.Predicting clinical behaviour of breast phyllodes tumours:A nomogram based on histological criteria and surgical margins[J].J Clin Pathol,2012,65:69.
[27]Asoglu O,Ugurlu M,Blanchard K,et al.Risk factors for recurrence and death after primary surgical treatment of malignant phyllodes tumors[J].Ann Surg Oncol,2004,11:1011.
[28]Jones AM,Mitter R,Springall R,et al.A comprehensive genetic profile of phyllodes tumours of the breast detects important mutations,intra-tumoral genetic heterogeneity and new genetic changes on recurrence[J].J Pathol,2008,214:533.
[29]Koerner FC.Diagnostic Problems in Breast Pathology[M].Singapore:Elsevier.2011:317-30.
(收稿日期:2014-07-24)
文章编号:1007-4287(2015)07-1228-04
*通讯作者
