阻断淀粉样前体蛋白-C端片段毒性通路对Cofilin磷酸化的影响
2015-02-24许妍姬
陈 慧,许妍姬
(延边大学医学院 预防医学教研室,吉林 延吉133000)
阻断淀粉样前体蛋白-C端片段毒性通路对Cofilin磷酸化的影响
陈慧,许妍姬*
(延边大学医学院 预防医学教研室,吉林 延吉133000)
摘要:目的本研究欲探讨阻断淀粉样前体蛋白-C端片段(Amyloid Precursor Protein C Terminal Fragments,APP-CTFs)毒性通路对Cofilin磷酸化的影响方法大鼠胚鼠大脑皮层神经元细胞培养,采取3种方法阻断APP-CTFs毒性通路。①APP-695转染后γ-内切酶抑制剂DAPT处理②利用YENPTY段删除的pEGFP-APP C99,C57转染至大鼠神经元细胞③GSK-3β抑制剂LiCl处理,3种方法阻断后,均采用蛋白印迹方法检测Ph-cofilin蛋白水平。结果DAPT处理组与未处理组比较Ph-cofilin蛋白表达水平降低(P<0.05)。转染YENPTY段删除的pEGFP-APP CTFs组未能明显增强磷酸化Cofilin的蛋白表达水平(P>0.05),虽然转染APP-CT99,57-pEGFP组与空载体对照组相比较,Ph-Cofilin蛋白表达水平明显增加(P<0.05)。LiCl处理组与非处理组相比,Ph-Cofilin蛋白表达无明显改变(P>0.05)。结论提示APP-CTFs诱导的Cofilin磷酸化过程与APP-CTFs核转移毒性通路有关,但与其诱导的GSK-3β-Tau毒性通路无关。
(ChinJLabDiagn,2015,19:1045)
到目前为止AD病的病因及发病机制尚不清楚,目前仍缺乏特异的治疗方法,因此世界各国医药界对AD的研究尤为重视,该领域已成为当今世界研究的热点[1]。研究AD的分子机制以寻找新的靶点是抗AD药物开发的集中所在。AD有各种发病假说,如胆碱能功能低下假说,炎症或免疫假说,基因突变假说,淀粉样蛋白假说,氧化应激及兴奋性毒性假说,凋亡假说等。其中淀粉样蛋白假说一直很受重视。最近淀粉样前体蛋白C端片段在发病机制里起重要作用的报道很多。淀粉样前体蛋白(Amyloid precursor protein,APP)依次经α-,β-,γ-分泌酶水解后形成不同长度C端片段APP-CTFs,APP-CTFs的毒性机制贡献于AD。其毒性机制是被各种酶切之后形成的AICD与Fe65结合进行核转移,后与CP2/LSF/LBP1转录因子结合刺激GSK-3β基因,增强Tau磷酸化[2-5]。
AD脑组织除老年斑和神经元纤维缠结之外,还包含Hirano bodies,是由肌动蛋白和其结合蛋白cofilin构成的节状结构[6-8]。老年性痴呆患者的脑皮质和海马回中发现的ADF/cofilin-肌动蛋白节状结构,在正常人脑中没有[9]。
我们在先前的研究中已发现APP-CTF转染可以使磷酸化-cofilin水平增高。此次我们想阻断APP-CTFs毒性通路对Cofilin磷酸化的影响。采取3种方法阻断APP-CTFs毒性通路。①APP-695转染后γ-内切酶抑制剂DAPT处理,阻断APP-CTF的产生②利用YENPTY段删除的pEGFP-APP C99,C57转染,阻断APP-CTF核内毒性通路。③处理GSK-3β抑制剂LiCl,阻断APP-CTF导致的Tau毒性通路。3种通路阻断后,均采用蛋白印迹方法检测Ph-cofilin蛋白水平。本研究在分子机制水平上更深层次地探讨APP-CTFs对cofilin基因表达的影响,可为AD的发病机制提供一个新的不同的毒性通路。
1材料与方法
1.1 材料
APP-CTFs[5]由韩国首尔医科大学药理学教室徐维宪教授馈赠。
1.1.1药品与试剂胰蛋白酶(Sigma);胎牛血清(Corning,N.Y,14831,USA);DMEM培养液(Grand Island,N.Y,14072,USA);Ph-cofilin和tubulin免疫染色抗体购于德国默克密理博公司;10%DF培养液由本实验室自配;NDiff Neuro-2(N2)培养基补充剂购于德国默克密理博公司;DMEM培养液购自Grand Island,N.Y,14072,USA;Lipofectamine 2000从invitrogen公司购买;辣根过氧化物山羊抗兔(抗属)抗体,以及相应WB封闭液、洗涤液、一抗二抗稀释液均从碧云天生物科技公司购买;胎牛血清;马血清;SPF级SD大鼠由延边大学动物科学实验中心饲养提供。
1.1.2实验仪器蛋白印迹电泳(转膜)装置、分析天平、生物显微镜、低高速容量离心机、恒温水浴锅、恒温CO2培养箱、立式压力蒸汽灭菌器、制冰机、移液器等均由延边大学医学院预防医学实验中心提供。
1.2 实验方法
1.2.1质粒的扩增、提取和纯化分别将含有重组质粒pEGFP-N1-APLP2-CTFs(C57,C99)[5]和空载体pEGFP-N1的菌种用Kan+培养基培养并选取单菌落,取单菌落至10 ml含Kan+的LB液体培养基中,于37℃、230 r/min振荡培养过夜,再转入200 ml LB液体培养基中扩大培养。按照质粒大量提取试剂盒说明提取、纯化质粒,并用紫外分光光度计测定质粒的浓度和纯度。
1.2.2胚胎神经元细胞培养选择怀孕16-18天的大鼠将其用乙醚麻醉,解剖腹部取出胚胎放入预冷的D-hank’s液中。剪开胚胎,取出仔鼠,用剪刀轻轻剪开颅骨,剥离掉最上层的脑膜后,直接取大脑皮层组织(此过程在超净台操作);将组织剪成约1 mm×1 mm块状并放置于新的D-hank’s液中离心;去上清液后的组织再加入0.25%的胰酶消化分解,于37 ℃水浴20 min。最后把消化过的组织用200目筛网进一步碾碎过筛,得到神经元细胞。
预先用含0.1%的多聚赖氨酸溶液包埋在盖玻片上,促使神经元细胞贴壁生长。刚获得的神经元细胞用含5%的马血清,10%胎牛血清的DMEM培养液,在5%浓度的CO2,37℃恒温培养箱中培养;第二天换成含有1%的N2的DMEM培养液培养,第四天再更换含有5%的马血清,10%胎牛血清的DMEM培养液,5-7天进行做后续处理。
1.2.3质粒的转染实验分为3个组,①对照组转染pEGFP-N1空载体②APP-CTs转染组③突变型APP-CTs转染组
1.2.4Western印迹方法检测ph-cofilin蛋白水平用预冷的PBS清洗细胞,加入RIPA裂解液,在冰上用细胞刮裂解细胞,收集细胞,4℃ 6 000 g rpm 离心5分钟,得出细胞裂解液,蛋白定量,进行聚丙烯酰胺凝胶电泳,电转移至PVDF膜,用封闭液封闭1 h,用活化的ph-cofilin单克隆抗体(1∶1000)4℃孵育过夜, 洗涤液漂洗3次后加二抗辣根氧化酶(HRP)-IgG(1∶1000),室温孵育1 h,洗膜三次后化学发光法显色。用紫外分光光度计扫描条带灰度值,β-actin作为内参照,计算蛋白质表达水平。

2结果
2.1DAPT处理对ph-cofilin蛋白表达的影响为了探究APP-CTFs的产生对Cofilin磷酸化的影响,我们转染APP-695 整长度(FL,Fulllength)cDNA后,处理DAPT。DAPT是γ-内切酶的抑制剂,可以抑制APP-CTFs的产生。实验结果显示加入DAPT处理与非处理组相比较,磷酸化Cofilin的蛋白表达水平下降(P<0.05,图1)
2.2 转染突变型APP-CTFs对ph-cofilin蛋白表达的影响
为了探究APP-CTFs诱导的Cofilin磷酸化过程是否与APP-CTFs的核转移毒性通路有关。我们转染了YENPTY段删除的pEGFP-APPC99、C57转染至大鼠神经元细胞,观察了磷酸化Cofilin的蛋白表达水平。结果转染YENPTY段删除的pEGFP-APP CTFs组未能明显增强磷酸化Cofilin的蛋白表达水平,与空载体对照组相比较无显著性差异(P>0.05,图2)。虽然转染APP-CT99,57-pEGFP组与空载体对照组相比较,Ph-Cofilin蛋白表达水平明显增加。(P<0.05,图2)
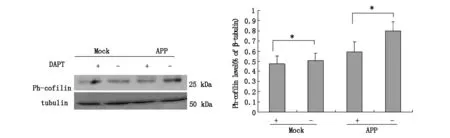
图1DAPT处理对磷酸化-cofilin蛋白表达的影响转染APP-695整长度(FL,Full length)cDNA后,处理DAPT.DAPT是γ-内切酶的抑制剂,可以抑制APP-CTFs的产生.每组实验数据来自3次实验,进行了配对T-检验.

图2转染突变型APP-CTFs(#CT)对磷酸化-cofilin蛋白表达的影响转染YENPTY段删除的pEGFP-APP C99、C57至大鼠胚鼠大脑皮层神经元细胞
2.3 LiCl处理对ph-cofilin蛋白表达的影响
为了探究APP-CTFs诱导的Cofilin磷酸化过程是否与APP-CTFs的GSK-3β-Tau毒性通路有关。我们选择了GSK-3β抑制剂LiCl。转染APP-CTFs基因片段后,处理10mM LiCl,结果LiCl处理组与非处理组相比,Ph-Cofilin蛋白表达无明显改变。(P>0.05,图3)
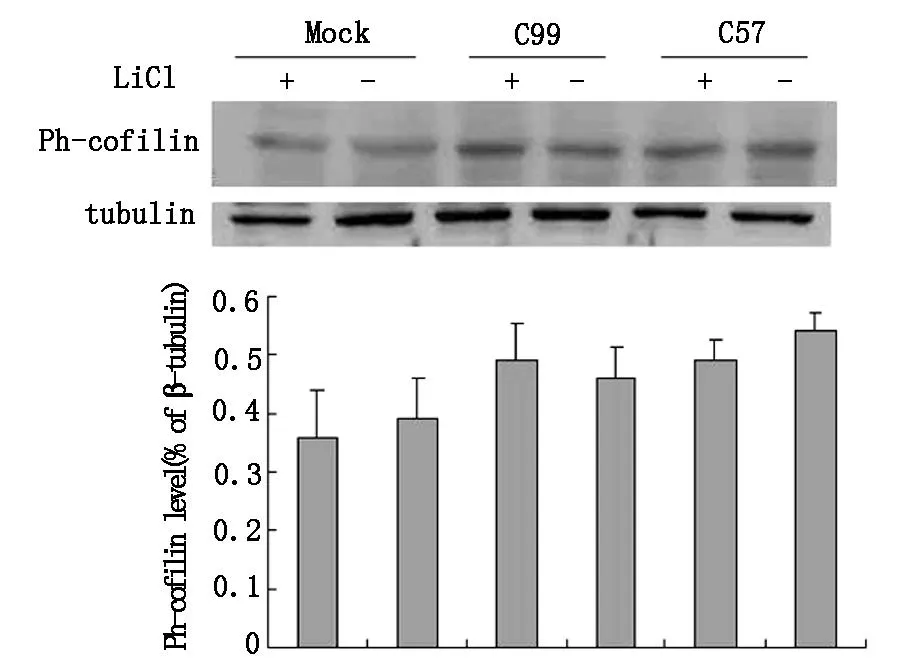
图3LiCl处理对APP-CTFs诱导磷酸化-cofilin蛋白表达的影响大鼠胚鼠大脑皮层神经元细胞转染APP-CTFs之前,预处理10 mM LiCl,LiCl是GSK-3β抑制剂.
3讨论
老年性痴呆(阿尔茨海默病,Alzheimer disease,AD)患者病理典型变化是脑中老年斑(Senileplaque)和细胞内神经元纤维缠结(NFT)。淀粉样前体蛋白(APP)先后经β分泌酶和γ分泌酶的剪切之后,产生了Aβ和不同长度的APP-C端游离片段。最近,APP-CTFs在AD的发病机制里也起重要作用的报道很多[1-3]。淀粉样前体蛋白(Amyloid precursor protein,APP)依次经α-,β-,γ-分泌酶水解后形成不同长度C端片段APP-CTFs,APP-CTFs的毒性机制贡献于AD。其毒性机制是被各种酶切之后形成的AICD与Fe65结合进行核转移,后与CP2/LSF/LBP1转录因子结合刺激GSK-3β基因,增强Tau磷酸化[2-5]
Cofilin是ADF蛋白家族成员,老年性痴呆与cofilin家族表达变化有关[10-12,18]。最近研究表明,异常的cofilin沉积可引起Tau神经毡螺纹(neuropil threads),所以提示cofilin-肌动蛋白束在AD病理机制中可能引起重要作用。但cofilin-肌动蛋白节状结构形成的具体机制还未阐明[10-12]。Aβ诱导的退行性变化,通过LIM-激酶对ADF/cofilin-脱磷酸化来实行,阐明老年性痴呆神经营养不良的潜在性机制[13]。
我们在先前的研究中已发现APP-CTF转染可以使磷酸化-cofilin水平增高。此次我们想阻断APP-CTFs毒性通路对Cofilin磷酸化的影响。采取三种方法阻断APP-CTFs毒性通路。首先,转染APP-695 整长度(FL,Full length)cDNA 后,γ-内切酶的抑制剂DAPT处理后观察了对ph-cofilin蛋白表达的影响。结果DAPT处理与非处理组相比较,磷酸化Cofilin的蛋白表达水平下降(P<0.05,图1),说明APP-CTFs的产生对Cofilin磷酸化过程是重要的环节。
其次,为了探究APP-CTFs诱导的Cofilin磷酸化过程是否与APP-CTFs的核转移毒性通路有关。转染YENPTY段删除的pEGFP-APP CTFs组未能明显增强磷酸化Cofilin的蛋白表达水平(P>0.05,图2),虽然转染APP-CT99,57-pEGFP组与空载体对照组相比较,Ph-Cofilin蛋白表达水平明显增加(P<0.05,图2)。提示APP-CTFs诱导的Cofilin磷酸化过程与APP-CTFs的核转移毒性通路有关。最近研究表明Cofilin蛋白有核进入和输出信号,况且这些信号作用于在应激压力状态下可以形成适当的rod 结构[15]。其它的HD(Huntington disease,亨廷顿病性痴呆)疾病这些cofilin-肌动蛋白节状(actin rod)结构被假设成有潜在的生理作用和假如被调控为结构紊乱时可以增加患神经变性性疾病的罹患率[16]。APP-CTFs和Cofilin核转移和相互作用的进一步分子生物学机制有待于进一步研究。
最后,为了探究APP-CTFs诱导的Cofilin磷酸化过程是否与APP-CTFs的GSK-3β-Tau毒性通路有关。我们选择了GSK-3β抑制剂LiCl。结果LiCl处理组与非处理组相比,Ph-Cofilin蛋白表达无明显改变。(P>0.05,图3)提示APP-CTFs诱导的Cofilin磷酸化过程与APP-CTFs诱导的GSK-3β-Tau毒性通路无关。也有报道cofilin-肌动蛋白节状(actin rod)结构的蓄积可以延伸tau病理变化[17],况且这些变化与患者的年龄是无关的。APP-CTFs诱导的Cofilin磷酸化过程与Tau毒性通路之间的详细的分子生物学机制也有待于再研究。
本研究在分子机制水平上更深层次地探讨APP-CTFs对cofilin基因表达的影响,可为AD的发病机制提示一个新的不同的毒性通路,其具体更深的分子生物学机制有待于进一步研究探讨。
参考文献:
[1]高文明.淀粉样前体蛋白研究进展[J].济宁医学院学报.2010,33(2):137.
[2]Cao X,Sudhof TC.A transcriptionally active complex of APP with Fe65 and histone acetyltransferase Tip60[J].Science,2001,293 (5527) :115.
[3]Kimberly WT,Zheng JB,Guenette SY,et al.The intracellular domain of the beta-amyloid precursor protein is stabilized by Fe65 and translocates to the nucleus in a notch-like manner[J].J Biol Chem,2001,276(43) :40288.
[4]Minopoli G,de Candia P,Bonetti A,et al.The beta-amyloid precursor protein functions as a cytosolic anchoring site that prevents Fe65 nuclear translocation[J].J Biol Chem,2001,276(9):6545.
[5]Kim HS,Kim JP,Lee CH,et al.C-terminal fragments of amyloid precursor protein exert neurotoxicity by inducing glycogen synthase kinase-3beta expression[J].FASEB J,2003,17:1951-1953.
[6]Bamburg JR,Bernstein BW.Roles of ADF/cofilin in actin polymerization and beyond[J].F1000 Biol Rep,2010,2:62.
[7]Bamburg JR,Bloom GS.Cytoskeletal pathologies of Alzheimer Disease[J].Cell Motil Cytoskeleton,2009,6(8):635.
[8]Davis RC,Marsden IT,Maloney MT,et al.Amyloid beta dimers/trimers potently induce cofilin-actin rods that are inhibited by maintaining cofilin-phosphorylation[J].Mol Neurodegener,2011,6(1):10.
[9]郭林林 李学宝.肌动蛋白解聚因子/丝切蛋白:肌动蛋白重塑蛋白质家系[J].生命的化学,2005,25(3):216.
[10]Yao J,Hennessey T,Flynt A,et al.MicroRNA-related cofilin abnormality in Alzheimer's disease[J].PLoS One,2010,5(12):e15546.
[11]Whiteman IT,Gervasio OL,Cullen KM,et al.Activated actin-depolymerizing factor/cofilin sequesters phosphorylated microtubule-associated protein during the assembly of alzheimer-like neuritic cytoskeletal striations[J].J Neurosci,2009,29(41):12994.
[12]Bamburg JR,Bernstein BW,Davis RC,et al.ADF/Cofilin-actin rods in neurodegenerative diseases[J].Curr Alzheimer Res,2010,7(3):241.Review.
[13]Heredia L,Helguera P,de Olmos S,et al.Phosphorylation of actin-depolymerizing factor/cofilin by LIM-kinase mediates amyloid beta-induced degeneration:a potential mechanism of neuronal dystrophy in Alzheimer's disease[J].J Neurosci,2006,26(24):6533.
[14]Beta-secretase-cleaved amyloid precursor protein accumulates at actin inclusions induced in neurons by stress or amyloid beta:a feedforward mechanism for Alzheimer's disease[J].Maloney MT,Minamide LS,Kinley AW,et al.J Neurosci,2005,25(49):11313.Erratum in:J Neurosci,2006,26(1):354.
[15]Lise Nicole Munsie,Carly R.Desmond and Ray Truant.Cofilin nuclear-cytoplasmic shuttling affects cofilin-actin rod formation during stress[J].Journal of Cell Science,2012,125 (17):3977.
[16]Munsie LN1,Truant R.The role of the cofilin-actin rod stress response in neurodegenerative diseases uncovers potential new drug targets[J].Bioarchitecture,2012,2(6):204.doi:10.4161/bioa.22549.
[17]Rahman T,Davies DS,Tannenberg RK,et al.Cofilin Rods and Aggregates Concur with Tau Pathology and the Development of Alzheimer's Disease[J].J Alzheimers Dis,2014,11:235.
[18]田磊,廖明芳,李冀洲,等.细胞骨架蛋白中ADF/cofilin蛋白家系的作用:如何与肌动蛋白结合及发挥解聚作用[J]?中国组织工程研究与临床康复,2009,13(50):9941.
关键词:APP- C端片段;Cofilin;DPAT,YENPTY,LICl
Effect of blocking toxicity pathways of C-terminal Fragment of Amyloid Precursor Protein on ADF/Cofilin in rat primary neuronal culture cellsCHENHui,XUYan-ji.(DepartmentofPreventiveMedicine,MedicalCollegeYanbianUniversity,Yanji,Jilin133000,China)
Abstract:ObjectiveIn this study,we aim to eluciate the effects of blocking toxicity pathways of APP-CTFs on cofilin phosphorylationMethodsrat primary neuronal cells were cultured and choosed three different blocking toxicity pathways of APP-CTFs.①transfected with APP-695 Full length cDNA,and treated with an inhibitor of γ-secretase,DAPT②transfected with deletion of YENPTY domain of APP-CTFs.③treated with an inhibitor of GSK-3β,LiCl.ResultsAs an inhibitor of γ-secretase,DAPT treatment decreased the phospho-cofilin (Ph-cofilin) protein levels in the transfected group with a full length of APP-695.When transfected with the deletion of the YENPTY domain of mutated APP-CTFs,Ph-cofilin did not have any significant increase.As an inhibitor of GSK-3β,LiCl treatment did not block the APP-CTFs that induced cofilin phosphorylation.ConclusionIndicating that this may be related to the translocation of the nucleus pathway; but not mediated by the GSK-3β pathway.
Key words:APP;cofilin; C-terminal Fragment; DPAT;YENPTY;LICl
(收稿日期:2015-03-15)
作者简介:许妍姬(1973-),女,朝鲜族,博士,副教授,主要从事神经毒理学研究。
文献标识码:A
中图分类号:TQ93
文章编号:1007-4287(2015)07-1045-05
*通讯作者
基金项目:国家自然科学基金(81160159)
