偏头痛患者血浆中过氧化物酶体增殖物激活受体水平的研究
2015-02-24张贺敏刘苏丽陈晓虹
张贺敏, 何 秋*,林 湘,刘苏丽,陈晓虹
(1.辽宁省人民医院 神经内四科,辽宁 沈阳 110016; 2.大连医科大学; 3 驻马店市中心医院)
偏头痛患者血浆中过氧化物酶体增殖物激活受体水平的研究
张贺敏1, 何秋1*,林湘2,刘苏丽3,陈晓虹1
(1.辽宁省人民医院 神经内四科,辽宁 沈阳 110016; 2.大连医科大学; 3 驻马店市中心医院)
(ChinJLabDiagn,2015,19:0382)
关于偏头痛发病机制的研究目前仍然是神经科的一个热点问题,其中脑干-三叉神经-血管炎性学说作为主要发病机制越来越受到关注,而脑和脑膜的炎症反应是偏头痛的主要病理生理机制[1,2]。过氧化物酶体增殖物激活受体家族(peroxisome proliferator-activated receptors,PPARs)由Issemann等于1990年首次发现,是配体激活的转录因子,均属于核激素受体超家族[3],PPARs与卒中、阿尔茨海默病、多发性硬化等中枢神经系统疾病的关系已有研究[4-6]。我们前期的基础研究发现实验性大鼠偏头痛模型中三叉神经颈复合体处过氧化物酶体增殖物激活受体PPARα、PPARβ/δ、PPARγ均呈强阳性表达[7],临床研究显示偏头痛发作期血浆PPARγ水平下调[8],提示PPARs可能参与偏头痛的发病过程。本研究检测偏头痛患者不同时期血浆中PPARs水平的变化,进一步推测PPARs与偏头痛发作之间的关系,为偏头痛的防治提供理论基础。
1对象与方法
1.1研究对象
入选病例:在辽宁省人民医院神经内科及神经外科门诊、住院的偏头痛患者227例。 其中发作期98例,发作间期129例;有先兆偏头痛患者62例, 无先兆偏头痛患者165例。诊断标准:符合2011版《中国偏头痛诊断治疗指南》的患者入选为偏头痛患者,研究期间患者可进行发作期止痛治疗,但均不可予预防期治疗。患者志愿参加,在知情同意书上签字。
排除标准:(1)年龄<15岁或>65岁;(2)体质量指数(BMI)<18 kg/m2或>30 kg/m2;(3)有脑动脉瘤、颅内感染、脑梗死、脑出血、蛛网膜下腔出血、脑血管畸形、脑肿瘤等神经系统疾病者(经TCD、头CT 或头MRI、头MRA等检查证实);(4)血常规、红细胞沉降率(ESR)、抗“O”(ASO)、RF(类风湿因子)、心电图等检查异常;(5)同时合并高血压病、糖尿病、高脂血症、动脉粥样硬化等疾病者;(6)患有炎症及风湿性关节炎、桥本氏甲状腺炎、系统性红斑狼疮、炎症性肠病等全身性风湿免疫性疾病者;(7)口服避孕药、怀孕或哺乳期;(8)吸烟。
连续入选同期健康体检者100例为健康对照组。对照组年龄、性别、民族、地域等与病例组相匹配而无血缘关系,并且无偏头痛病史及家族史者。
1.2病人分组
A组:发作期患者(n=98);其中A1组—无先兆的发作期患者(n=71),A2组—有先兆的发作期患者(n=27)。
B组:发作间期患者(n=129);其中B1组—无先兆的发作间期患者(n=94),B2组—有先兆的发作间期患者(n=35)。
C组为健康对照组(n=100)。
1.3研究方法
标本收集与处理:入院24 h内抽取清晨空腹外周肘静脉血2 ml,收集至EDTA抗凝管中。患者血浆中PPARα、β/δ、γ的水平检测采用酶联免疫法(ELISA)。临床数据收集:详细收录一般临床信息资料(包括性别,年龄、BMI、血压、血脂等)。
检测方法:所取标本进行3 000 r/min离心10 min后吸取上层清液,分装置于EP管中,操作步骤严格按照说明书的实验方法进行。PPARα、β/δ、γ试剂盒由北京鼎国生物技术有限责任公司提供。
1.4统计学处理
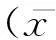
2结果
2.1一般资料比较A组、B组、C组各组之间患者的一般资料比较,各方面差异均无统计学意义(P>0.05)(表1)。
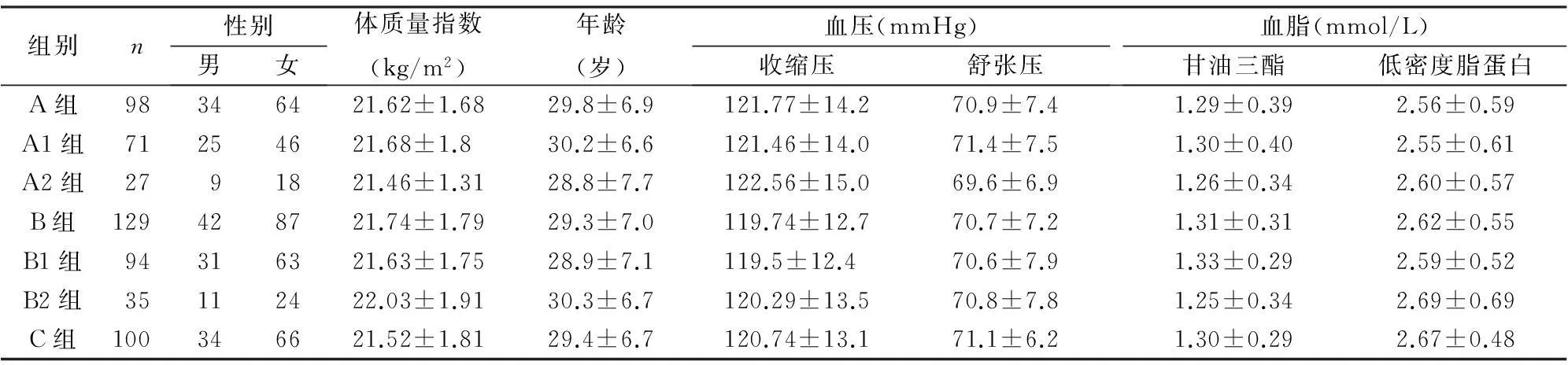
表1 偏头痛患者各组一般情况比较
注:A:发作期;A1:无先兆发作期;A2:有先兆发作期;B:发作间期;B1:无先兆发作间期;B2:有先兆发作间期。C:对照组;各组之间年龄、性别、BMI、血压、血脂(低密度脂蛋白、甘油三酯)等方面无统计学差异(P>0.05)。
2.2血浆PPARα、β/δ、γ水平比较A组患者血浆PPARα、β/δ水平高于B组及C组者(P<0.05),PPARγ水平低于B组及C组患者(P<0.05);亚组分析发现有无先兆偏头痛患者发作期血浆PPARs 水平与发作间期相比均有显著差异(P<0.05)。有先兆偏头痛患者发作期、发作间期血清PPARα、β/δ、γ水平与无先兆偏头痛患者相比无显著性差异(P>0.05)。B组患者血浆PPARα、β/δ、γ 水平与C组相比无显著性差异(P>0.05)(表2)。
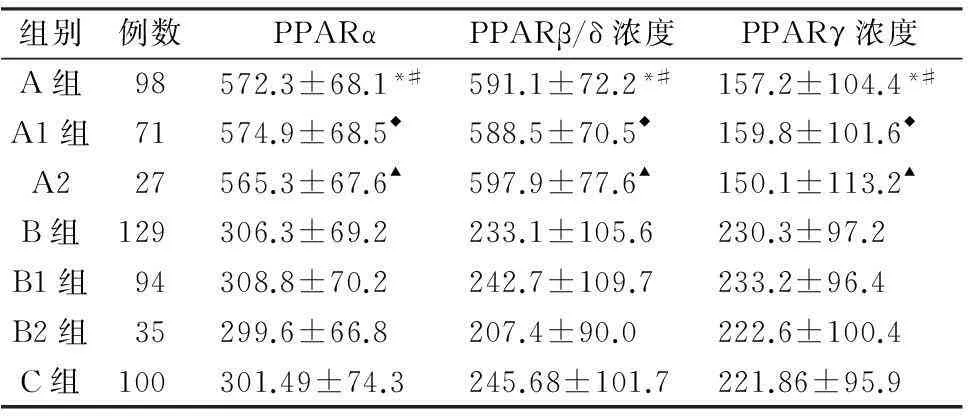
组别例数PPARαPPARβ/δ浓度PPARγ浓度A组98572.3±68.1*#591.1±72.2*#157.2±104.4*#A1组71574.9±68.5◆588.5±70.5◆159.8±101.6◆A227565.3±67.6▲597.9±77.6▲150.1±113.2▲B组129306.3±69.2233.1±105.6230.3±97.2B1组94308.8±70.2242.7±109.7233.2±96.4B2组35299.6±66.8207.4±90.0222.6±100.4C组100301.49±74.3245.68±101.7221.86±95.9
*A组与B组相比有统计学差异(P<0.05),#A组与C组相比较有统计学差异(P<0.01)。◆A1与B1组相比较有统计学差异(P<0.05);▲A2组与B2组相比有统计学差异(P<0.05)。
3讨论
偏头痛是一种神经系统功能性疾患,其机制至今尚未完全阐明。被公认为偏头痛发病机制主流学说的脑干-三叉神经-血管炎性学说认为神经源性炎症的产生使三叉神经的刺激逆行或顺行传导传至大脑皮层引起疼痛[9]。近年来研究发现,核转录因子-κB(nucleartranscription factor-κB,NF-κB)、IL家族(IL-6、IL-1、IL-10)、TNF-α及TNF-β等因子在偏头痛的发生发展中发挥着作用[10]。我们前期的研究发现,5-HT、NF-κB及细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)等通过不同途径参与了偏头痛的发病过程[11,12],同时在动物实验中就PPARs与偏头痛的关系进行了探讨[7];前期临床试验中发现过氧化物酶体增殖物激活受体亚型γ可能也影响偏头痛的发生。
PPARs是一种配体激活型转录调控因子核受体超家族成员,目前己知的PPARs有3种亚型:PPARα、PPARβ/δ、PPARγ,它们的功能各不相同。PPARα可调控炎症、细胞增殖和分化、氧化应激反应等非代谢过程的表达[13-15]。 PPARβ/δ在血管炎症、肿瘤、内质网应激所致炎症及胰岛素抵抗等的发生过程中发挥着重要的作用[16-18]。PPARγ参与中枢神经系统的急慢性损伤及炎症反应,在糖脂代谢、脑缺血及中枢神经系统免疫性疾病中均具有保护作用。
本研究检测偏头痛患者血浆中PPARs(PPARα、β/δ、PPARγ)的水平,并分别对不同时期的PPARs水平进行了比较。我们前期的基础研究发现硝酸甘油实验性大鼠偏头痛模型中三叉神经颈复合体处过氧化物酶体增殖物激活受体PPARα、PPARβ/δ、PPARγ均呈强阳性表达[7]。分析结果无论动物实验还是临床研究中PPARα、PPARβ/δ在血浆均增加。PPARγ水平仍降低,与我们前期临床试验结果相符[8],表明增加样本量后结果仍有意义,结果稳定,可信性高;而PPARγ在大鼠三叉神经颈复合体处表达增强却在人血浆中水平下降,分析结果可能与物种不同、组织分布不同或实验方法等不同有关,将在未来的实验研究中做进一步探讨。
本研究结果提示PPARs的水平与偏头痛的发作密切相关而PPAR不同亚型间存在差异。分析结果考虑PPARs对偏头痛的发生产生不同的作用。偏头痛发作期血清PPARα水平升高,PPARα激活后,通过抑制P38丝裂原活化蛋白激酶和核因子-κB活化而发挥抗炎的作用[19];PPARβ/δ可能通过抑制ERK1/2磷酸化途径,阻断LPS诱导的NF-κB激活,并达到控制炎症因子的表达及炎症反应的目的[20]。而偏头痛发作时的血浆PPARγ水平降低,考虑对偏头痛的发生发作起到了促进作用。
本研究结果发现无先兆的偏头痛患者与有先兆的偏头痛患者血浆PPARs水平的比较均无显著性统计学差异(无论在发作期,亦或是发作间期),结果提示偏头痛患者是否发生先兆与血浆中的PPARs水平高低可能无关。偏头痛先兆的发生可能是由于偏头痛患者脑内神经元的兴奋性较枕叶皮层的神经元兴奋高,容易发生皮层扩散性抑制,最终出现先兆症状[21]。
本研究结果进一步说明PPARs参与偏头痛的发作主要是由于其参与了炎性反应,而非神经元的兴奋,故有先兆组与无先兆组相比PPARs水平无显著性差异。
总之,本研究结果表明PPARs 参与偏头痛的发病过程,结合前期研究结果考虑发作期血清PPARα、β/δ水平升高可能是偏头痛的保护机制之一,而PPARγ对偏头痛的发作起到了促进作用。本研究的结论将为完善偏头痛的发病机制研究提供新的思路,为防治偏头痛的药物研发提供理论依据。展望未来可在基础研究及临床研究中进一步将作用于PPARs受体的药物引入偏头痛的治疗中,为偏头痛的治疗打开了新的通道。
参考文献:
[1]Edvinsson L,Villalon CM,Maassen Van Den Brink A.Basic mechanisms omigraine and its acute treatment[J].Pharmacol Ther,2012,136(3):319.
[2]Cutrer FM.Pathophysiology of migraine[J].Semin Neurol,2010,30(2):120.
[3]Issemann I,Green S.Activation of a member of the steroid hormone receptor super family by peroxisome proliferators [ J ].Nature,1990,347:645.
[4]Liu J,Wang LN.Peroxisome proliferator-activated receptor gamma agonists for preventing recurrent stroke and other vascular events in patients with stroke or transient ischaemic attack[J].Cochrane Database Syst Rev,2014,1:CD010693.
[5]Jahrling JB,Hernandez CM,Denner L,et al.PPARγ recruitment to active ERK during memory consolidation is required for Alzheimer's disease-related cognitive enhancement[J].J Neurosci,2014,34(11):4054.
[6]Szalardy L,Zadori D,Tanczos E,et al.Elevated levels of PPAR-gamma in the cerebrospinal fluid of patients with multiple sclerosis[J].Neurosci Lett,2013,554:131.
[7]陈薇,肖明明,任占秀,等.过氧化物酶体增殖物激活受体在偏头痛大鼠模型中的表达[J].中华神经医学杂志,2014(4):371.
[8]丁文才,李付勇,任占秀,等.偏头痛患者血清中过氧化物酶体增殖物激活受体γ水平研究[J/CD].中华临床医师杂志,2013,7(22):9857.
[9]Andreou AP,Shields KG,Goadsby PJ.GABA and valproate modulate trigemin-vascular nociceptive transmission in the thalamus[J].Neurobiol Dis,2010,37(2):314.
[10]Bokowski L,Smigielska-Kuzia J,Sobaniec W,et al.Anti-inflammatory plasma cytokines in children and adolescents with migraine headaches[J].Pharmacol Rep,2010,62:287.
[11]何秋,王怀良,章新华,等.5-H T受体激动剂对偏头痛大鼠脑膜神经源炎症的影响[J].中风与神经疾病杂志,2007,24(5):520.
[12]何秋,王怀良,章新华,等.大鼠静脉注射硝酸甘油后脑膜ICAM-1表达的研究[J].中国医科大学学报,2004,33:99.
[13]Patel NS,di Paola R,Mazzon E,et al.Peroxisome Proliferator-activated receptor alPha contributes to the resolution of inflammtion after renal Ischemia /reperfusion injury[J].J Pharmacol ExP Ther,2009,328(2):634.
[14]Pozzi A,Ibanez MR,Gatica AE,et al.Peroxisome Proliferator-activated receptor-alPha-dependent inhibition of endothelial cell Proliferation and tumorigenesis[J].J Biol Chem,2007,282(24):17685.
[15]Kronke G;Kadl A,Ikonomu E,et al.Expression of heme oxygenase-1 in human vascular cells is regulated by Peroxisome Proliferator-aetivated receptors[J].Arterioscler Thromb Vasc Biol,2007,27(6):1276.
[16]J Xu,Y Zhang,Y Xiao,et al.Inhibition of 12/15-lipoxygenase by baicalein induces microglia PPARβ/δ:a potential therapeutic role for CNS autoimmune disease[J].Cell Death Dis,2013,4(4):e569.
[17]Josefine S,Alexander W,Kerstin Kaddatz,et al.Regulation of TAK1/TAB1-Med-iated IL-1β Signaling by Cytoplasmic PPARβ/δ[J].PLoS One,2013,8(4):e630.
[18]Salvadó L,Barroso E,Gómez-Foix AM,et al.PPARβ/δ prevents endoplasmic reticulum stress-associated inflammation and insulin resistance in skeletal muscle cells through an AMPK-dependent mechanism[J].Diabetologia,2014,57(10):2126.
[19]Michalik L,Wahli W.PPARs Mediate Lipid Signaling in Inflammation and Cancer[J].PPAR Res,2008,134059.
[20]Di Paola R,Esposito E,Mazzon E,et al.GW0742,a selective PPAR-beta/delta a-gonist,contributes to the resolution of inflammation after gut ischemia/reperfusion injury[J].J Leukoc Bio,2010,88(2):291.
[21]Dahlem MA,Chronicle EP.A comptational perspective on migraine aura[J].Prog Neurobiol,2004,74(6):351.
摘要:目的观察不同时期、不同亚型偏头痛患者血浆中过氧化物酶体增殖物激活受体(PPARs)的变化,探讨偏头痛的发病机制。方法将227例偏头痛患者分成偏头痛发作期组(A组,n=98)和发作间期组(B组,n=129);同时根据患者先兆症状的不同又分为四个亚组,即A1组-无先兆的偏头痛发作期患者(n=71),A2组-有先兆的偏头痛发作期患者(n=27);B1组-无先兆的偏头痛发作间期患者(n=94),B2组-有先兆的偏头痛发作间期患者(n=35);以年龄、性别相匹配的100例健康者作为对照组。搜集患者的临床资料(性别、年龄、BMI、血压、血脂),并采用酶联免疫法(ELISA)检测受试者血浆PPARs水平,采用SPSS系统软件进行统计分析。结果偏头痛发作期患者血浆中PPARα、PPARβ/δ水平明显高于发作间期及健康对照者的水平(572.3±68.1 VS 306.3±69.2 VS 301.49±74.3、591.1±72.2 VS 233.1±105.6 VS 245.68±101.7,P<0.05 ),而PPARγ水平发作期组低于发作间期组及健康对照组(157.2±104.4 VS 230.3±97.2 VS 221.86±95.9,P<0.05) ;有先兆和无先兆偏头痛发作期PPARα、PPARβ/δ、PPARγ水平与发作间期比较均有明显差异( 574.9±68.5 VS 308.8±70.2,588.5±70.5 VS 242.7±109.7,159.8±101.6 VS 233.2±96.4,P<0.05)。PPARs水平在发作间期患者组与健康对照者组之间比较无统计学显著性差异(P>0.05);无论是偏头痛发作期或发作间期,有先兆与无先兆患者血浆PPARs水平组内比较均无明显差异(P>0.05)。 结论PPARs参与偏头痛发作的病理生理过程,与有无偏头痛先兆发生无关。
关键词:偏头痛; 过氧化物酶体增殖物激活受体; 发病机制; 炎症
Changes of serum PPARs levels in migraine patientsZHANGHe-min,HEQiu,LINXiang,etal.(DepartmentofNeurology,LiaoningProvinceHospital,Shenyang110016,China)
Abstract:ObjectiveTo observe the clinical features of patients with migraine , and analyze the plasma level of PPARs(peroxisome proliferator-activated receptors) during different periods and different subtypes in migraine patients.To explore the relationship between PPARs and migraine attacks.Methods227 patients with migraine were divided into two main groups:attack period group (n=98) and attack free period group (n=129).According to the patients with or without aura symptoms patients were further divided into four subgroups.100 cases of healthy were taken as control group.Collect the clinical data of patients(Gender,age,BMI,blood pressure,blood lipid.The serum levels of PPARs were measured using enzyme-linked immunoassay (ELISA).Using SPSS software for statistical analysis.ResultsNo significant difference about age,BMI,blood pressure,blood lipid level among migraine during headache attack period、headache free period and the control group..The PPARα、PPARβ/δ levels in patients with migraine during headache attack period were significantly higher than headache free period and healthy control group.The PPARγlevels in patients with migraine during headache attack period were significantly lower than those during headache free period and healthy control group.The PPAR α、β/δ、γlevels in patients with migraine during headache attack period have significant differences compared with those during headache free period no matter with or without aura.The PPARs levels in headache free period have no significant difference to healthy control group (P>0.05).The level of PPARs in plasma of migraine was no significant difference between migraine with aura group and without aura group,regardless of whether during headache attack period or headache free period(P>0.05).ConclusionPPARα、β/δ,and PPARγ involved in the pathogenesis of migraine.With or without aura had no obvious effect to PPARs level.
Key words:Migraine;Peroxisome proliferator-activated receptors(PPARs);Pathogenesis;Inflammation
收稿日期:(2013-10-13)
文献标识码:A
中图分类号:R747.2
文章编号:1007-4287(2015)03-0382-04
通讯作者*
