急性视神经炎血清CXCL12、血小板源性生长因子及CXCL14水平与疾病转归
2015-02-24刘子豪姜兆财魏世辉陈霆隽
刘子豪 姜兆财 魏世辉 陈霆隽
·神经眼科专题·
急性视神经炎血清CXCL12、血小板源性生长因子及CXCL14水平与疾病转归
刘子豪*姜兆财**魏世辉 陈霆隽
目的 对视神经炎(ON)及相关脱髓鞘疾病进行血清趋化因子12(CXCL12)、血小板源性生长因子(PDGF)、趋化因子14(CXCL14)浓度检测,分析不同疾病类型及时期各项因子的变化规律。方法 采集就诊ON及相关脱髓鞘疾病患者的静脉血,并根据疾病种类及病程进行分组。用酶联免疫吸附试验(ELISA)对血液样本中CXCL12、PDGF及CXCL14的浓度进行定量检测。结果 ①血清CXCL12检测结果:健康对照组(HC)的浓度为(0.207±0.150)ng/mL;急性期视神经炎(AON)组的浓度为(0.136±0.076)ng/mL;缓解期视神经炎(CON)组的浓度为(0.431±0.276)ng/mL;急性期视神经脊髓炎谱系疾病(ANMOSDs)组的浓度为(0.281±0.257)ng/mL;缓解期视神经脊髓炎谱系疾病(CNMOSDs)组的浓度为(0.270±0.132)ng/mL;视神经脊髓炎(NMO)组的浓度为(0.498±0.221)ng/mL;多发性硬化(MS)组的浓度为(0.439±0.174)ng/mL。②血清PDGF检测结果:HC组的浓度为(40.944±14.677)pg/mL;AON组的浓度为(25.771±5.094)pg/mL;CON组的浓度为(34.359±4.567)pg/mL;ANMOSDs组的浓度为(32.589±8.957)pg/mL;CNMOSDs组的浓度为(38.805±10.449)pg/mL;NMO组的浓度为(48.982±12.985)pg/mL;MS组的浓度为(50.498±6.322)pg/mL。③血清CXCL14检测结果:HC组的浓度为(2.149±1.783)ng/mL;AON组的浓度为(1.312±1.127)ng/mL;CON组的浓度为(4.740±2.281)ng/mL;ANMOSDs组的浓度为(2.111±1.351)ng/mL;CNMOSDs组的浓度为(2.127±1.739)ng/mL;NMO组的浓度为(7.096±5.198)ng/mL;MS组的浓度为(2.409±1.009)ng/mL。结论 ①在ON的急性期,CXCL12、PDGF、CXCL14的血清浓度降低,而随着疾病的恢复,各因子浓度升高,可能略高于正常人水平。②在NMOSDs的急性期和缓解期,CXCL12和CXCL14血清浓度差异无统计学意义,与正常血清浓度差异也无统计学意义。PDGF血清浓度在急性期降低,缓解期升高,但始终低于正常人水平。③急性期的NMO和MS,CXCL12浓度均高于正常人水平。非急性期的NMO患者,CXCL14浓度高于正常人。④NMOSDs和NMO在疾病预后或神经修复机制上可能差异较大,因而导致血清CXCL12、PDGF和CXCL14浓度之间的显著差异。 (中国眼耳鼻喉科杂志,2015,15:155-162)
视神经炎;脱髓鞘疾病;趋化因子12;血小板源性生长因子;趋化因子14
视神经炎(optic neuritis,ON)是临床孤立综合征(clinically isolated syndrome, CIS)的一种类型。在临床上,CIS患者可进展为多发性硬化(multiple sclerosis, MS)或视神经脊髓炎(neuromyelitis optica, NMO)等中枢神经系统(central nervous system, CNS)脱髓鞘疾病。在脱髓鞘疾病中,CNS不但存在髓鞘的脱失,还存在轴索的损伤。就MS和NMO而言,NMO的病理学损伤在轴索上更为明显,特别是水通道蛋白4(aquaporins 4, AQP4)密集区域[1]。在疾病早期,特别是ON初次发作的时候,AQP4-Ab、脑脊液寡克隆区带(cerebrospinal fluid-restricted oligoclonal bands, CSF-OCB)等免疫指标为疾病进展提供了很好的参考标准。但是由于随访时间、个体差异等因素,在ON首次发作后,疾病的预后和转归尚无较为合适的生物学指标作为参照。
从20世纪末至今,有关MS和NMO生物学标记的研究为2种疾病的临床诊断、鉴别及治疗提供了重要支持;然而作为这2种CNS脱髓鞘疾病的一部分,在临床上首次发作的ON,其疾病走势仍是临床及科研工作中的一大难题。目前NMO的重要诊断指标AQP4-Ab往往在患者还处在ON阶段时无法检出,但是其他一些因子,尤其是与神经髓鞘再生相关的细胞因子,在近年来的研究中越来越受到重视。这些因子包括血小板源性生长因子(platelet-derived growth factor, PDGF)、趋化因子12(chemokine 12, CXCL12) 和CXCL14。
CNS脱髓鞘疾病是一种免疫介导的中枢神经系统疾病,越来越多的免疫指标正在研究。在免疫系统中,趋化因子对调节髓系细胞、淋巴细胞及前体细胞在中枢和外周之间的运输和定位起到决定性作用[2-3]。在炎性反应中,趋化因子对白细胞的归巢和募集有决定性作用,因而直接诱发炎性反应,包括CNS的自身免疫性疾病。有研究发现,CXCL12在CNS炎性疾病中升高[4],特别是在MS患者的CSF中[5]。在CNS炎性疾病中,CXCL12主要是由星形胶质细胞和血管内皮细胞分泌[6],这为从血清中研究CXCL12与炎性脱髓鞘疾病提供了依据。PDGF对调节CNS功能有重要作用。在MS患者CSF中,PDGF浓度升高代表治疗有效[7]。与CXCL12类似,PDGF也可由血管细胞分泌,如内皮细胞、平滑肌细胞、外皮细胞、成纤维细胞[8-10]。CXCL14可与CXCL12的受体趋化因子受体4(chemokine receptor 4, CXCR4)特异性结合,抑制CXCL12的作用[11],但在CNS炎性疾病中的作用尚需更多研究。
本研究选取血清CXCL12、PDGF和CXCL14作为指标进行酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)定量检测,对不同情况CNS脱髓鞘疾病进行分析,以期对不同类型脱髓鞘疾病乃至不同疾病时期给予指示作用。
1 资料与方法
1.1 资料
1.1.1 ON血液来源 在解放军总医院眼科门诊和病房,根据ON治疗研究小组(ONTT)制订的诊断标准诊断为ON的患者,排除既往有MS、NMO、视神经脊髓炎谱系疾病(neuromyelitis optica spectrum diseases,NMOSDs)及感染等其他原因造成的视神经病变者。对急性期ON且病程≤2周者进行血液采集;对缓解期患者,病程>3个月,最佳矫正视力(BCVA)恢复至 1.0 且视野大致正常者进行血液采集,并将血液分为急性期ON(acute ON, AON)组与缓解期ON(catabatic ON, CON)组。
1.1.2 NMOSDs血液来源 明确NMOSDs当前的范围[12]:NMO、特发的单次或复发的长节段脊髓炎(长度>3个脊髓节段)、复发的或双眼同时发病的ON、亚洲的视神经脊髓型MS、与系统性自身免疫性疾病相关的ON或长节段脊髓炎、ON或脊髓炎且在颅内有NMO特征性病灶的一类疾病。在资料收集过程中,由于眼科病源限制,主要收集与ON关系较为密切的患者血液;并根据病程分为急性期NMOSDs(acute NMOSDs, ANMOSDs)组和缓解期NMOSDs(catabatic NMOSDs,CNMOSDs)组。
1.1.3 NMO和MS血液来源 在解放军总医院眼科门诊和病房,根据2010年McDonald诊断标准确诊为MS的患者和2006年Wingerchuk对NMO的诊断标准确诊为NMO的患者,对其进行血液采集并分为NMO组和MS组。
1.1.4 健康对照组血液来源 收集近期健康人且血液检查结果不合并炎症性疾病及病毒感染(如乙型肝炎病毒、人类免疫缺陷病毒等)的血液,分类为健康对照(health control, HC)组。
1.2 血液收集及保存 静脉血均用含惰性分离胶的采血管进行采集。血液采集完毕静置1~2 h后进行离心(3 000 r/min, 10 min)。将离心后采血管里的血清取出并分装至Eppendorf管中,每管200 μg。分装完毕并标记后立即置-80 ℃冰箱保存,直到使用前取出。
1.3 试剂盒制备
1.3.1 材料 96孔板(Sigma-Aldrich公司,美国);CXCL12、PDGF、CXCL14捕获抗体(R&D公司,美国);磷酸盐缓冲液(phosphate-buffered saline, PBS)(上海生工生物工程有限公司);磷酸盐吐温缓冲液(PBS/0.05% Tween-20, PBST)(Sigma-Aldrich公司,美国);牛血清蛋白(bovine serum albumin, BSA)(Sigma-Aldrich公司,美国);CXCL12、PDGF、CXCL14标准品(Peprotech公司,美国);生物素标记抗CXCL12、PDGF、CXCL14抗体(Santa cruz公司,美国);链霉亲和素辣根过氧化物酶(美国Santa cruz公司);洗涤液(上海碧云天生物技术有限公司);显色剂(北京中杉金桥生物技术有限公司);终止液(北京康为世纪生物科技有限公司)。
1.3.2 制备过程(CXCL12、PDGF、CXCL14) ①包被:用PBS稀释捕获抗体至2 μg/mL,分别加至96孔板各孔中,每孔加液量100 μL。将96孔板置4 ℃冰箱24 h。②洗涤:倾去包被液,用PBST加满每孔,静置 5 min,倾去洗液,重新加满,重复洗涤5次,最后拍干96孔板。③封闭:每孔加1%BSA 200 μL,置 37 ℃恒温箱温育2 h。④洗涤:方法同②。
1.4 ELISA检测所需设备及试剂 4 ℃冰箱、37 ℃恒温箱、酶标分析仪(DNM-9606)、不同规格Eppendorf移液枪数把、一次性枪头、蒸馏水、已制备完成的CXCL12/PDGF/CXCL14试剂盒等。
1.5 血清样本准备 在实验前1 d将血清样本从-80 ℃冰箱转移至-20 ℃冰箱。在检测当天将血清样本取出,在冰水混合物中解冻至血清完全溶解。在ELISA所需试剂及设备调试好之前,放入4 ℃冰箱待检。
1.6 血清样本ELISA
1.6.1 CXCL12血清样本测定 ①加样:将标准品(A. 0 ng/mL,B. 0.5 ng/mL,C. 1.0 ng/mL,D. 2.5 ng/mL,E. 5.0 ng/mL, F. 10 ng/mL)和待测样品加入96孔板,每孔均加样100 μL,空白孔加入PBS,所有检测均做复孔。将96孔板充分混合后置37 ℃温育 2 h。②洗涤:倾去液体,拍干,每孔加满洗涤液,震荡 30 s,倾去洗涤液。如此重复5次,拍干。③每孔加入生物标记抗CXCL12抗体100 μL,37 ℃反应15 min。④洗涤:方法同②。⑤每孔加入链霉亲和素辣根过氧化物酶100 μL,37 ℃反应15 min。⑥洗涤:方法同②。⑦显色:每孔加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37 ℃避光反应15 min。⑧终止:每孔加入终止液50 μL,终止反应。⑨测定:在加入终止液10 min内,将酶标板放入酶标分析仪进行测定。⑩得出数据:将酶标仪读出的数据用空白孔调零后,根据标准品浓度及对应OD值算出标准曲线的直线回归方程(R2>0.99),由此算出各样品浓度。
1.6.2 PDGF和CXCL14血清样本测定 PDGF和CXCL14血清样本测定过程与CXCL12的测定过程基本相同,除了步骤①和步骤③。步骤①中,PDGF的标准品为A. 0 pg/mL,B. 50 pg/mL,C. 100 pg/mL,D. 250 pg/mL,E. 500 pg/mL,F. 1 000 pg/mL;CXCL14的标准品为A. 0 ng/mL,B. 0.5 ng/mL,C. 1.0 ng/mL,D. 2.5 ng/mL,E. 5.0 ng/mL, F. 10 ng/mL。在加样过程中,标准品及检测样品加样量均为10 μL。步骤③中测定PDGF时加入生物素标记抗PDGF抗体,测定CXCL14时加入生物标记抗CXCL14抗体。
1.7 统计学处理 应用SPSS 19.0建立数据库,进行各组间差异性检验,并用GraphPad Prism 5对检测结果作图。
2 结果
2.1 血液样本 共收集血清95份:ON患者血清22份,其中AON组10份,CON组12份;NMOSDs患者血清41份,其中ANMOSDs组24份,CNMOSDs组17份;NMO组血清13份;MS组血清5份;HC组血清14份。其中NMOSDs组主要是复发性的ON、双眼同时发病的ON和伴随系统性自身免疫性疾病的ON。
2.2 CXCL12检测结果 HC组浓度为(0.207±0.150)ng/mL;AON组浓度为(0.136±0.076)ng/mL;CON组浓度为(0.431±0.276)ng/mL;ANMOSDs组浓度为(0.281±0.257)ng/mL;CNMOSDs组浓度为(0.270±0.132)ng/mL;NMO组浓度为(0.498±0.221)ng/mL;MS组浓度为(0.439±0.174)ng/mL。以分组为变量进行方差分析(ANOVA),各组之间浓度差异有统计学意义(P=0.000)。
CXCL12在各组间的相互比较见图1。①AON组、CON组与HC组的比较中(图1A),AON组较为集中,CON组波动范围较大。AON组浓度均数低于CON组,差异有统计学意义(P=0.003 8)。CON组浓度均数比HC组高,差异有统计学意义(P=0.015 8)。AON组均数低于HC组,但差异没有统计学意义(P=0.168 6)。②ANMOSDs组、CNMOSDs组与HC组的比较中(图1B),ANMOSDs组离散程度较大,CNMOSDs组相对集中。各组间均数差异没有统计学意义,ANMOSDs组与HC组(P=0.340 2),ANMOSDs组与CNMOSDs组(P=0.867 8),CNMOSDs组与HC组(P=0.235 9),但HC组均数略低于ANMOSDs组和CNMOSDs组。③NMO组、MS组与HC组的比较中(图1C),各组均表现出较大的离散度。NMO组均数高于HC组,差异有统计学意义(P=0.000 5)。MS组均数高于HC组,差异有统计学意义(P=0.011 6)。NMO组均数高于MS组,但差异无统计学意义(P=0.601 9)。④NMOSDs组(包含ANMOSDs组与CNMOSDs组)、NMO组与HC组比较中(图1D),各组间离散度较大。NMO组均数高于NMOSDs组,差异有统计学意义(P=0.002 1)。NMO组均数也高于与HC组,差异有统计学意义(P=0.000 5)。NMOSDs组与HC组差异无统计学意义(P=0.272 9)。

图1. 不同分组中CXCL12浓度及组内差异性 *示P<0.05,**示P<0.01,***示P<0.001
2.3 PDGF检测结果 HC组浓度为(40.944±14.677)pg/mL;AON组浓度为(25.771±5.094)pg/mL;CON组浓度为(34.359±4.567)pg/mL;ANMOSDs组浓度为(32.589±8.957)pg/mL;CNMOSDs组浓度为(38.805±10.449)pg/mL;NMO组浓度为(48.982±12.985)pg/mL;MS组浓度为(50.498±6.322)pg/mL。以分组为变量进行ANOVA,各组间浓度差异有统计学意义(P=0.000)。
PDGF在各组间的相互比较见图2。①AON组、CON组与HC组的比较中,AON组与CON组均较为集中,HC组变异度较大。AON组浓度均数低于CON组,差异有统计学意义(P=0.000 5)。AON组浓度均值同样低于HC组,差异有统计学意义(P=0.005 0)。CON组与HC组浓度均数略有差别,但差异无统计学意义(P=0.149 2)。②ANMOSDs组、CNMOSDs组与HC组的比较中,ANMOSDs组浓度最低,与HC组相比差异有统计学意义(P=0.035 3),与CNMOSDs组相比差异有统计学意义(P=0.047 8)。CNMOSDs组浓度均数略低于HC组,但差异无统计学意义(P=0.639 5)。③NMO组、MS组与HC组的比较中,各组间离散程度不等。NMO组与MS组浓度均数基本相同,高于HC组浓度。各组间差异无统计意义,NMO组与HC组(P=0.145 5),NMO组与MS组(P=0.808 0),MS组与HC组(P=0.182 4)。④NMOSDs组(包含ANMOSDs组与CNMOSDs组)、NMO组与HC组比较中,NMOSDs组浓度均数最低,与NMO组相比差异有统计学意义(P=0.000 2),但与HC组相比差异无统计学意义(P=0.104 7)。NMO组略高于HC组,但差异无统计学意义(P=0.145 5)。
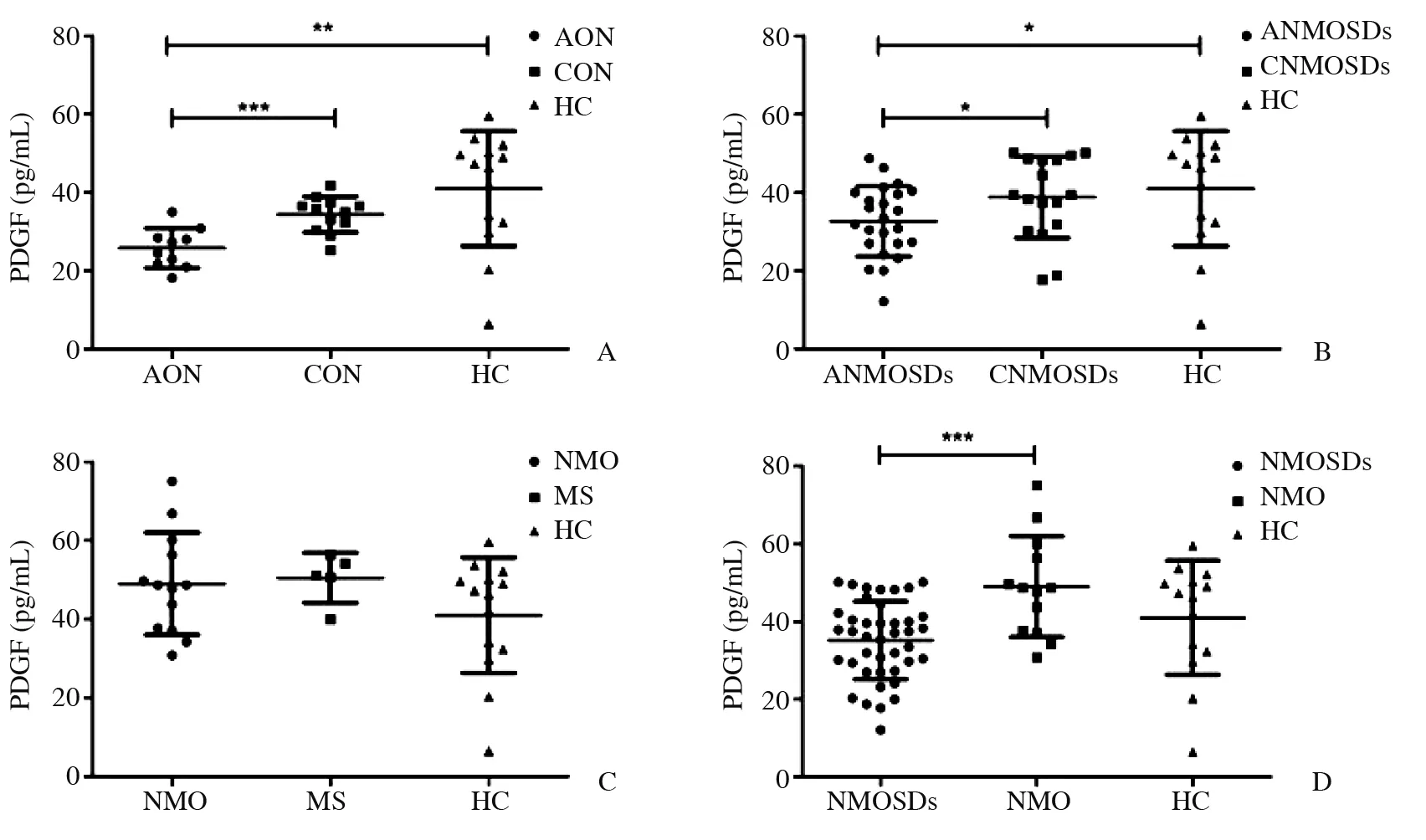
图2. 不同分组中PDGF浓度及组内差异性 *示P<0.05,**示P<0.01,***示P<0.001
2.4 CXCL14检测结果 HC组浓度为(2.149±1.783)ng/mL;AON组浓度为(1.312±1.127)ng/mL;CON组浓度为(4.740±2.281)ng/mL;ANMOSDs组浓度为(2.111±1.351)ng/mL;CNMOSDs组浓度为(2.127±1.739)ng/mL;NMO组浓度为(7.096±5.198)ng/mL;MS组浓度为(2.409±1.009)ng/mL。以分组为变量进行ANOVA,各组间浓度差异有统计学意义(P=0.000)。
CXCL14在各组间的相互比较见图3。①AON组、CON组与HC组的比较中,AON组较为集中,CON组离散度最大,HC组浓度呈两端分布明显。AON组浓度均数最低,与CON组相比差异有统计学意义(P=0.000 3),与HC组相比差异无统计学意义(P=0.205 3)。CON组浓度均数高于HC组,差异有统计学意义(P=0.003 4)。②ANMOSDs组、CNMOSDs组与HC组的比较中,ANMOSDs组与CNMOSDs组成倒三角分布,HC组呈两端分布。各组间浓度均数大致相等,差异均无统计学意义,ANMOSDs组与HC组(P=0.942 1),ANMOSDs组与CNMOSDs组(P=0.970 7),CNMOSDs组与HC组(P=0.975 6)。③NMO组、MS组与HC组的比较中,NMO组离散度最大,MS组相对集中,HC组呈两端分布。NMO组浓度均数最高,与HC组相比,差异有统计学意义(P=0.002 5),但与MS组差异无统计学意义(P=0.066 9)。MS组与HC组浓度均数大致相同,差异无统计学意义(P=0.761 9)。④NMOSDs组(包含ANMOSDs组与CNMOSDs组)、NMO组与HC组比较中,NMOSDs组较为集中,NMO离散度大,HC组成两端分布。NMOSDs组浓度均数低于NMO组,差异有统计学意义(P<0.000 1)。NMOSDs组与HC组浓度均数大致相等,差异无统计学意义(P=0.951 1)。NMO组浓度均数高于HC组,差异有统计学意义(P=0.002 5)。

图3. 不同分组中CXCL14浓度及组内差异性 *示P<0.05,**示P<0.01,***示P<0.001
2.5 相同患者在疾病不同时期各因子变化 共有6例患者在ON的急性期和缓解期均有血液样本采集(图4),其各项指标结果如下:AON组,CXCL12浓度为(0.204±0.179)ng/mL,PDGF浓度为(24.312±5.788)pg/mL,CXCL14浓度为(1.424±0.878)ng/mL;CON组,CXCL12浓度为(0.308±0.275)ng/mL,PDGF浓度为(32.450±11.932)pg/mL,CXCL14浓度为(1.756±1.772)ng/mL。各因子在AON组的浓度均数均低于CON组,但差异无统计学意义(P值分别为0.351、0.085及0.731)。

图4. 相同患者在疾病急性期及缓解期血清CXCL12、PDGF和CXCL14浓度水平
3 讨论
3.1 CXCL12浓度与各组间的关系 在CNS脱髓鞘动物模型中发现,CXCL12在病灶区域的微血管高表达,说明在脱髓鞘疾病中,血-脑屏障(blood-brain barrier, BBB)是CXCL12的主要来源[13]。在这些动物BBB中CXCL12浓度较高的表现出较轻微的症状,而CXCL12浓度较低甚至检测不到的动物,则接近瘫痪状态[13]。CXCL12沿血管腔分泌,通过活化星形胶质细胞和小胶质细胞浸润至CXCL12高浓度区;并与CNS中与高表达CXCR4的少突胶质细胞祖细胞(oligodendrocyte progenitor cells,OPCs)特异性结合,促进OPCs成熟,且OPCs本身也可分泌CXCL12以放大效应[14-16]。这说明CXCL12在脱髓鞘损伤的修复中起重要作用。
在本研究中,AON组血清中CXCL12浓度较低,而CON组血清中浓度较高,且高于HC组患者。血清中CXCL12浓度在ON不同时期的变化,印证了在基础实验中CXCL12对CNS脱髓鞘损伤的修复作用。CON组CXCL12浓度离散程度较高,可解释为在缓解的过程中所表现出来的不同阶段,可能为ON的预后提供了一个有效的血液学指标。
对于NMOSDs组来说,无论是ANMOSDs组或CNMOSDs组,与HC组均没有显著差异。在国内外文献中也尚无关于CXCL12与NMOSDs间的研究。NMOSDs所包含的疾病较多,无论是复发性ON、双眼同时发病的ON及系统性自身免疫性疾病相关的ON等,其疾病本身都有着复杂性,而在这种复杂环境的影响下,血清CXCL12浓度尚不能对疾病的预后有明确的指示作用。然而从另一角度分析,首次发病的ON患者,如果病程的急性期和缓解期CXCL12浓度变化较小,可能意味着该患者应归属于NMOSDs,对其疾病的进程应做进一步的观察。
在NMO组及MS组中,血清并非来自患者急性期。因此,在NMO组、MS组及HC组三者的比较中,NMO组和MS组CXCL12浓度比HC组显著增高,说明在NMO及MS的非急性期,脱髓鞘后的修复作用占主导地位。
在NMOSDs组、NMO组及HC组的比较中发现,NMOSDs组CXCL12浓度明显低于NMO组。由于NMOSDs组包括了急性期和缓解期两个时期,这种与NMO组间的差异,显得不易解释。这可能也是因为NMOSDs的易复发性和复杂性所导致。
3.2 PDGF浓度与各组间关系 在CNS中,PDGF对神经元增生和分化起到至关重要的作用[17-19]。PDGF也被认为与神经损伤后的修复相关,如在动物脑缺血模型中,负责PDGF转录的mRNA迅速增高;与此同时在CNS中,PDGF受体的表达也增高[20]。有研究[21]发现,在动物模型中PDGF调节Arc/Arg3.1基因的表达,而Arc/Arg3.1基因与突触可塑性和神经的长期修复有关。在MS的研究中发现,PDGF通过活化OPCs来促进CNS脱髓鞘病灶的髓鞘再生[22]。然而PDGF由于其来源和作用广泛,并有多种不同的类型,包括PDGF-A、PDGF-B、PDGF-C和PDGF-D,致使其在CNS脱髓鞘疾病的血液研究中构成了重大障碍。
在本研究中,AON、CON与HC 3组的比较中,AON组和CON组PDGF浓度较为集中,且AON组与CON组血清中PDGF的显著性差异仍被检测到。CON组中高浓度的PDGF可以理解为PDGF对OPCs增殖分化作用和对神经元修复及突触重塑作用,在临床上使得ON临床表现缓解;而CON组与HC组相比,其差别虽没有显著差异,HC组却表现出较高的均数。但是,HC组离散度较大,是否是由于标本量过少,还是由于血液中其他来源的PDGF对研究结果造成的影响尚不能明确分析,需要进一步的研究才能得出结论。
NMOSDs两组和HC组的对比中,急性期与缓解期和正常组间的浓度差异显著。而在相同标本的CXCL12中没有检测出差异性,PDGF是否能结合CXCL12来分析NMOSDs疾病的预后甚至疾病的诊断值得进一步的研究。
在NMO、MS与HC 3组的比较中,3组离散程度均较大,NMO组和MS组均数高于HC组,但没有显著性差异。这种血清PDGF浓度的升高在非急性期NMO和MS中也可以解释为PDGF升高带来的CNS修复作用在血液学中的客观表现。
在NMOSDs、NMO与HC 3组的比较中,NMOSDs组血清PDGF均数显著低于NMO组。这种显著性差异,在CXCL12的血清检测中同样存在。
3.3 CXCL14浓度与各组间关系 CXCL14又名胸肾表达趋化因子(breast and kidney expressed chemokine, BKEC),在肿瘤的研究中具有重要的地位。在免疫反应中,CXCL14活化巨噬细胞、未成熟的树突细胞和NK细胞;但在CXCL14缺乏的小鼠中,并没有出现明显的免疫缺陷,这意味着其作用可能被其他趋化因子代偿[23]。近年来在动物模型的CNS免疫反应中CXCL14发挥重要的作用[24-25]。随后,日本一个关于干细胞工程的研究团队发现,CXCL14与CXCL12的特异性受体CXCR4特异性结合抑制CXCL12所产生的趋化作用,从而限制白细胞和造血祖细胞的增殖和趋化作用[26]。但在CNS损伤和修复中,CXCL14的来源仍不清楚。
在各组组内和组间的比较中,CXCL14在血清中的浓度均数变化与CXCL12表现出近乎完全相同。结合日本研究团队研究结果,CXCL14更倾向是伴随CXCL12浓度升高反馈产生的抑制性因子。但是从本研究结果来看,各组均表现出较高的离散度,特别是HC组中,CXCL14浓度呈两端分布。这是否与CXCL14的浓度受体内更多因素调节有关,特别是某些周期性因素,如女性生理周期中雌、孕激素变化等。体内其他来源的CXCL14对血清浓度的影响也不能排除。
在AON、CON和HC 3组对照中,AON组和CON组血清CXCL14浓度显著的差异在判断ON急性期与缓解期之间的差异仍不失为一项可靠指标。
3.4 不同指标在相同患者不同时期的意义 本研究幸运地获取了6例ON患者急性期及缓解期的血清,并同时做了CXCL12、PDGF和CXCL14的检测分析。其结果与不同患者的急性期和缓解期表现出相同的趋势,进一步证明了在ON缓解的过程中,这3种因子浓度升高有着明确的意义。
[1] Wegner C. Recent insights into the pathology of multiple sclerosis and neuromyelitis optica[J]. Clin Neurol Neurosurg,2013,115(Suppl 1):S38-41.
[2] Nagasawa T, Tachibana K, Kishimoto T. A novel CXC chemokine PBSF/SDF-1 and its receptor CXCR4: their functions in development, hematopoiesis and HIV infection[J]. Semin Immunol,1998, 10(3):179-185.
[3] Lapidot T, Dar A, Kollet O. How do stem cells find their way home?[J]. Blood,2005,106(6):1901-1910.
[4] Pashenkov M, Söderström M, Link H. Secondary lymphoid organ chemokines are elevated in the cerebrospinal fluid during central nervous system inflammation[J].J Neuroimmunol,2003,135(1/2):154-160.
[5] Edwards KR, Goyal J, Plavina T, et al. Feasibility of the use of combinatorial chemokine arrays to study blood and CSF in multiple sclerosis[J]. PLoS One,2013,8(11):e81007.
[7] Mori F,Rossi S,Piccinin S, et al. Synaptic plasticity and PDGF signaling defects underlie clinical progression in multiple sclerosis[J]. J Neurosci, 2013, 33(49):19112-19119.
[8] Gilbertson DG, Duff ME, West JW, et al. Platelet-derived growth factor C(PDGF-C), a novel growth factor that binds to PDGF alpha and beta receptor[J].J Biol Chem,2001, 276(29):27406-27414.
[9] Uutela M, Laurén J, Bergsten E, et al. Chromosomal location, exon structure, and vascular expression patterns of the human PDGFC and PDGFD genes[J]. Circulation,2001,103(18):2242-2247.
[10] Sanchez-Guerrero E, Midgley VC, Khachigian LM. Angiotensin II induction of PDGF-C expression is mediated by AT1 receptor-dependent Egr-1 transactivation[J]. Nucleic Acids Res,2008,36(6):1941-1951.
[11] Tanegashima K, Suzuki K, Nakayama Y, et al. CXCL14 is a natural inhibitor of the CXCL12-CXCR4 signaling axis[J]. FEBS Lett,2013, 587(12):1731-1735.
[12] Wingerchuk DM, Lennon VA, Lucchinetti CF, et al. The spectrum of neuromyelitis optica[J]. Lancet Neurol, 2007,6(9): 805-815.
[14] McCandless EE, Wang Q, Woerner BM, et al.CXCL12 limits inflammation by localizing mononuclear infiltrates to the perivascular space during experimental autoimmune encephalomyelitis[J]. J Immunol,2006,177(11):8053-8064.
[15] McCandless EE, Piccio L, Woerner BM, et al. Pathological expression of CXCL12 at the blood-brain barrier correlates with severity of multiple sclerosis[J]. Am J Pathol,2008, 172(3):799-808.
[16] McCandless EE, Zhang B, Diamond MS, et al.CXCR4 antagonism increases T cell trafficking in the central nervous system and improves survival from West Nile virus encephalitis[J]. Proc Natl Acad Sci U S A,2008,105(32):11270-11275.
[17] Demoulin JB, Enarsson M, Larsson J, et al. The gene expression profile of PDGF-treated neural stem cells corresponds to partially differentiated neurons and glia[J]. Growth Factors,2006,24(3):184-196.
[18] Yao H, Duan M, Yang L, et al. Platelet-derived growth factor-BB restores human immunodeficiency virus Tat-cocaine-mediated impairment of neurogenesis: role of TRPC1 channels[J].J Neurosci,2012, 32(29):9835-9847.
[19] Asakura K, Hunter SF, Rodriguez M. Effects of transforming growth factor-beta and platelet-derived growth factor on oligodendrocyte precursors: insights gained from a neuronal cell line[J]. J Neurochem, 1997,68(6):2281-2290.
[20] Egawa-Tsuzuki T, Ohno M, Tanaka N, et al. The PDGF B-chain is involved in the ontogenic susceptibility of the developing rat brain to NMDA toxicity[J]. Exp Neurol,2004,86(1):89-98.
[21] Peng F, Yao H, Bai X, et al. Platelet-derived growth factor-mediated induction of the synaptic plasticity gene Arc/Arg3.1[J].J Biol Chem, 2010, 285(28):21615-21624.
[22] Watzlawik JO, Warrington AE, Rodriguez M.. PDGF is required for remyelination-promoting IgM stimulation of oligodendrocyte progenitor cell proliferation[J]. PLoS One,2013,8(2):e55149.
[23] Hara T, Tanegashima K. Pleiotropic functions of the CXC-type chemokine CXCL14 in mammals[J]. J Biochem,2012,151(5):469-476.
[24] Banisadr G, Bhattacharyya BJ, Belmadani A, et al. The chemokine BRAK/CXCL14 regulates synaptic transmission in the adult mouse dentate gyrus stem cell niche[J]. J Neurochem, 2011,119(6):1173-1182.
[25] Yamamoto T, Yamashita A, Yamada K, et al. Immunohistochemical localization of chemokine CXCL14 in rat hypothalamic neurons[J].Neurosci Lett,2011,487(3):335-340.
[26] Tanegashima K, Suzuki K, Nakayama Y, et al. CXCL14 is a natural inhibitor of the CXCL12-CXCR4 signaling axis[J]. FEBS Lett, 2013, 587(12):1731-1735.
(本文编辑 诸静英)
Serum level of CXCL12, platelet-derived growth factor, CXCL14 in acute optic neuritis and its association with prognosis
LIU Zi-hao*, JIANG Zhao-cai**, WEI Shi-hui, CHEN Ting-jun
Department of Ophthalmology, Chinese People′s Liberation Army General Hospital, Beijing 100853, China
CHEN Ting-jun, chentingj_1@163.com
Objective To detect the serum level of chemokine 12(CXCL12), platelet-derived growth factor(PDGF), and chemokine 14(CXCL14) in optic neuritis (ON) as well as other demyelination diseases, and to analyze the differences of these factors. Methods Venous blood of patients with ON and other demyelination diseases were collected and divided into several groups. Enzyme-linked immunosorbent assay was used to measure the serum level of CXCL12, PDGF and CXCL14. Results ①The serum level of CXCL12 were 0.207±0.150 ng/mL in healthy control group(HC), 0.136±0.076 ng/mL in acute optic neuritis group(AON), 0.431±0.276 ng/mL in catabatic optic neuritis group(CON), 0.281±0.257 ng/mL in acute neuromyelitis optica spectrum diseases group(ANMOSDs), 0.270±0.132 ng/mL in catabatic neuromyelitis optica spectrum diseases group(CNMOSDs), 0.498±0.221 ng/mL in neuromyelitis optica group(NMO), and 0.439±0.174 ng/mL in multiple sclerosis group(MS). ②The serum level of PDGF were 40.944±14.677 pg/mL in HC group, 25.771±5.094 pg/mL in AON group, 34.359±4.567 pg/mL in CON group, 32.589±8.957 pg/mL in ANMOSDs group, 38.805±10.449 pg/mL in CNMOSDs group, 48.982±12.985 pg/mL in NMO group, and 50.498±6.322 pg/mL in MS group. ③The serum level of CXCL14 were 2.149±1.783 ng/mL in HC group, 1.312±1.127 ng/mL in AON group, 4.740±2.281 ng/mL in CON group, 2.111±1.351 ng/mL in ANMOSDs group, 2.127±1.739 ng/mL in CNMOSDs group, 7.096±5.198 ng/mL in NMO group, and 2.409±1.009 ng/mL in MS group. Conclusions ①The serum level of CXCL12, PDGF and CXCL14 decrease in AON group, and increase even higher than that in HC group as symptom recovering. ②The serum level of CXCL12 and CXCL14 have no significant distinction in different stages of NMOSDs. The serum level of PDGF is low in acute stage and high in catabatic stage, but is lower than that in HC group all the time. ③The serum level of CXCL12 in non-acute stage of NMO and MS are higher than that in HC group, without significant distinction. The serum level of CXCL14 in non-acute stage of NMO are higher than that in HC group. ④NMOSDs and NMO may have significant differences in prognosis and mechanism of nerve regeneration, which lead to the differences of serum levels of CXCL12, PDGF and CXCL14. (Chin J Ophthalmol and Otorhinolaryngol,2015,15:155-162)
Optic neuritis; Demyelinating diseases; Chemokine 12; Platelet-derived growth factor; Chemokine 14
中国人民解放军总医院眼科 北京 100853;*北京市中医药大学附属东直门医院眼科 北京 100700;
**北京市隆福医院眼科 北京 100010
陈霆隽(Email:chentingj_1@163.com)
10.14166/j.issn.1671-2420.2015.03.003
2015-03-12)
