微生物油脂制备生物柴油技术研究现状及发展趋势
2015-02-23李小英聂小安王义刚
李小英, 聂小安,2*, 陈 洁, 王义刚
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042;2.中国林业科学研究院 林业新技术研究所,北京 100091)
·综述评论——生物质能源·
微生物油脂制备生物柴油技术研究现状及发展趋势
李小英1, 聂小安1,2*, 陈 洁1, 王义刚1
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042;2.中国林业科学研究院 林业新技术研究所,北京 100091)
总结了微生物油脂的国内外研究现状,对比分析了中国与其他国家的生物柴油质量标准。介绍了微生物柴油的生产工艺,包括微生物油脂的筛选与培养、微生物预处理、油脂的提取精炼、微生物柴油的制备,并对微生物柴油的发展趋势进行了展望。
微生物油脂;研究现状;生产工艺;发展趋势
能源安全问题一直为世界各国所重视,随着石化资源的枯竭及日益严重的环境问题,生物柴油因其低硫、低芳香性、燃烧性能优良及生物可降解性等优点引起世界各国的广泛关注[1-4]。生物柴油主要通过酯交换法来制备,原料有大豆、油菜籽等油料作物,油棕、黄连木等油料林木果实,工程微藻等水生植物,以及动物油脂、餐饮废油等[5]。然而,粮油作物作为生物柴油的原料存在“与民争粮”的问题,木本植物的生长周期长、成本高,动物油脂和餐饮废油原料分散、回收困难、质量参差不齐、没有统一的国家质量标准,这些都严重制约了生物柴油的发展。近年来,从微藻、酵母、霉菌和细菌等含油微生物中提取油脂制备生物柴油受到了广泛关注和重视[6]。微生物油脂又称单细胞油脂(SCO),是由酵母、霉菌和藻类等产油微生物以碳水化合物、碳氢化合物和普通油脂为碳源、氮源,辅以无机盐在一定条件下生产的油脂和另一些有商业价值的脂质,主要是由不饱和脂肪酸(PUFAs)组成的甘油三酯,在脂肪酸组成上与植物油如菜籽油、棕榈油、大豆油等相似,是以C16和C18为主的脂肪酸[7-8],但不饱和度更高。因此,以微生物油脂为原料制备的生物柴油品质更好[9]。
1 微生物油脂的研究现状
1.1 国外研究现状
早在十九世纪晚期,德国就开始研究利用微生物生产油脂,以Paul Lindner为主的研究者发现了产油酵母菌美极梅奇酵母[10],其后美国也开始了研究。20世纪40年代发现了高产油脂的斯达凯依酵母、粘红酵母、曲霉属及毛霉属[11]。20世纪70年代,Nancy Moon等从衣阿华州立大学牛奶厂的排水通道中分离出产油酵母——弯假丝酵母[10]。
1976年,美国启动能源微藻研究,期望利用石化燃料产生的废气来生产含脂量高的微藻[12]。 1986年,日本和英国率先从微生物中提取含γ-亚麻酸(GLA)的油脂作为保健食品、功能性饮料和高级化妆品等,使得微生物油脂成功实用化[13]。1994年新西兰淀粉公司所属的油脂厂,从假丝酵母中选育出一种含油量达50%(干基)的“产油酵母菌”,它们利用制奶酪工厂的副产品——乳清作为产油酵母培养基,繁殖出大量的菌体,用传统的植物油压榨工艺获得对人体和家禽均无副作用的微生物油脂[14]。2007年,美国以能源部圣地亚国家实验室为主的实验室宣布了“微型曼哈顿计划”,希望从海洋藻类中获得丰富的能源[15]。2011年,西班牙水处理公司推出全球首个大规模利用废水培养微藻进行生物能源生产项目,计划2015年年底建成面积相当于10个足球场的展示厂房。随后微生物油脂的研究越来越受到重视,但由于生产成本等问题均与植物油脂和动物脂肪无法相比,因此研究大多以含有多不饱和脂肪酸的微生物为主。
1.2 国内研究现状
国内20世纪60年代就有霉菌和酵母菌生产油脂的报道,但研究较多的开始于20世纪90年代,而且主要为微生物功能性油脂,对微生物油脂制备微生物柴油的研究较少。1993年,张峻等[16]紫外诱变深黄被孢霉,得到菌体得率25%和油脂质量分数32.8%的变异株。1995年,罗玉萍等[17]分离出一株高产棕榈油酸的酵母菌,其油脂占干菌体质量的32.06%。1997年,施安辉等[18]从8株酵母菌中筛选出一株油脂含量高的GLR523菌株,进行诱变处理后,优化培养最终油脂产量可达干菌体质量分数的67.2%。2004年,缪晓玲[19]获得了油脂质量分数占干菌株质量55%的异样微藻。
2012年河北廊坊新奥集团研发的微藻制备生物柴油技术取得中试成功,已在内蒙古建设5 000 t/年微藻生物柴油示范工程,对煤电厂和化工厂等排放的二氧化碳进行资源化利用,生产生物能源。2013年,青岛能源所通过对国内外多株丝状微藻的性状进行评价,获得1株高含油的淡水黄丝藻。在低光照、无营养胁迫条件下培养12 d,获得淡水黄丝藻的总脂含量占干质量的61.3%,采用酸碱两步法对提取的油脂进行转酯化制备生物柴油,其脂肪酸组分主要为C16∶0与C16∶1,且制备的生物柴油完全符合国家标准 GB/T 20828—2007。
2 生物柴油的质量标准
微生物油脂作为清洁可再生的生物柴油原料,以其替代石化柴油也受到世界各国的重视。世界上很多国家已经拟定了生物柴油理化性质标准,从而保证柴油的质量,使消费者更加放心的使用生物柴油。自2000年开始,欧洲在实施不同阶段的汽车排放法规时,就不断降低柴油中的硫含量,到2009年时要求车用柴油的硫含量不得高于10 mg/kg,日本在车用柴油标准上基本参照了欧洲的发展趋势。美国自2006年就要求车用柴油的硫含量不得高于10 mg/kg,美国2015年发布了最新的生物柴油混合燃料(B100)标准规格ASTM D6751-2015a。我国首个生物柴油质量标准于2007年颁发, 2015年颁布了柴油机燃料调和用生物柴油(BD100)的最新国家标准GB/T 20828—2015,生物柴油具体质量标准见表1。
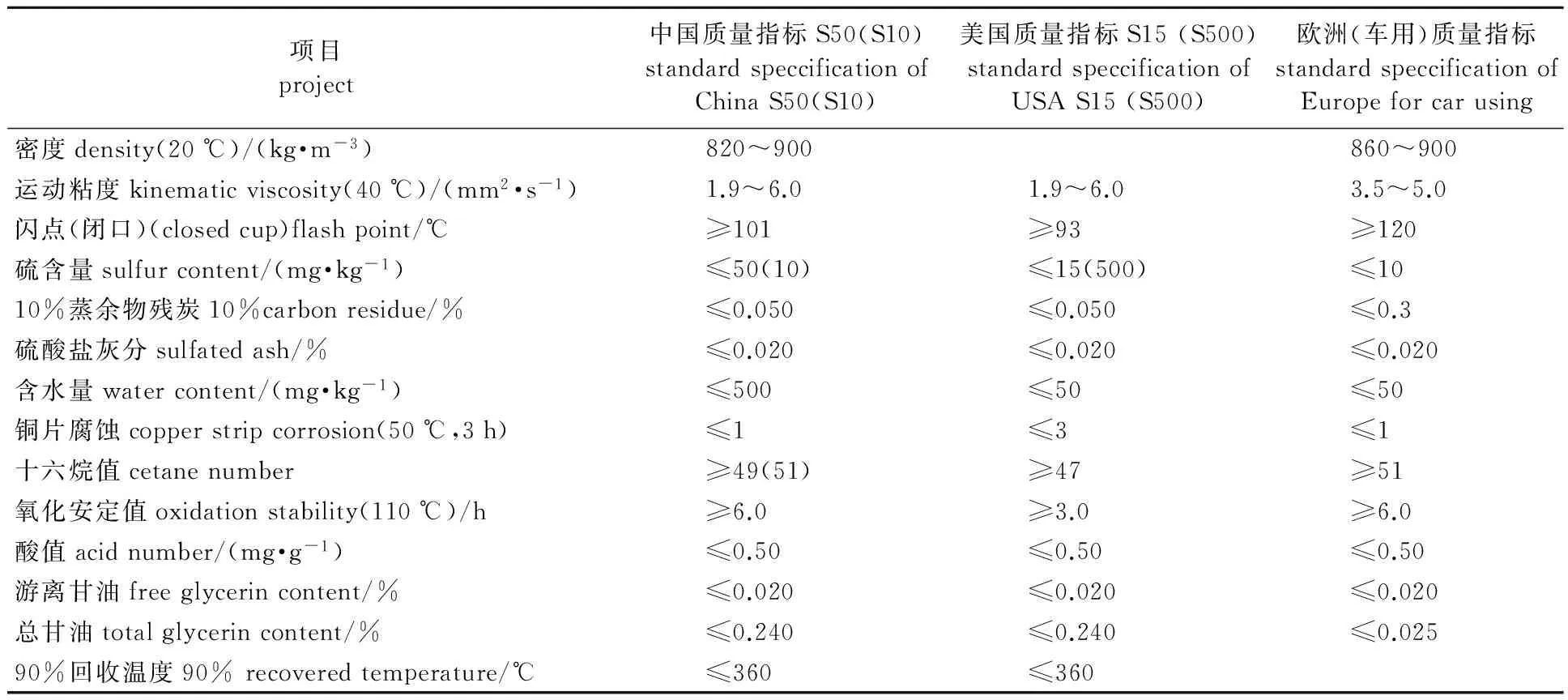
表1 中国、美国和欧洲的生物柴油质量标准
3 微生物柴油的制备工艺
微生物柴油的制备首先需要筛选出高产油脂的微生物菌体作为原料,经过灭菌处理后,可以进行扩大培养、收集,由于油脂存在于微生物菌体细胞内,需要对其进行预处理,以利于油脂的提取,提取后的油脂经脱胶、脱色等方法精炼后,通过酯交换反应后精炼得到精炼微生物柴油。
3.1 菌体的筛选和培养
在已有菌株的基础上利用细胞融合、诱变育种、基因工程等手段选育出应用于工业化的菌株,需具备: 1)油脂积累量大,含油量应达50%以上,且油脂转化率不低于15%; 2)生长速度快,不易污染杂菌,不易产生虫害; 3)能适应工业化的大规模简单培养,培养条件不宜苛刻[6]。
微生物都能合成少量油脂,但只有在适宜条件下可产生并贮存的油脂占其生物总量20%以上的才称为产油微生物[20]。目前用于微生物油脂生产的微生物主要为酵母、霉菌、微藻和细菌等,而细菌主要合成特殊脂类和多不饱和脂肪酸,产油率低[21-22],所以目前主要集中在酵母、霉菌和微藻上。
3.1.1 产油酵母 酵母是一种单细胞真菌,属于兼性厌氧菌,多数分离于富含糖类的环境中。产油酵母中含有的脂肪酸较为单一,多为含C16和C18脂肪酸[23-24]。常见的产油酵母主要有假丝酵母、浅白色隐球酵母、弯隐球酵母、斯达氏油脂酵母、胶粘红酵母、产油油脂酵母等,含油量可达菌体质量的30%~70%。
中科院大连化物所筛选出4株产油酵母能同时将葡萄糖、木糖和阿拉伯糖转化为油脂,菌体含油量超过其干质量的55%[25]。
3.1.2 产油霉菌 霉菌是形成分枝菌丝的真菌的统称,因其油脂含量高,并含有丰富的γ-亚麻酸、花生四烯酸等功能性多不饱和脂肪酸而被深入研究。霉菌种类很多,常见的产油霉菌为土菌霉、深黄被孢霉、高山被孢霉、卷枝毛霉、米曲霉等,其含油量可达菌体干质量的25%~65%。
郑红波等[26]从富含油脂的土壤中分离出47株产油脂菌株,筛选出7株油脂含量高的菌体,其中菌株华2-1(该菌株为深黄伞形霉)的油脂质量分数达48.60%。
叶思特等[27]从30份土壤样品中筛选出9株产油霉菌和4株产油酵母,产油最高的是霉菌嗜松青霉,为26.4%;产油最高的酵母是假丝孢酵母,为44.3%;其他菌株的产油率多为17%~27%,其他文献报道的产油率多为20%~25%[28-29],基本一致。
3.1.3 产油微藻 微藻是指能进行光合作用的单细胞藻类或藻群体,广泛分布在海洋、淡水湖泊等水域以及潮湿的土壤和树干等[30]。目前,藻类专家已经测定了几百种富油微藻,常见的产油微藻有绿藻、硅藻和部分蓝藻如小球藻、杜氏盐藻、葡萄藻等[31]。
Rodolfi等[32]从30份微藻中筛选出4株菌株(2株海藻和2株淡水藻),其中一株黄绿藻Nannochloropsissp.在缺氮条件下培养,油脂质量分数高达60%。
Moazami等[33]从波斯湾和格什姆岛筛选出147种微藻,在培养8~12 d之后,Nannochloropsissp.和Neochlorissp.的油脂质量分数分别为52%和46%。
不同微生物的最佳培养条件不同,培养方法、培养基组成、培养温度、pH值、光照、通气量等均影响菌体产油率。
3.2 微生物预处理
微生物油脂多包含在菌体胞内,有的甚至与菌体细胞蛋白或糖物质结合,由于细胞壁坚韧,在提取油脂之前要对菌体细胞进行破壁预处理。目前,微生物油脂成本高,寻找适于工业化的高效破壁技术是关键。常见的破壁方法有:研磨法、酸热法、反复冻融法、超声波破碎法、酶解法等[34-36],其中研磨法较接近传统植物油脂的预处理,常用于工业化生产油脂,反复冻融、超声波法等适用于实验室小型操作。
3.2.1 研磨法 利用研钵、球磨等研磨机械产生的剪切力将细胞破碎,在合适条件下一次操作就可以达到较高的破壁率,操作简单、实用性强,易于工业放大,但料液损失较严重。万其兵等[37]研究了研磨法对真菌细胞破壁的影响,结果发现,若研磨时间较短,细胞破壁效果不佳,只有延长研磨时间,但容易使胞内物质变性。
3.2.2 酸热法 首先用盐酸对菌体细胞壁进行处理,使原来结构紧密的细胞壁变得疏松,再经沸水浴及速冻处理,使细胞壁进一步被破坏[38]。酸热破壁条件苛刻,容易破坏细胞中的物质或与其反应,且后续的盐酸难以除去,因此很少用于大规模工业生产。孔凡敏等[39]通过正交试验确定了酸热法对酵母干菌体破壁的最优条件为4 mol/L盐酸沸水浴8 min。
3.2.3 反复冻融法 利用冻结-解冻过程中细胞内部的冰晶对细胞壁的机械作用而使其破裂的一种物理方法。它可以避免高温对原料造成的营养损失、风味劣变等,是较温和的破壁方式,且设备简单,能源消耗低,但每次冻融需要消耗大量时间,使得部分酵母细胞自溶而使油脂含量降低[40]。孙晓璐等[41]采用冻融法处理产油酵母细胞,在-80 ℃液氮冷冻后煮沸30 min的油脂得率为9.5%,效果较差。
3.2.4 超声波破碎法 超声波是一种弹性机械振动波,当超声波在液体介质中引起空化作用,产生大量空泡,空泡随后爆裂,在此过程中产生冲击波和局部高温,从而使细胞破裂[42]。该法高效、省时、操作简单、料液损失少;但噪音大、散热困难,目前还停留在实验室规模应用。孙利芹等[43]研究了超声波对紫球藻细胞破壁率影响,当空占比为50%,输出功率为150 W,时间为20 min,破壁率可达84.4%。
3.2.5 酶解法 基于某种特定的生物酶对菌体细胞进行分解,破坏细胞壁加速胞内油脂的释放。操作时需先调节环境pH值至酶活性最大,再加入一定比例的酶液对细胞壁进行处理。酶法破壁适用于多种微生物,其作用条件温和,且破壁过程对内含物不易产生破坏,但溶酶价格昂贵,回收溶酶又会增加额外的分离纯化操作,这限制了它的大规模应用。林杰[44]确定了复合酶破壁提取裂殖壶菌胞内油脂的优化条件:复合酶用量为(0.263±0.012)%,pH值7.45±0.5,破壁时间3.0 h,温度50±1 ℃,此时DHA的粗油得率为(83.85±0.8)%。
3.3 油脂提取
针对微生物油脂提取工艺中细胞破壁成本高的问题,开发高效低成本的破壁技术,快速释放油脂,采用低成本、快速的油水分离技术,分析研究各种提取工艺的优缺点及适用范围,选用合适方法,并通过进一步改进得到简易快捷的提取方法尤为重要。
3.3.1 有机溶剂法 利用油脂能够溶于某些溶剂的特性,通过浸湿渗透、分子扩散等将菌体细胞中的油脂提取出来。常用的有机溶剂如苯、丙酮、己烷、环己烷、乙醚等对微生物油脂的提取效果较好,可以用单一或几种溶剂混合物作为提取剂。该法成本低,操作简单,但溶剂有毒,污染环境,且有机溶剂渗透性较差,测定的总脂含量不准确。Cheng等[45]比较了溶剂提取和超临界CO2萃取技术对Pavlovasp.粗油脂提取效率,发现混合溶剂乙酸乙酯/甲醇提取效果最佳,为44.7%。
3.3.2 索氏提取法 利用溶剂在索氏提取器中的回流和虹吸,从而使微生物油脂不断被萃取。该法油脂得率高,但耗时长,需要加热消耗能量大,但因其高效准确,可作为筛选菌株和优化培养时使用。刘宪夫等[46]研究了不同提取方法对小球藻油脂得率的影响,发现索氏提取法中无水乙醇作为溶剂的提取率最高为(24.37±0.21)%。
3.3.3 超临界CO2萃取法 当CO2处于临界温度和压力以上时,就使得其具有液体的溶解性和气体的流动性。在临界点附近,CO2对油脂溶解度随体系温度和压力连续变化,从而可以从菌体中提取油脂[47]。该法可以避免产物氧化,不破坏提取物,提取速度快,安全无污染,但需要专门的仪器设备,且设备操作费用昂贵[48]。 Couto等[49]研究了在温度323 K、压力为30 MPa、超临界CO2萃取3 h的条件下,几乎50%的微藻油脂被提取出来。
3.4 微生物柴油的制备
生物柴油替代石油最初是在第二次世界大战中提出,主要是采用直接与汽油或柴油混合、微乳化和高温裂解法,以降低油脂的黏度,但成效不大。目前,较为常用的方法为酯交换法,包括酸催化酯交换法、碱催化酯交换法、酶催化酯交换法、亚临界酯交换法和超临界酯交换法等。
3.4.1 酸催化酯交换法 酸催化剂包括无机液体酸(硫酸、磷酸和盐酸等)、有机磺酸、酸性离子液体、强酸性离子交换树脂和固体酸等。硫酸为较常用的酸性催化剂, 价格便宜, 但腐蚀设备且不易回收,与碱金属相比,耗用的甲醇多,反应时间长,但当甘油酯中游离脂肪酸和水含量较高时,酸更合适[50]。
Dai等[51]利用硫酸催化从酵母Rhodotorulagutinis中提取的油脂,在醇油物质的量之比为30∶1,反应5 h后,生物柴油的得率可达81.7%,且制得的生物柴油组分与植物油相似。
3.4.2 碱催化酯交换法 碱催化剂包括KOH、NaOH、碳酸盐、烷基氧化物(如甲醇钠等)、固体碱(如CaO等)和含氮类有机碱等, 最常用的碱性催化剂为KOH 和NaOH[50]。碱催化酯交换的反应速率很快,是酸催化速率的4 000倍,但是碱催化对原料中的游离脂肪酸和水更敏感,游离脂肪酸与碱反应易发生皂化反应,生成的皂在反应中起乳化作用,与产品甘油和脂肪酸甲酯发生乳化而无法分离。而水会使产物甲酯水解成脂肪酸,使反应体系变得复杂。
刘会影等[52]采用两步法,首先以超临界CO2萃取深黄被孢霉M2发酵得到微生物油脂,然后研究了酸催化脱酸-碱催化酯交换两步法制备生物柴油,在酸值由高酸值降低到1.60 mg/g时,催化剂KOH用量为1.25%,醇油物质的量之比10∶1,反应温度为57 ℃,反应1.47 h,微生物柴油得率高达93.39%。
3.4.3 酶催化酯交换法 酶催化法是指以脂肪酶为催化剂,将醇与脂肪酶反应生成脂肪酸酯的过程,其催化工艺通常是多个顺序水解和酯化的过程。
里伟等[53]通过酸热法提取了微生物油脂,采用3% Lipozyme TLIM和1% Novozym 435脂肪酶混合用于酵母毛油脂制备生物柴油,在叔丁醇介质体系下,三步甲醇醇解的生物柴油得率高达89.7%。
Tran等[54]用固定化脂肪酶催化微藻转酯化制备生物柴油,比较了超声波破壁与己烷提取的粗油脂和超声波破壁后直接与甲醇酯交换的悬浮液的油脂转化率,分别为72.1%和97.3%。实验表明:直接在细胞破壁后用脂肪酶催化转酯化效率更高,且脂肪酶在重复使用6次后活性变化不大。
该法反应条件温和、收率高,脂肪酶催化剂容易与产品分离,固定化酶可以重复使用,废弃的酶可以被生物降解,不会产生工业废水;反应中不需要过量的甲醇,分离提取简单,耗能少;无酸碱,不会造成皂化反应,生产稳定性好等,因此也受到广大研究者的关注,但由于生产成本高、酯交换时间长,在工业上没有大规模推广[55-56]。目前存在以下问题:脂肪酶只对长链脂肪醇的酯化或转酯化有效,对短链脂肪醇(甲醇、乙醇等)的转化率只有40%~60%;甲醇和乙醇对酶有毒,容易导致其失活;副产物甘油和水难以回收,并且反应过程中对脂肪酸酯的生成产生抑制作用[57]。
3.4.4 亚临界酯交换法 油脂-甲醇-催化剂在接近甲醇超临界温度下进行的酯交换反应。亚临界温度通常为120~220 ℃。由于反应温度大大高于甲醇常压沸点,整个反应体系实质上处于带压状态。
侯相林等[58]研究了亚临界甲醇相固体碱催化大豆油酯交换制备生物柴油,在140 ℃、2 MPa、醇油物质的量之比16∶1和反应时间30 min条件下,K2CO3/Al2O3催化大豆油酯交换反应脂肪酸甲酯含量可达90%以上。亚临界酯交换法工艺的特点是反应时间短,对原料油脂的酸值、含水量等要求不高,不需要精制预处理,降低了生产成本。
3.4.5 超临界酯交换法 当温度和压力超过临界点时,物质处于一种气液不分的状态。在超临界状态下,流体具有不同于气体或液体的性质,密度接近于液体,黏度接近于气体,导热率和扩散系数介于气液之间,此时植物油与甲醇相容性提高,反应几乎是在均相中进行,使得反应和提取可以同时进行。超临界酯交换法是指在不添加催化剂的条件下,油脂在甲醇的超临界状态下进行的酯交换反应。
张贵芝等[59]以小球藻为原料采用超临界甲醇直接酯交换法制备生物柴油,在甲醇与湿藻(50%含水量)配比为8∶1(mL∶g)、反应温度260 ℃、反应压力8 MPa和停留时间10 min、未加任何萃取剂的条件下,微藻生物柴油产率高达9%,获得微生物柴油的性质与石化柴油的理化性质和组分相近。
目前,工业上主要采用化学法生产生物柴油,但化学法对油脂原料品质要求苛刻,需要酸碱作为催化剂,工艺复杂、效率低、成本高且污染环境,因而近年来利用超临界甲醇制备生物柴油的研究受到关注。超临界甲醇法不使用催化剂,可将回收的废弃食用油用于制备生物柴油,对油脂原料要求低,不需要预处理,反应时间短,工艺简单,无污染排放,具有明显的经济效益和社会效益。然而,反应条件苛刻,反应温度达300~400 ℃,压力10~15 MPa,设备投资大,工业化生产困难[60-61]。
微生物油脂可以通过萃取-酯交换法、直接醇解法和酯交换法制备微生物柴油。周力等[62]研究了干藻直接转化制备生物柴油的工艺,直接转化法在最优条件下得到生物柴油转化率为(7.56±0.37)%,而传统两步法(正丙醇-正己烷-水萃取+转化法,Bligh-Dyer法萃取+转化法)在最优条件下得到生物柴油转化率分别为(4.24±0.45)%、(7.77±0.44)%,结果表明直接转化法C16~C18总含量最高,能够得到较高品质的生物柴油,省去了传统两步法中的萃取、浓缩等耗能步骤,具有明显优点。
Johnson等[63]分别采用两步法和一步法研究了裂殖壶菌酯交换制备生物柴油,当干菌株采用两步法制备生物柴油时,微生物柴油产生率为98.4%;用湿菌株、萃取溶剂和醇类混合后直接反应时,微生物柴油得率很高,若不加入萃取溶剂最终产率只有12.7%,且直接转酯化获得的生物柴油基本符合ASTM标准。
4 展 望
能源问题将成为人类长期关注的问题,随着微生物油脂研究与开发技术的日益成熟与工业化,微生物油脂完全有可能成为生物柴油的重要原料来源。然而,目前还未实现规模化生产,要实现微生物油脂产业化的关键是降低成本,寻找廉价、可规模化采集的油脂资源。未来的发展可从以下几个方面探索: 1)探索廉价碳源用于产油脂的微生物发酵,促进微生物油脂产业化,结合工业排放的废气、废液、废料等培养菌株,不仅可以减少温室气体的排放和减少污染,还可以降低生产成本;2)进行产油微生物菌种的筛选、改良、培育的研究,对发酵产油脂工艺进行优化;3)对野生菌株进行诱变、细胞融合、定向进化和基因改造,以获得高产油菌株;4)创制菌株破壁节能、低密度采集与酶法破壁偶联提取胞内微生物油脂技术,以降低生物柴油制取成本;5)开发生物柴油气液两相法专用介孔催化剂及再生技术,创制油脂气液低压酯化预处理关键技术。
[1]CRABBLE E,NOLASCD-HIPOLITO C,KOBAYASHI G. Biodiesel production from crude palm oil and evaluation of butanol extration and fuel properties[J]. Process Biochemistry,2001,37(1):65-71.
[2]KRAWCZYK T. Biodiesel-alternative fuel makes inroads but hurdles remain[J]. Inform,1996,7(8):800-815.
[3]忻耀年. 生物柴油的发展现状和应用前景[J].中国油脂,2005,30(3):49-53.
[4]ALCANTARA R,AMORS J,CANOIRA L,et al. Catalytic production of biodiesel from soy-bean oil used frying oil and tallow[J]. Biomass and Bioenergy,2000,18(6):515-527.
[5]李建政,汪群慧.废物资源化与生物能源[M].北京:化学工业出版社,2004:48-53.
[6]黎雨轩.美国:微藻、酵母和细菌是生物柴油的理想选择[J].渔业信息与战略,2013(1):86-87.
[7]颜治,陈晶.微生物油脂及其开发利用研究进展[J].粮食与油脂,2003(7):13-15.
[8]郑建仙,耿立萍.功能性食品基料:γ-亚麻酸[J].食品与发酵工业,1996(1):49-55.
[9]XU Han,MIAO Xiao-ying,WU Qing-yu. High quality biodiesel production from a microalgaChlorellaprotothecoidesby heterotrophic growth in fermenters[J]. Journal of Biotechnology,2006,126(4):499-507.
[10]胡芳华,殷福珊.产油酵母——可再生油脂的潜在资源[J].日用化学品科学,2009,32(4):12-13.
[11]蒲海燕,贺稚非,刘春芬,等.微生物功能性油脂研究概况[J]. 粮食与油脂,2003(11):12-14.
[12]薛飞燕,张栩,谭天伟.微生物油脂的研究进展及展望[J].生物加工过程,2005,3(1):23-27.
[13]顾家瑞.微藻制油产业化先过成本关[J].石油知识,2013(5):26-27.
[14]刘俊利.粮油仓储科技通讯[J].粮食检测与加工,2004(1):50-51.
[15]杨黎.微藻能源技术研发展望[J].中国工程咨询,2013(3):38-40.
[16]张峻,邢来君,王红梅.γ-亚麻酸高产菌株的选育及发酵产物的分离提取[J].微生物油脂,1993,20(3):140-143.
[17]罗玉萍,杨荣英,李思光,等.产棕榈油酸酵母菌的分离和鉴定[J].微生物学报,1995,35(6):400-403.
[18]施安辉,谷劲松,刘淑君,等.高产油脂粘红酵母GLR513菌株的选育[J].山东食品发酵工程,1997(2):12-18.
[19]缪晓玲.藻类可再生能源的利用及藻细胞抗环境胁迫的研究[D].北京:清华大学博士学位论文,2004.
[20]GILL C O,HALL M J,RATLEDGE C. Lipid accumulation in an oleaginous yeast (Candida107) growing on glucose in single-stage continuous culture[J]. Applied and Environmental Microbiology,1977,33(2):231-239.
[21]YI Shao-jin,ZHENG Yi-ping. Research and application of oleaginous microorganism[J]. China Foreign Energy,2006,11(2):90-94.
[22]PATNAYAK S,SRE A. Screening of bacterial associates of marine sponges for single cell oil and PUFA[J]. Letters in Applied Microbiology,2005,40(5):358-363.
[23]KAVADIA A,KOMAITIS M,CHEVALOT I,et al. Lipid andγ-linolenic acid accumulation in strains ofZygomycetesgrowing on glucose[J]. Journal of the American Oil Chemists' Society,2001,78(4):341-346.
[24]XIN Meng,YANG Jian-ming,XU Xin,et al. Biodiesel production from oleaginous microorganisms[J]. Renewable Energy,2009,34(1):1-5.
[25]赵宗保.加快微生物油脂研究为生物柴油产业提供廉价原料[J].中国生物工程杂志,2005,25(2):8-11.
[26]郑红波,刘光华,李昕然,等.产油微生物菌种的筛选、鉴定及其油脂组成分析[J].四川大学学报,2010,47(6):1397-1401.
[27]叶思特,郭丽琼,刘晓蓉,等.产油微生物的筛选[J].华南农业大学学报,2012,33(3):384-387.
[28]BOTHAM P A,RATLEDGE C. A biochemical explanation for lipid accumulation inCandida107 and other oleaginous micro-organisms[J]. Journal of General Microbiology,1979,114(2):361-375.
[29]LEKCHAROENSUK P,MOROZOV I,PAUL P S,et al. Epitope mapping of the major capsid protein of type 2 porcine circovirus (PCV2) by using chimeric PCV1 and PCV2[J]. Journal of Virology,2004,78(15):8135-8145.
[30]MATA T M,MARTINS A A,CAEETANO N S. Microalgae for biodiesel production and other applications:A review[J]. Renewable and Sustainable Energy Reviews,2010,14(1):217-232.
[31]LI Yan-qun,HORSMAN M,WU Nan,et al. Biofuels from microalgae[J]. Biotechnology Progress,2008,24(4):815-820.
[32]RODOLFI L,CHINI ZITTELLI G,BASSI N,et al. Microalgae for oil:Strain selection,induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor[J]. Biotechnology and Bioengineering,2009,102(1):100-112.
[33]MOAZAMI N,RANJBAR R,ASHORIS A,et al. Biomass and lipid productivities of marine microalgae isolated from the Persian Gulf and the Qeshm Island[J]. Biomass and Bioenergy,2011,35(5):1935-1939.
[34]杨建斌,陈明锴,汤世华,等.超声波辅助制备微生物柴油的研究[J].武汉工业学院学报,2008,27(1):23-27.
[35]姜剑锋,赵丽芹,陈涛,等.寇氏隐甲藻不同破壁方法的研究[J].中国粮油学报,2011,26(8):92-94.
[36]孟国庆,王传宝,朱陶,等.啤酒废酵母细胞破壁方法的研究[J].中国果菜,2014,34(12):30-34.
[37]万其兵,刘丽丽,杨秀英. 真菌细胞破壁方法的研究[J]. 天津师范大学学报:自然科学版,2004,24(4):38-40.
[38]单振秀,江澜,王宜林. 富硒酵母细胞壁破碎方法的比较——细胞自溶法和酸-热破碎法[J]. 西南大学学报:自然科学版,2001,23(4):365-367.
[39]孔凡敏,赵祥颖,田延军,等.酸热法提取酵母油脂条件的研究[J].山东食品发酵,2009(4):28-31.
[40]FANG Jia-song,KATO C,SATO T,et al. Biosynthesis and dietary uptake of polyunsaturated fatty acids by piezophilic bacteria[J]. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology,2004,137(4):455-461.
[41]孙晓璐,孙玉梅,曹芳,等.对产油脂酵母的细胞破碎方法及油脂提取效果的比较[J].河南工业大学学报,2007,28(4):67-69.
[42]曹雁平,刘佐才. 化工进展[M].北京:化学工业出版社,2005.
[43]孙利芹,王长海,江涛. 紫球藻细胞破碎方法研究[J]. 海洋通报,2004,23(4):71-74.
[44]林杰. 裂殖壶菌粉的复合酶酶解破壁工艺研究[J]. 福建轻纺,2012(8):29-33.
[45]CHENG Chen-hsi,DU Tz-bang,PI Hsien-chueh,et al. Comparative study of lipid extraction from microalgae by organic solvent and supercritical CO2[J]. Bioresource Technology,2011,102(21):10151-10153.
[46]刘宪夫,孙利芹,王长海.小球藻油脂不同提取方法的比较[J].食品研究与开发,2014,35(3):18-22.
[47]张文成. 超临界 CO2萃取-结晶强化措施研究进展[J]. 食品科学,2007,28(8):514-517.
[48]HALIM R,GLADMAN B,DANQUAH M K,et al. Oil extraction from microalgae for biodiesel production[J]. Bioresource Technology,2011,102(1):178-185.
[49]COUTO R M,SIMOES P C,REIS A,et al. Supercritical fluid extraction of lipids from the heterotrophic microalgaCrypthecodiniumcohnii[J]. Engineering in Life Sciences,2010,10(2):158-164.
[50]MA Fang-rui,HANNA M A. Biodiesel production:A review[J]. Bioresource Technology,1999,70(1):1-15.
[51]DAI Chuan-chao,TAO Jie,XIE Feng,et al.Biodiesel generation from oleaginous yeastRhodotorulaglutiniswith xylose assimilating capacity[J].African Journal of Biotechnology,2007,6(18):2130-2134.
[52]刘会影,薛冬桦,潘安龙,等.微生物油脂酯化工艺优化[J].中国生物工程杂志,2013,33(3):92-98.
[53]里伟,杜伟,李永红,等.生物酶法转化酵母油脂合成生物柴油[J].过程工程学报,2007,4(1):137-140.
[54]TRAN D T,YEH K L,CHEN Ching-lung,et al. Enzymatic transesterification of microalgal oil fromChlorellavulgarisESP-31 for biodiesel synthesis using immobilizedBurkholderialipase[J]. Bioresource Technology,2012,108:119-127.
[55]MOHAMED M S,UWE T B. Improvement in lipase-catalyzed synthesis of fatty acid methyl esters from sunflower oil [J]. Enzyme Microbiol,2003,33(1):97-103.
[56]LINKO Y Y,TERVAKANGAS T,LAMSA M,et al. Production of trimethylolpropane esters of rapeseed oil fatty acids by immobilized lipase[J].Biotechnology Techniques,1997,11(12):889-892.
[57]李昌珠,蒋丽娟,程树棋.生物柴油——绿色能源[M].北京:化学工业出版社,2005.
[58]侯相林,乔欣刚,齐永琴,等.亚临界甲醇相固体碱催化大豆油酯交换制备生物柴油[J].中国油脂,2006,31(10):37-40.
[59]张贵芝,王勇,曹宁,等.微藻超临界甲醇直接酯交换法制备生物柴油[J].生物质化学工程,2012,46(1):6-10.
[60]HE Hua-yang,WANG Tao,ZHU Shen-lin. Continuous production of biodiesel fuel from vegetable oil using supercritical methanol process[J]. Fuel,2007,86(3):442-447.
[61]DEMIRBAS A. Biodiesel from vegetable oils via transesterification in supercritical methanol[J]. Energy Conversion and Management,2002,43(17):2349-2356.
[62]周力,王松松,孙源,等.酸前处理微藻制备生物柴油工艺研究[J].中国油脂,2013,38(11):61-63.
[63]JOHNSON M B,WEN Zhi-you. Production of biodiesel fuel from the microalgaSchizochytriumlimacinumby direct transesterification of algal biomass[J]. Energy & Fuels,2009,23(10):5179-5183.
《林业科技开发》更名为《林业工程学报》的启事
根据林业工程学科的发展需要和读者建议,经研究,并报请国家新闻出版广电总局批准(新广出审[2015]868号),《林业科技开发》将自2016年起更名为《林业工程学报》,刊号为CN32-1862/S。更名后,期刊的办刊方针和报道内容将作必要调整。
《林业工程学报》的办刊方针为:以精品化、国际化为向导,重点报道木材科学与技术、林产化学加工工程、装备与信息化、森林工程、家具设计与制造等方面的科研成果和最新进展,大力促进林业工程学科的科研创新和学术交流,培养高层次林业工程人才,推动我国林业工程学科向更高水平发展。
期刊目前为中文核心期刊、中国科技核心期刊、RCCSE中国核心学术期刊和中国农业核心期刊,被国内外多家数据库收录。更名后原有的期刊数据和评价结果将予以继承,编辑部将在此基础上努力将期刊办出更高水平。
《林业工程学报》主要栏目有木材科学与技术、林产化学工程、装备与信息工程、家具设计与制造、森林工程等。双月刊,大16开,120页,公开发行,刊号CN32-1862/S,邮局发行代号28-103,单价:20元/册,全年120元,逢单月25日出版。
编辑部电话:025-85427227,85427298;http:∥lkkf.njfu.edu.cn;E-mail:lkkf@vip.163.com,lygcxb@vip.163.com;地址:210037南京市龙蟠路159号南京林业大学内《林业工程学报》编辑部。
《林业工程学报》编辑部
Research Status and Development Trendency ofBiodiesel Preparation from Microbial Lipid
LI Xiao-ying1, NIE Xiao-an1,2, CHEN Jie1, WANG Yi-gang1
(1.Institute of Chemical Industry of Forest Products,CAF;National Engineering Lab.for Biomass Chemical Utilization;Keyand Open Lab.of Forest Chemical Engineering,SFA;Key Lab.of Biomass Energy and Material,Jiangsu Province,Nanjing 210042, China; 2.Research Institute of Forestry New Technology,CAF, Beijing 100091, China)
The classification and research situation of oleaginous microorganisms were reviewed. The quality standards of China and other countries were compared. The production technology of microbial lipid and explained in this paper. They included the pretreatment of microbial cell, extraction and refinement of microbial lipid, and preparation of micro-biodiesel. In addition, the prospect of microbial lipid was proposed.
microbial lipid; research situation; production technology; prospect
10.3969/j.issn.1673-5854.2015.06.008
2015- 06- 18
“十二五”国家科技支撑计划资助(2014BAD02B02)
李小英(1990—),女,湖北孝感人,硕士生,主要从事微生物油脂炼制生物质燃料油
*通讯作者:聂小安(1966—),男,江西安乐人,研究员,博士,硕士生导师,主要从事环氧树脂、固化剂、胶黏剂以及生物质液体能源的科研及产业化工作;E-mail:niexiaoan@126.com。
TQ35
A
1673-5854(2015)06- 0037- 08
