高产虫草素Cordyceps militaris 菌的诱变育种
2015-02-23曹照平,周广麒,杨吉祥,武博,金美芳,王亚芳
曹 照 平,周 广 麒,杨 吉 祥,武 博,金 美 芳,王 亚 芳
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
Cordycepin(虫草素,即3′-脱氧腺苷),又名蛹虫草(Cordycepsmilitaris)菌素,是一种细胞毒性试剂和腺苷的结构类似物[1],能抑制枯草杆菌、鸟结核杆菌、炭疽杆菌、猪出血性败血症杆菌等病原菌的生长,尤以对枯草杆菌的抑制作用最强[2-3]。但Cordycepin 在C.militaris中的含量很低,传统的选育方法为原生质体紫外辐射和吖啶橙、亚硝基胍等理化因子诱变[4-6],新兴的方法有离子注入、近红外光谱法诱变[7]等。李文等[8]利用低能离子束修饰C.militaris菌株提高Cordycepin产量。Das等[9]利用高能离子束辐照方法,筛选得到8-氮鸟嘌呤抗性突变株C.MilitarisG81-3,使发酵液中Cordycepin的产量达到3.1g/L,比出发菌株提高了72%。本研究通过超声波联合硫酸二乙酯(DES)复合诱变C.militaris菌,针对性的筛选黄嘌呤和鸟嘌呤双重营养缺陷型(Xan-+Gua-)株,其Cordycepin产量与亲株相比明显提高,为Cordycepin的规模化生产提供有力的理论和技术支持。
1 材料与方法
1.1 材 料
1.1.1 菌 株
CordycepsmilitarisFFCC5111,大连工业大学食品发酵微生物菌培养与保藏中心提供。
1.1.2 培养基
基本培养基:硝酸钠3g/L,磷酸氢二钾1g/L,MgSO4·7H2O 0.5g/L,氯化钾0.5g/L,蔗糖30g/L,琼脂20g/L,补足水至1 000mL。
活化培养基:葡萄糖40g/L,酵母粉10g/L,Xanthine 0.1g/L,Guanine 0.1g/L,pH 7.0。
发酵培养基Ⅰ:取马铃薯200g→去皮→切碎→加水煮沸→滤液,加入葡萄糖20g,维生素B110mg,加水至1 000mL,pH 自然。固体培养需加入琼脂20g。
发酵培养基Ⅱ:葡萄糖40g/L,酵母粉15g/L,MgSO4·7H2O 0.5g/L,K2HPO4·3H2O 0.5g/L,KH2PO40.5g/L,Guanosine 0.1g/L。
补充培养基:在基本培养基中添加Xanthine 100μg/mL和Guanine 100μg/mL,pH 7.0。
1.1.3 试 剂
Xanthine,Guanine,Guanosine,Cordycepin标准品,Sigma公司。
1.1.4 主要仪器和设备
UV-5200紫外分光光度计,旋转蒸发仪,真空冷冻干燥机,MJL07-5超声-微波反应器,MJ33万分之一电子天平,摇瓶/振荡机,高压蒸汽灭菌锅,超净工作台。
1.2 试验方法
1.2.1 单孢子悬液的制备
将C.MilitarisFFCC5111菌种转接于发酵培养基Ⅰ中,26 ℃、160r/min摇瓶培养6d,无菌过滤,滤取孢子,制备单孢子[10]悬液,无菌生理盐水稀释使孢子浓度为106~107个/mL。
1.2.2C.militaris的诱变
1.2.2.1 超声波诱变条件的确定
超声波功率为200 W,22kHz。将单孢子悬液置于冰水浴中,经过超声波诱变处理60 min后,从中吸取菌液0.1 mL 涂布于完全培养基凝固平板中,26 ℃培养7d,检查培养平板中的单菌落数,计算致死率,并确定超声波诱变的时间。同时做对照试验。
致死率=(A-B)/A×100%
式中:A为未经超声波诱变的对照平皿中的单菌落数;B为经超声波诱变后平皿中的单菌落数。
1.2.2.2 DES诱变条件的确定
用无菌的磷酸盐缓冲液(磷酸氢二钠-磷酸二氢钠缓冲液,0.1mol/L,pH 7.0),梯度稀释单孢子悬液至10-1,10-2,10-3和10-4倍,分别加入DES溶液使体积分数达到1%,振荡诱变45min。吸取1mL各稀释度诱变菌液至试管中,加入硫代硫酸钠溶液(250g/L)0.5mL 终止反应,再从中吸取0.1 mL 涂布于完全培养基凝固平板上,26 ℃培养到第7 天,检查培养平板中的单菌落数,计算致死率,并确定DES诱变的时间。
1.2.2.3 复合诱变
取稀释度为10-3倍的单孢子悬液8 mL,加入磷酸盐缓冲液和DES溶液,在冰水浴中先后进行超声波和DES 交替复合诱变处理,并从0~60min选择最佳的诱变时间,使得涂于培养平板中基本培养基上的细胞致死率为75%~90%。
1.2.3 营养缺陷型菌株的筛选
1.2.3.1 缺陷型的检出
吸取1mL 诱变液倒入基本培养基中混匀,制成夹层培养基平板(夹层培养基平板共有3层,自下至上依次为不含菌的基本培养基、混有诱变菌液的基本培养基、不含菌的基本培养基)。26 ℃培养后,对首次出现的菌落作标记,然后再向皿内倒入一层(第4层)补充培养基。继续培养后,长出的形态较小的新菌落,即为疑似Xan-和Gua-营养缺陷型突变株[11]。
1.2.3.2 缺陷型的验证
将疑似Xan-和Gua-营养缺陷型突变株依次接种在基本培养基、基本培养基+Xanthine、基本培养基+Xanthine+Guanine上,仅在后者长出的菌就是Xan-和Gua-双重营养缺陷型菌株[12]。
1.2.3.3 高产Cordycepin菌株的获得
作为次生代谢产物的Cordycepin 具有抗菌作用[2-3]。将获得的Xan-+Gua-双重营养缺陷型突变株接种于发酵培养基Ⅱ中,160r/min、26 ℃摇瓶培养6 d。通过冷冻干燥法制备Cordycepin试样。将指示菌B.subtilis悬液均匀涂于细菌培养基平板上,取10μL Cordycepin样液于直径0.4cm 的滤纸片上,放在指示菌平板上,37 ℃培养过夜,观测各个突变株对B.subtilis生长的抑菌圈,评定Cordycepin的生产能力。
1.2.3.4 复 筛
在100 mL 的发酵培养基Ⅱ中接种10%,160r/min、26 ℃培养16d,期间从第6天开始检测生物量、葡萄糖含质量浓度Cordycepin 生成量,最终选定高产菌株。
1.2.4 Cordycepin的提取及检测
将发酵液4 000r/min离心15min,过滤,清液置于旋转蒸发仪蒸发浓缩,浓缩液加超纯水定容至100mL,待测。
将菌体用蒸馏水反复洗涤,于-50 ℃真空冷冻干燥获得冻干菌体,放入干燥器维持恒重。精确称取0.500g冻干菌溶于10mL 超纯水中,利用超声波提取Cordycepin。提取后10 000r/min离心15min,过滤,取上清液,反复提取2 次,定容至25mL。超声条件:100 W,60 ℃,40min。
将发酵液及冻干菌提取液适当稀释,利用紫外分光光度计测定Cordycepin的含量。
1.2.5 生物量测定
将发酵液4 000r/min离心15min,过滤,蒸馏水反复洗涤,于-50 ℃真空冷冻干燥后,冻干菌体放入干燥器保持恒重,用分析天平称量。
生物量/(g·L-1)=菌丝体干重/发酵液体积
2 结果与分析
2.1 诱变菌最佳稀释度的确定
将单孢子悬液取稀释度分别为10-1,10-2,10-3,10-4,检验诱变因子超声波和DES 分别对出发菌株C.militarisFFCC5111的影响。如表1所示,当稀释度为10-3时,致死率分别为88.17%和85.47%。通常当微生物致死率在75%~90%时,发生正向突变的概率最高,因此确定10-3为最佳诱变稀释倍数。
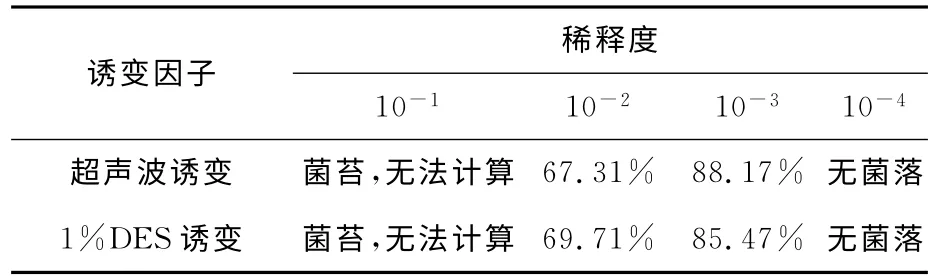
表1 诱变因子超声波和DES对菌液稀释倍数的影响Tab.1 Effect of mutagenic factors ultrasound and diethyl sulfate on the germ liquid dilution ratio
2.2 最佳诱变时间的确定
按照“1.2.2”所述的超声波诱变、DES 诱变和复合诱变3种方法,检测处理时间从0~60min对出发菌株致死率的影响。稀释度均取10-3。结果如图1所示。由图1 可知,3 种诱变方案的致死率随作用时间延长而增大,且复合诱变强度要高于单因子诱变强度。当诱变时间达到60min时,诱变因子超声波和DES 作用于单孢子悬液的致死率分别为77.17%和89.76%。而当复合诱变35 和45 min 时,致死率分别为83.33%和88.56%,均比较适合筛选;当60 min时,致死率达到95%。但无论从诱变强度还是诱变效果看,采用超声波联合DES复合诱变均优于单因子诱变。最终选用的最佳复合诱变条件为:1%DES,200 W、22kHz超声强度,处理45min。

图1 不同诱变时间的菌株致死率Fig.1 Strain death rate under different treatment time
2.3 营养缺陷型的筛选
根据“1.2.3.3”所述方法,将获得的Xan-+Gua-双重营养缺陷型突变株进行摇瓶培养/发酵6d,将菌体冷冻干燥后制备Cordycepin,在指示菌B.subtilis平板上进行抑菌试验,结果见图2。如图2所示,根据“1.2.3”方法筛选鉴定出双营养缺陷型(Xan-+Gua-)共7株,检测摇瓶培养/发酵至16d时溶液中Cordycepin 的产量,结果见表2。

图2 双营养缺陷型(Xan-+Gua-)抗菌活性Fig.2 Antibacterial activity of double auxotroph mutant(Xan-+Gua-)strain
由图2 和表2 可见,发酵16d 时发酵液中Cordycepin产量与在B.subtilis平板上抑菌圈直径结果一致。诱变菌株C.militarisFFCC5111-c的抑菌圈最大,同时生产的Cordycepin 能力较C.militarisFFCC5111提高了约40.2%。

表2 双营养缺陷型(Xan-+Gua-)突变株和原始菌株Cordycepin产量Tab.2 Cordycepin production of double auxotroph mutant(Xan-+Gua-)and original strain
2.4 摇瓶培养/发酵过程中生物量和Cordycepin的变化
虫草菌在培养和发酵过程中,生物量将会增长达到几乎恒量,在0~20g/L 葡萄糖含量线性降低,双营养缺陷型(Xan-+Gua-)突变株C.militarisFFCC5111-c合成Cordycepin 的能力明显提高,见图3、图4。
由图3可知,发酵第6 天,C.militarisFFCC5111菌已进入对数生长期,至第10天生物量达到最高为21.2g/L,然后略有下降,随后基本上维持稳定;而C.militarisFFCC5111-c细胞生长速度略慢于亲株,但其葡萄糖消耗速率大于亲株。比较图4,可能的原因是C.militarisFFCC5111-c的遗传物质发生了改变,合成Cordycepin能力有了明显提升。
原始菌株C.militarisFFCC5111培养/发酵至第16 天,发酵液中Cordycepin 积累量达到2.85g/L;菌体内的积累量则在第10天达到峰值3.124 mg/g。双突变株C.militarisFFCC5111-c的发酵液中Cordycepin不断积累,第16 天达到最大3.995g/L;其在菌体内的积累量6~13d几乎线性增长,第13天达到峰值7.924mg/g,随后略有下降。最高值突变株比出发株分别提高了1.41和2.54倍(图4)。

图3 C.militaris FFCC5111-c和C.militaris FFCC5111发酵过程生物量与葡萄糖消耗变化Fig.3 Biomass and glucose consumption of C.militaris FFCC5111-c and C.militaris FFCC5111in fermentation process
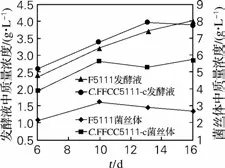
图4 不同发酵时间发酵液和菌丝体Cordycepin的积累变化Fig.4 Cordyceps accumulation of Cordyceps militaris fermentation broth and mycelium at different fermentation time
3 讨论与结论
本研究利用一株生长性状优良的Cordyceps militarisFFCC5111为出发菌株,采用超声波联合DES复合诱变技术,通过抗菌实验初筛、摇瓶培养/发酵复筛,针对性的筛选出双重营养缺陷型菌株(Xan-+Gua-)C.militarisFFCC5111-c。突变株经过摇瓶培养/发酵至第16 天,C.militarisFFCC5111-c培养/发酵产生的Cordycepin总量为4.142g/L,比亲株提高了44.5%。试验证明,筛选Xanthine和Guanine双重缺陷型突变株是获得Cordycepin高产菌种行之有效的方法之一,同时也验证了Cordycepin的生产与鸟嘌呤是彼此相关的[13]。
Cordycepin提取的方法目前有许多报道,有柱层析法(CCE)[14]、微波法和超声法提取虫草素[15]。但超声提取方法更快捷简便且准确度高,因此采用超声法提取虫草素。本试验采用-40~-50 ℃冷冻干燥法(菌体部分)和减压浓缩法(液体部分)。超声波是频率高于20kHz的声波,穿透能力强,方向性好,可以改变细胞壁膜结构,使细胞内外发生物质交换。硫酸二乙酯(DES)是一种诱变谱较为广泛的烷化剂,能与DNA 中碱基的磷酸部分发生烷化作用,从而引起DNA 复制时碱基配对的转换或颠换。复合诱变因子的使用,可以提高诱变的效率。据试验结果判断,嘌呤核苷酸的代谢途径中IMP→XMP→GMP的代谢支路可能被切断,使代谢前体物质IMP较多地合成腺苷,进一步合成Cordycepin[16]。
[1]苏哈道尼克.核苷类抗菌素[M].谢其明,王恕蓉,译.北京:科学出版社,1982:58-84.
[2]SUGAR A M,McCAFFREY R P.Antifungal activity of 3′-deoxyadenosine[J].Antimicrobial Agents and Chemotherapy,1998,42(6):1424-1427.
[3]AHN Y J,PARK S H,LEE S C,et al.Cordycepin:Selective growth inhibitor derived from liquid culture ofCordycepsmilitarisagainst clostridium SPP[J].Journal of Agricultural and Food Chemistry,2000,48(7):2744-2748.
[4]周礼红,王仕敏,罗丽美.高产虫草菌素蛹虫草菌株的紫外线诱变选育[J].食用菌,2009,31(4):20-21.
[5]莫红丽.吖啶橙诱变提高蛹虫草虫草素含量的研究[J].广东蚕业,2011,45(2):23-26.
[6]翟景波,滕利荣,黄宝玺.高产蛹虫草菌株的选育[J].中国生物制品学杂志,2011,24(10):1230-1232.
[7]郭伟良,张卓勇,逯家辉,等.近红外光谱法在蛹虫草诱变筛选及其发酵条件优化中应用[J].2010,30(8):2077-2082.
[8]李文,赵世光,陈宏伟,等.低能离子束修饰蛹虫草菌株高产虫草素[J].生物工程学报,2009,25(11):1725-1731.
[9]DAS S K,MASUDA M,HATASHITA M,et al.A new approach for improving cordycepin productivity in surface liquid culture ofCordycepsmilitarisusing high-energy ion beam irradiation[J].Letters in Applied Microbiology,2008,47(6):534-338.
[10]周广麒,戴娜.响应面法优化虫草培养的研究[J].中国酿造,2011(1):112-115.
[11]周德庆.微生物学教程[M].北京:北京高等教育出版社,2002:221-223.
[12]王小茹,乔宾福,袁勤生.抗8-氮鸟嘌呤腺苷产生菌的选育[J].中国生化药物杂志,2003,24(5):224-226.
[13]MASUDA M,URABE E,HONDA H,et al.Enhanced production of cordycepin by surface culture using the medicinal mushroomCordycepsmilitaris[J].Enzyme and Microbial Technology,2007,40(5):1199-1205.
[14]NI He,ZHOU Xiao-hong,LI Hai-hang,et al.Column chromatographic extraction and preparation of cordycepin fromCordycepsmilitariswaster medium[J].Journal of Chromatography B,2009,877(22):2135-2141.
[15]黄子琪,贲松彬,桑育黎.微波法与超声破碎法提取蛹虫草菌丝体中虫草素的比较研究[J].食品科学,2009,30(18):176-180.
[16]LENNON M B,SUHADOLNIK R J.Biosynthesis of 3′-deoxyadenosine byCordycepsmilitaris:Mechanism of reduction[J].Biochimica et Biophysica Acta(BBA)-Nucleic Acids and Protein Synthesis,1976,425(4):532-536.
